میانبری برای تعیین هیبریداسیون یک اتم در یک مولکول
در اینجا میانبری برای چگونگی تعیین هیبریداسیون یک اتم در یک مولکول آورده شده است که حداقل در 95٪ مواردی که در Org 1 می بینید کار خواهد کرد.
برای یک اتم معین:
- تعداد را بشمار اتم ها به آن متصل است (اتم ها – نه اوراق قرضه!)
- تعداد را بشمار جفت های تنها به آن متصل شده است.
- اضافه کردن این دو عدد با هم
- اگر این است 4، اتم شما است sp3.
- اگر این است 3، اتم شما است sp2.
- اگر این است 2، اتم شما است sp.
(اگر 1 باشد، احتمالاً هیدروژن است!)
استثنای اصلی اتم هایی با جفت های تنها هستند که هستند مجاور به پیوندهای پی که در زیر به تفصیل در مورد آن صحبت خواهیم کرد.
فهرست مطالب
- چند نمونه کار ساده از میانبر هیبریداسیون
- نحوه تعیین هیبریداسیون یک اتم: دو تمرین
- آیا استثنایی وجود دارد؟
- استثنا شماره 1: جفت های تنها در مجاورت باندهای پی
- جفتهای تنها در اوربیتالهای P (در مقابل اوربیتالهای ترکیبی) همپوشانی مداری بهتری با سیستمهای Pi مجاور دارند
- استثنا شماره 2. محدودیت های هندسی
- “هندسه هیبریداسیون را تعیین می کند، نه برعکس”
- یادداشت
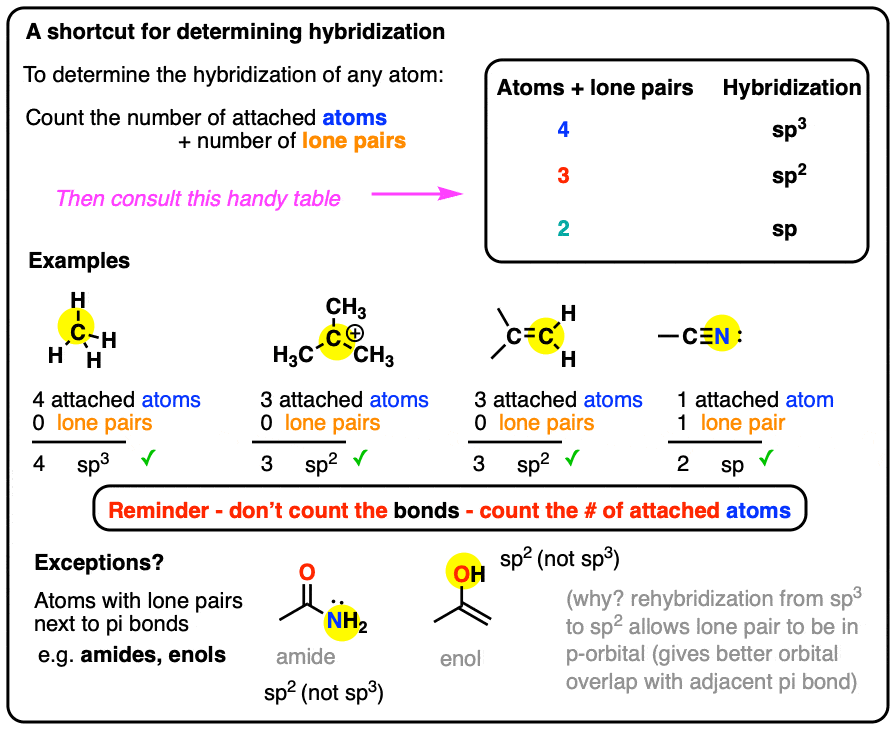
1. چند نمونه کار ساده از میانبر هیبریداسیون
sp3 هیبریداسیون: مجموع پیوست اتم ها + جفت های تنها = 4
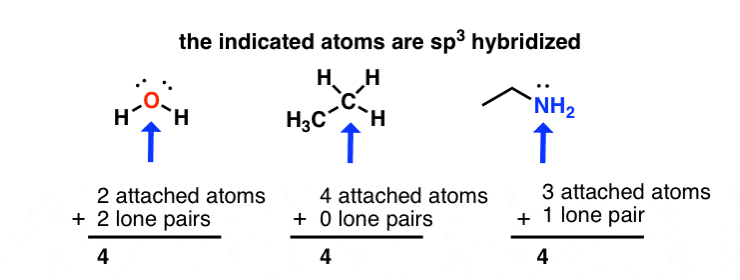
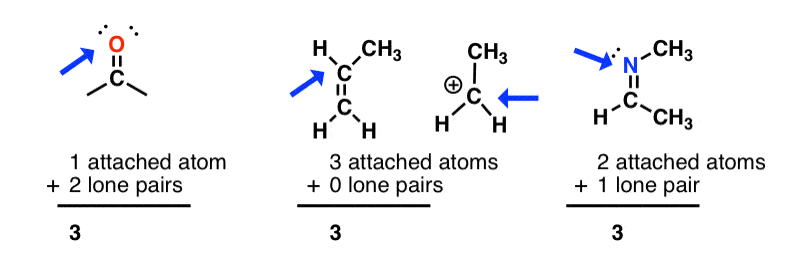
sp2 هیبریداسیون: مجموع پیوست اتم ها + جفت های تنها = 3
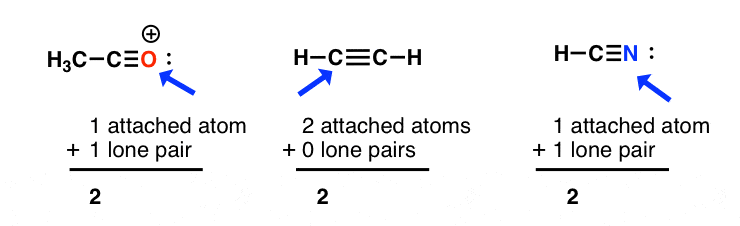
هیبریداسیون sp: مجموع پیوست اتم ها + جفت های تنها = 2
جایی که ممکن است کمی مشکل شود، برخورد با نمودارهای خطی است حاوی هیدروژن های ضمنی (“پنهان”) و جفت های تنها.
شیمیدانان مانند هر کس دیگری میانبرهای صرفه جویی در زمان را دوست دارند و یادگیری تفسیر سریع نمودارهای خطی به همان اندازه برای شیمی آلی اساسی است که یادگیری الفبای انگلیسی نوشتاری است.
یاد آوردن:
- فقط به این دلیل که جفت های تنها به اکسیژن، نیتروژن و فلوئور کشیده نمی شوند. نمی کند یعنی اونجا نیستن
- یک اکتت کامل را فرض کنید برای C، N، O و F با موارد زیر یکی استثنا: بار مثبت روی کربن نشان می دهد که فقط وجود دارد شش الکترون های اطراف آن [Nitrogen and oxygen bearing a formal charge of +1 still have full octets].
[Advanced: Note 1 covers how to determine the hybridization of atoms in some weird cases like free radicals, carbenes and nitrenes ]
2. نحوه تعیین هیبریداسیون یک اتم: دو تمرین
در اینجا یک تمرین است. سعی کنید هیبریداسیون اتمها را در این مولکول بسیار سمی که توسط قورباغهای با لباسخوابهای بد بو، در پایین سمت راست ساخته شده است، انتخاب کنید.
[Don’t worry if the molecule looks a little crazy: just focus on the individual atoms that the arrows point to (A, B, C, D, E). A and B especially. If you haven’t mastered line diagrams yet (and “hidden” hydrogens) maybe get some more practice and come back to this later.]
اینجا مثال های بیشتری است.
آزمونهای تمرینی بیشتری برای هیبریداسیون یافت میشود اینجا (عضویت MOC همه آنها را باز می کند)
3. آیا استثنا وجود دارد؟
مطمئن. اگرچه مانند بسیاری از موارد، توضیح میانبر حدود 2 دقیقه طول می کشد، در حالی که توضیح استثناها حدود 10 برابر بیشتر طول می کشد.
به طور مفید، این استثناها به دو دسته اصلی تقسیم می شوند. لازم به ذکر است که تا زمانی که دوره شما توضیح دهد که چرا این مثال ها استثنا هستند، احتمالاً بسیار فراتر از هیبریداسیون حرکت کرده است.
خط پایین: اینها احتمالاً در اولین میان ترم شما پیدا نخواهند شد.
4. استثنای شماره 1: جفت های تنها در مجاورت باندهای پی
استثنای اصلی مربوط به اتم هایی است که دارای جفت های تنها هستند در مجاورت پیوندهای پی
میانبر سریع: جفتهای تنها مجاور پیوندهای پی (و سیستمهای پی) تمایل دارند داخل باشند هیبرید نشده اوربیتال های p، به جای در sp هیبرید شدهn اوربیتال ها
این بیشتر برای نیتروژن و اکسیژن.
در موارد زیر، نیتروژن یا اکسیژنی که ممکن است انتظار داشته باشیم باشد sp3 هیبرید شده است در واقع sp2 هیبرید شده (مسطح مثلثی).
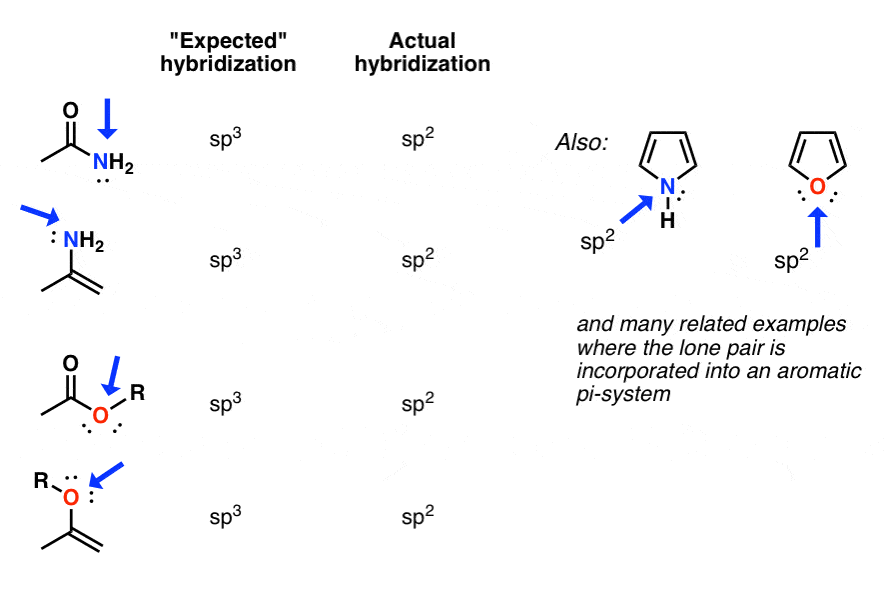
چرا؟ پاسخ سریع این است که کاهش انرژی از مزدوج اوربیتال p با پیوند پی مجاور بیش از افزایش انرژی به دلیل دافعه بیشتر جفت الکترون برای sp را جبران می کند2 در مقابل sp3
[see this post: “Conjugation and Resonance“]
جواب طولانی چیست؟
5. جفتهای تنها در اوربیتالهای P (در مقابل اوربیتالهای ترکیبی) همپوشانی مداری بهتری با سیستمهای Pi مجاور دارند.
بیایید به این فکر کنیم که چرا اتم ها در وهله اول هیبرید می شوند: به حداقل رساندن دافعه جفت الکترون.
برای یک آمین اولیه مانند متیلامین، پذیرش یک چهار وجهی (sp3هندسه با نیتروژن در مقابل یک صفحه مثلثی (sp2) هندسه حدود 5 کیلو کالری در مول ارزش دارد [roughly 20 kJ/mol].
ممکن است زیاد به نظر نرسد، اما برای دو گونه در تعادل، اختلاف 5 کیلوکالری بر مول در انرژی نشان دهنده نسبتی در حدود است. 4400:1]. [How do we know this? See this (advanced) Note 2 on nitrogen inversion]
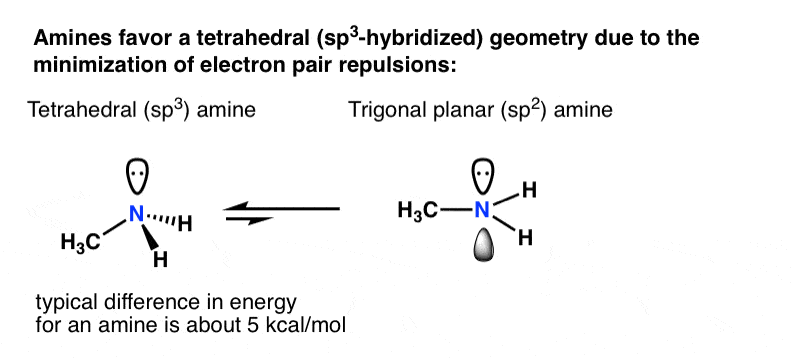
اگر یک اثر جبرانی وجود داشته باشد که به موجب آن یک جفت p-orbital هیبرید نشده در واقع پایدارتر از یک اوربیتال هیبرید شده باشد؟
معلوم می شود که در بسیاری از موقعیت ها که جفت تنها در مجاورت باند پی قرار می گیرد، این چنین است! رایج ترین و مهم ترین مثال آن است آمیدها، که پیوندهای بین اسیدهای آمینه را تشکیل می دهند. نیتروژن در آمیدها مسطح است (sp2)، نه هرمی مثلثی (sp3) همانطور که توسط کریستالوگرافی اشعه ایکس ثابت شده است.
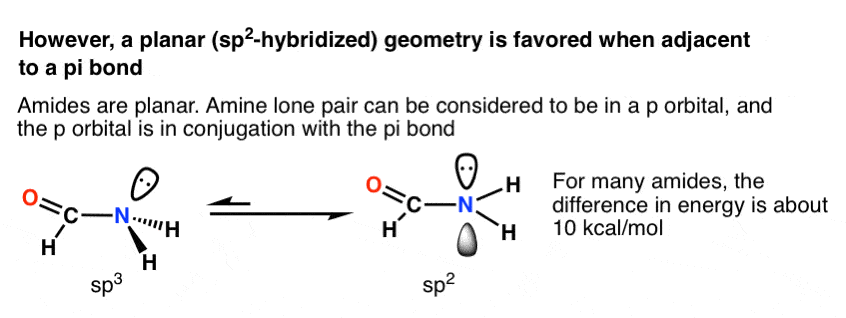
تفاوت در انرژی بسیار متفاوت است، اما یک مقدار معمولی حدود 10 کیلو کالری در مول است که به نفع هندسه مسطح مثلثی است. [We know this because many amides have a measurable barrier to rotation a topic we also talked about in the Conjugation and Resonance post]
چرا هندسه مسطح مثلثاتی در اینجا مورد علاقه است؟ همپوشانی اوربیتال بهتر اوربیتال p با پیوند pi در مقابل sp (هیبرید شده)3 مداری.
نقشه زیر سعی می کند نشان دهد که چگونه یک تغییر در هیبریداسیون از sp3 به sp2 اوربیتال p را به اوربیتال های p مجاور پیوند pi نزدیک می کند و امکان همپوشانی اوربیتال بهتر را فراهم می کند. همپوشانی مداری بهتر باعث ایجاد پیوند پی قویتر بین جفت نیتروژن تک و کربونیل p-اوربیتال میشود که منجر به کاهش کلی انرژی میشود. 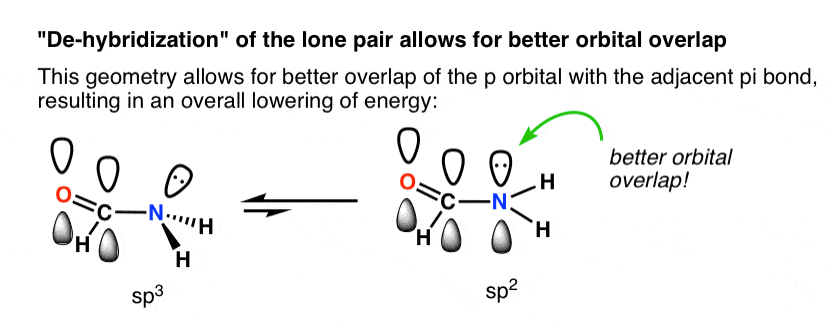
شما می توانید این را به عنوان منجر به یک پیوند C-N “جزئی” قوی تر در نظر بگیرید. دو پیامد مهم این برهمکنش، چرخش محدود در آمیدها، و همچنین این واقعیت است که اسید با آمیدهای اکسیژن واکنش میدهد، نه جفت نیتروژن تنها (!)
اکسیژن در استرها و انول ها همچنین sp2 هیبرید شده، همانطور که نیتروژن موجود در آن است میناها و نمونه های بی شمار دیگر
همانطور که احتمالاً در Org 2 خواهید دید، برخی از دراماتیک ترین موارد مواردی هستند که در آن جفت تنها “هیبریدزدایی شده” در یک سیستم معطر شرکت می کند. در اینجا، جبران انرژی برای تغییر در هیبریداسیون از sp3 به sp2 می تواند در واقع بسیار عالی باشد – در برخی موارد بیش از 20 کیلو کالری در مول.
به همین دلیل، اساسی ترین محل پیرول، جفت نیتروژن تنها نیست، بلکه روی کربن (C-2) است (!).
6. استثنای شماره 2. محدودیت های هندسی
مثال دیگری که در آن هیبریداسیون واقعی با آنچه ما از میانبر انتظار داریم متفاوت است در مواردی با محدودیت های هندسی است. به عنوان مثال در کاتیون فنیل زیر، کربن نشان داده شده دو اتم و صفر جفت تنها متصل است.
هیبریداسیون چیست؟
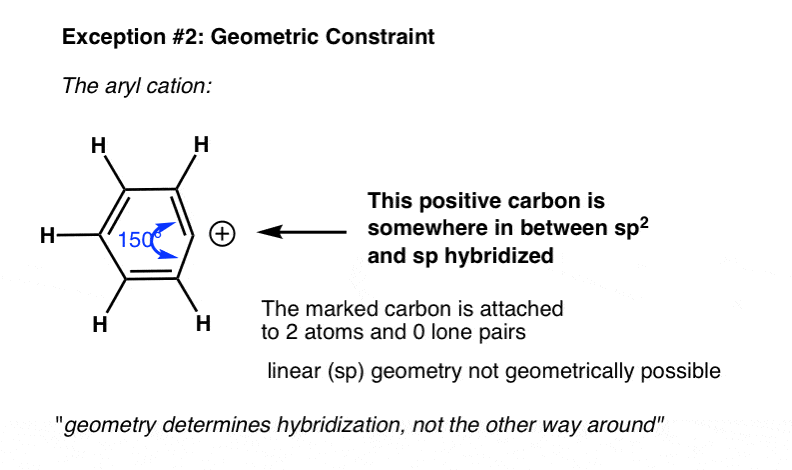
از میانبر ما، ممکن است انتظار داشته باشیم که هیبریداسیون انجام شود sp.
در واقع، هندسه اطراف اتم بسیار نزدیکتر به sp2. این به این دلیل است که کرنش زاویه ای که هندسه خطی (sp) را اتخاذ می کند منجر به کرنش زاویه ای بسیار زیادی می شود تا یک مولکول پایدار باشد.
7. “هندسه هیبریداسیون را تعیین می کند، نه برعکس”
نقل قولی که از مت به من منتقل شد مناسب به نظر می رسد:
“هندسه هیبریداسیون را تعیین می کند، نه برعکس”
خب، این احتمالاً بیشتر از آن چیزی است که می خواستید در مورد چگونگی تعیین هیبریداسیون اتم ها بدانید.
کافی است بگوییم، هر پستی از این سایت که حاوی میانبر در عنوان باشد، مطمئناً دارای بیش از 1000 کلمه و بیش از 10 رقم است.
با تشکر از مت پیرس از محلول های شیمی آلی برای کمک های مهم در این پست. از مت در مورد برنامه ریزی یک جلسه تدریس آنلاین در اینجا بپرسید.
یادداشت
پست های مرتبط
نکته 1. چند مورد عجیب و غریب.
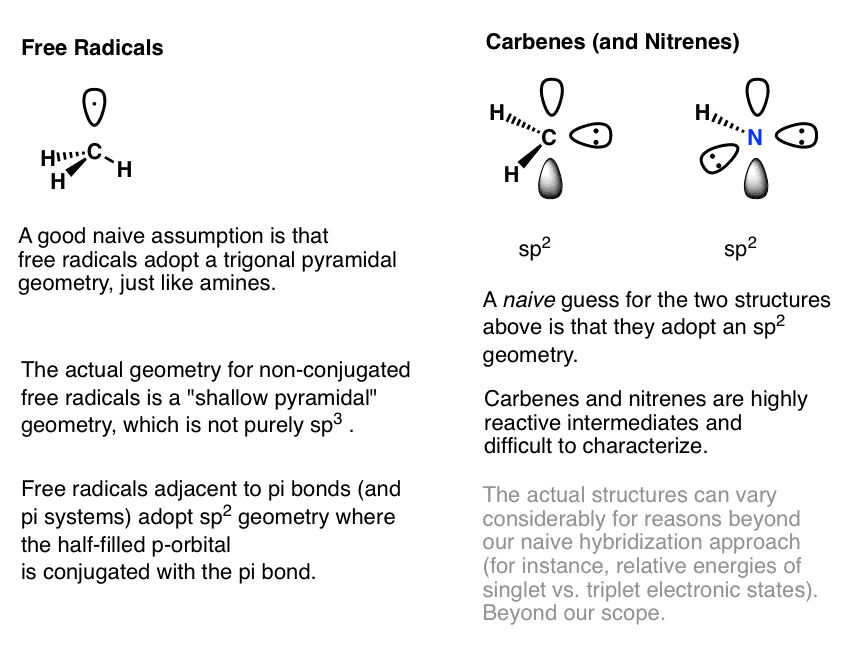
گاهی اوقات ممکن است از شما خواسته شود که هیبریداسیون را تعیین کنید رادیکال های آزاد و از کاربن ها (یا نیترن ها)
اگرچه بعید است که با این موارد روبرو شوید، بیایید همچنان نگاهی بیندازیم.
- رادیکال های آزاد در الف وجود دارند هرمی کم عمق هندسه، نه صرفاً sp2 یا sp3.
- با این حال، اگر آنها هستند مجاور به یک سیستم pi (به عنوان مثال یک پیوند دوگانه یا سه گانه CC) سپس هرم کم عمق خواهد شد دوباره هیبرید کنید به آن sp2 هندسه، که امکان کامل را فراهم می کند محلی سازی رزونانس از رادیکال آزاد
- کاربن ها و نیترن ها به ما sp2 هندسه با میانبر هیبریداسیون. با این حال، ساختار واقعی آنها می تواند بسته به وجود یا عدم وجود جفت الکترون در یک اوربیتال منفرد متفاوت باشد. تک نفره کاربن) یا به دو اوربیتال تک پر تقسیم می شود (الف سه قلو کاربن). این واقعاً فراتر از محدوده شیمی آلی مقدماتی است.
در مورد عناصر بلوک بالاتر مانند گوگرد و فسفر چطور؟
عناصر ردیف سوم مانند فسفر و گوگرد با ترکیب اوربیتال های d در هیبرید می توانند از یک هشت الکترون فراتر بروند. این بیشتر در حوزه شیمی معدنی است، بنابراین من واقعاً نمی خواهم در مورد آن بحث کنم. در اینجا یک مثال برای هیبریداسیون SF آورده شده است4 از جای دیگر (sp3اوربیتال d).
تبصره 2: برای رقم 5 کیلو کالری در مول اینجا را ببینید. [Tetrahedron Lett, 1971, 37, 3437]. (کورت میزلو، RIP.)
یک آمین متصل به سه جایگزین مختلف (R1 آر2 و R3) باید کایرال باشد، زیرا در مجموع دارای 4 جایگزین مختلف (از جمله جفت تنها) است. با این حال، تمام تلاش های اولیه برای تهیه آمین های خالص انانتیومر با شکست مواجه شد. بعداً مشخص شد که آمین ها تحت تأثیر قرار می گیرند وارونگی در دمای اتاق، مانند چتری که در اثر باد شدید به داخل به بیرون منتقل می شود.
در حالت گذار برای وارونگی نیتروژن مسطح مثلثی است. بنابراین می توان تفاوت انرژی بین sp را محاسبه کرد3 و sp2 هندسه با اندازهگیری مانع فعالسازی برای این فرآیند (به رجوع کنید).
نکته 3:یک ضد مثال جالب ممکن است کوئلنترازین باشد.
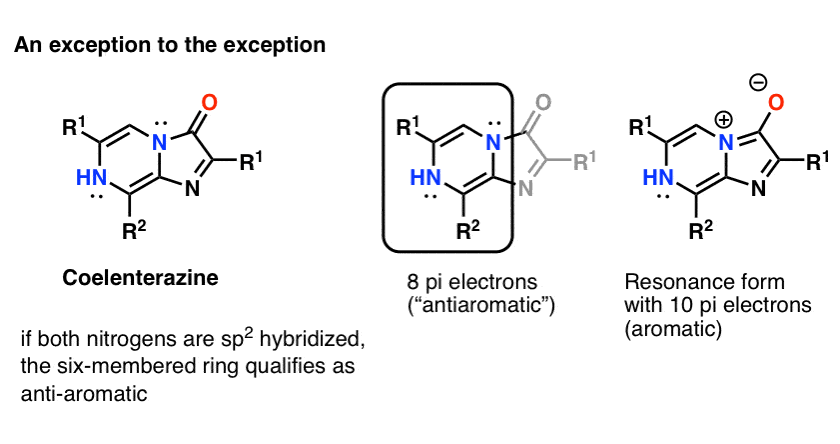
نمی توان انتظار داشت که هر دو اتم نیتروژن sp2 هیبرید شده، زیرا منجر به یک سیستم حلقوی، مسطح و مزدوج با الکترون 8 پی می شود: به عبارت دیگر، ضد آروماتیک. من نمی توانم ساختار کریستالی مولکول هسته را برای تأیید پیدا کنم (اما از هرگونه اطلاعات اضافی استقبال می کنم!)
توجه – (بعد اضافه شد) اگر فرم تشدید را ترسیم کنید که در آن جفت نیتروژن تنها با کربن کربونیل پیوند پی تشکیل می دهد، آنگاه سیستم حلقه دارای 10 الکترون است و بنابراین “آروماتیک” خواهد بود.
- مانع وارونگی هرمی نیتروژن در دی بنزیل متیل آمین
مایکل جی اس دوار و دبلیو برایان جنینگز
مجله انجمن شیمی آمریکا 1971 93 (2)، 401-403
DOI: 10.1021/ja00731a016 -
موانع وارونگی هرمی: اهمیت هندسه حالت پایه
جوزف استک هاوس، ریموند دی باچلر، کرت میزلو
حروف چهار وجهی جلد 12، شماره 37، 1971، صفحات 3437-3440
DOI: doi.org/10.1016/S0040-4039(01)97199-0
