E1 در مقابل E2: مقایسه واکنش های E1 و E2
اکنون که مکانیسمهای واکنشهای E1 و E2 را مرور کردیم، اجازه دهید لحظهای به آنها نگاه کنیم و آنها را با هم مقایسه کنیم.
فهرست مطالب
- مقایسه مکانیسم واکنش های E1 و E2
- واکنش های E1 و E2 چه وجه مشترکی دارند؟
- واکنش های E1 و E2 چگونه متفاوت هستند؟
- E1 در مقابل E2: چرا یک حذف به محصول “Zaitsev” می دهد و دیگری حذف نمی کند؟
- الزامات کلیدی استریوشیمی در واکنش E2
- (پیشرفته) مراجع و مطالعه بیشتر
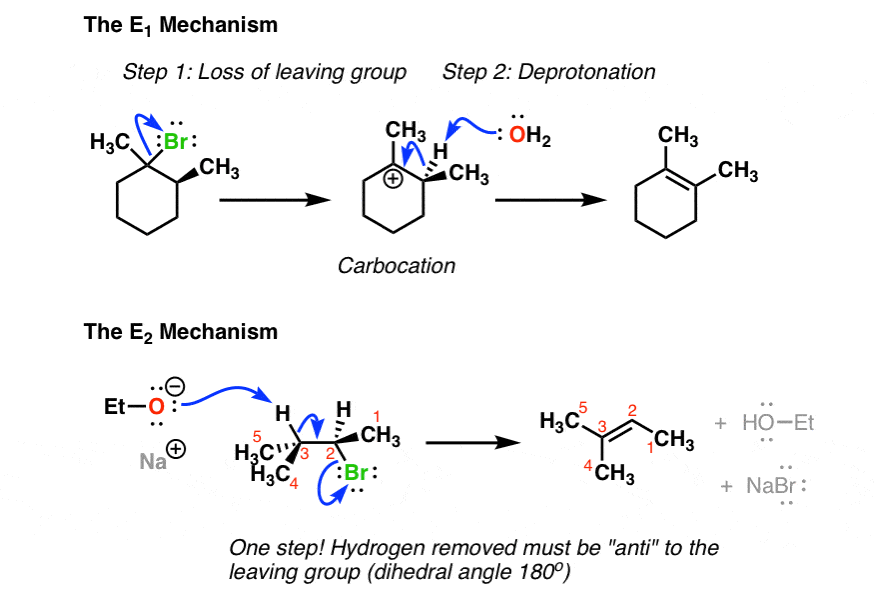
1. مقایسه مکانیسم واکنش های E1 و E2
در اینجا نحوه عملکرد هر یک از آنها آمده است:
2. واکنش های E1 و E2 چه وجه مشترکی دارند؟
در اینجا هر یک از این دو واکنش مشترک است:
- در هر دو مورد، ما یک پیوند CC π جدید تشکیل می دهیم و یک پیوند CH و یک پیوند C- (گروه ترک) را می شکنیم.
- در هر دو واکنش، یک گونه به عنوان پایه برای حذف یک پروتون عمل می کند و پیوند π جدید را تشکیل می دهد
- هر دو واکنش از قانون زایتسف پیروی کنید (هرجا که بشه)
- هر دو واکنش هستند مورد علاقه گرما.
3. واکنش های E1 و E2 چگونه متفاوت هستند؟
حال، بیایید به چگونگی تفاوت این دو مکانیسم نیز نگاه کنیم. بیایید به این نمودار شیک و کاربردی نگاه کنیم:

سرعت واکنش E1 بستگی دارد فقط روی بستر، از آنجایی که مرحله محدود کننده نرخ است تشکیل یک کربوکاتیون. از این رو، بیشتر پایدار که کربوکاتیون است، واکنش سریعتر خواهد بود. تشکیل کربوکاتیون “گام آهسته” است. یک پایه قوی است نه برای تشکیل آلکن مورد نیاز است، زیرا هیچ گروه ترکی وجود ندارد که نیاز به جابجایی داشته باشد (اطلاعات بیشتر در این مورد در یک ثانیه). در نهایت هیچ الزامی برای استریوشیمی ماده اولیه وجود ندارد. هیدروژن می تواند در هر جهتی به گروه خروجی در ماده اولیه باشد [although we’ll see in a sec that we do require that the C-H bond be able to rotate so that it’s in the same plane as the empty p orbital on the carbocation when the new π bond is formed].
سرعت واکنش E2 بستگی دارد هم بستر و هم پایه، از آنجایی که مرحله تعیین نرخ است دو مولکولی (پیوند هماهنگ). آ پایه قوی به طور کلی مورد نیاز است، چیزی که امکان جابجایی یک گروه ترک قطبی را فراهم می کند. استریوشیمی هیدروژن که باید حذف شود باید باشد ضد نسبت به گروه ترک جفت الکترون از پیوند CH شکسته شده به اوربیتال ضد پیوند پیوند C- (گروه ترک) اهدا می شود که منجر به از دست دادن آن به عنوان یک گروه ترک می شود.
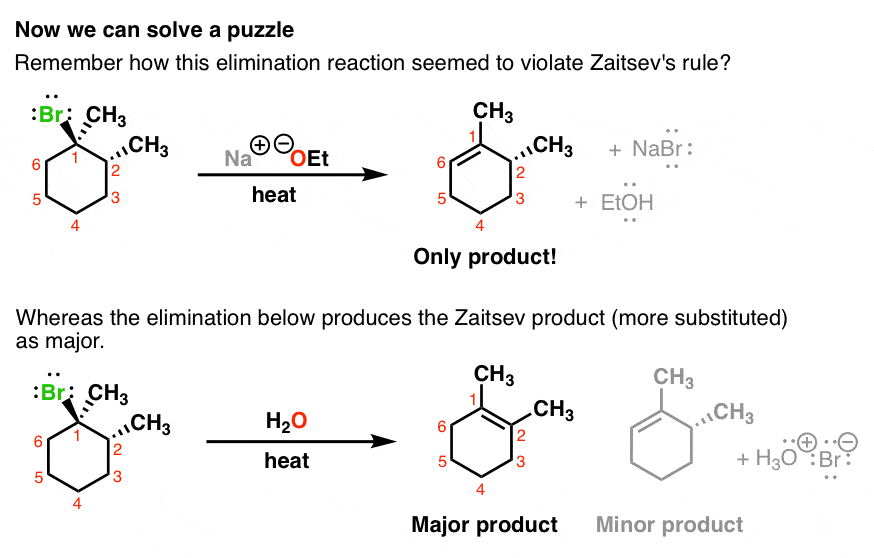
4. E1 در مقابل E2: چرا یک حذف به محصول “Zaitsev” می دهد و دیگری حذف نمی کند؟
اکنون ما در موقعیتی هستیم که بتوانیم به معمایی پاسخ دهیم که اولین بار به واکنش های حذفی نگاه کردیم. این واکنش را به خاطر بسپارید – جایی که یکی از حذف ها محصول “Zaitsev” را به ارمغان آورد، در حالی که دیگری این کار را نکرد. حالا می توانید ببینید چرا؟
5. الزامات کلیدی استریوشیمی در واکنش E2
پس اینجا چه خبر است؟
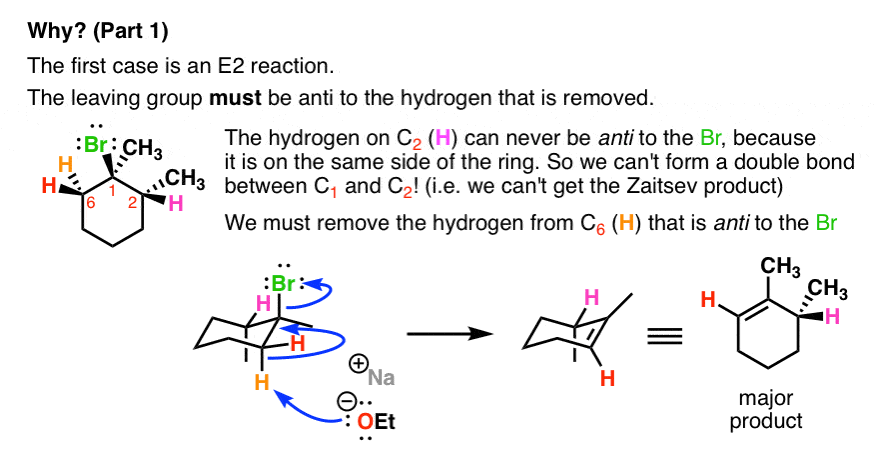
- مورد اول یک واکنش E2 است. گروه ترک باید بودن ضد به هیدروژنی که حذف می شود.
- مورد دوم یک واکنش E1 است.
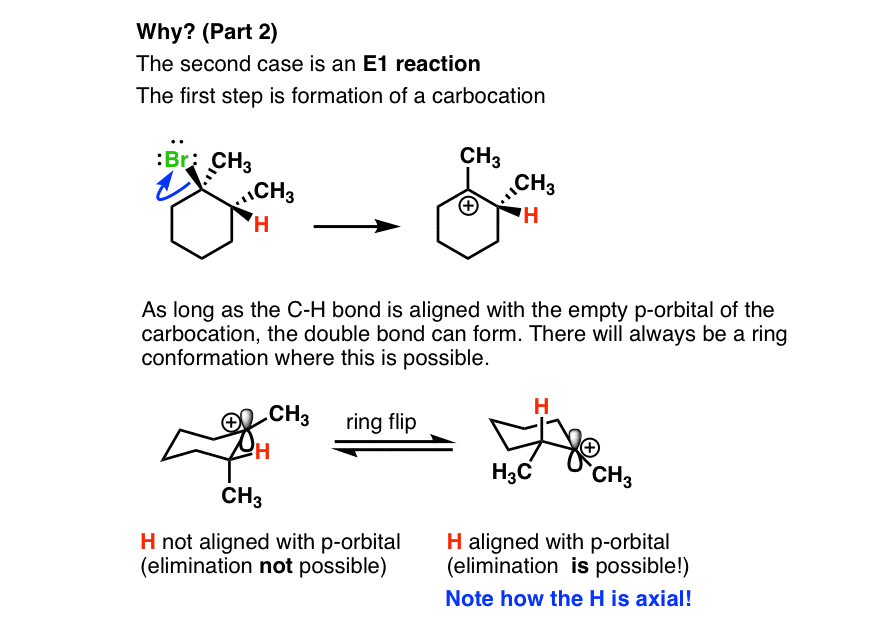
- در حلقه سیکلوهگزان ما در اینجا، هیدروژن باید محوری باشد. این تنها راهی است که می توانیم بین این دو کربن پیوند π ایجاد کنیم. ما به اوربیتال p کربوکاتیون نیاز داریم تا با جفت الکترون های پیوند CH که در مرحله پروتوناسیون در حال شکستن آن هستیم، هم ردیف شود. ما همیشه میتوانیم حلقهای را انجام دهیم تا این H محوری شود، بنابراین میتوانیم محصول Zaitsev را تشکیل دهیم.
- در اینجا مرحله deprotonation آمده است:
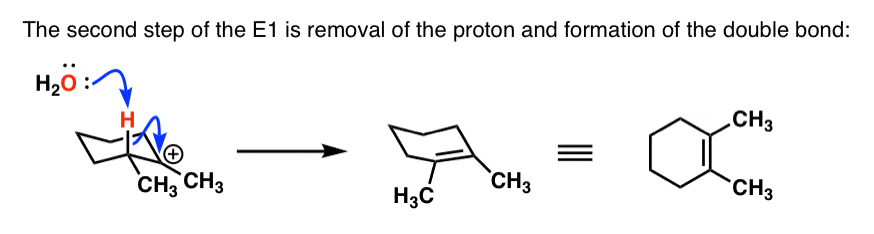
همانطور که می بینید حلقه های سیکلوهگزان با واکنش های حذف می توانند عوارض جالبی ایجاد کنند! در پست بعدی مسیر انحرافی را طی می کنیم و به طور خاص در مورد واکنش های E2 در حلقه های سیکلوهگزان صحبت می کنیم.
پست بعدی: واکنش های حذف و حلقه های سیکلوهگزان
(پیشرفته) مراجع و مطالعه بیشتر
- مکانیسم واکنش های حذف قسمت یازدهم سینتیک حذف الفین از ترت بوتیل و ترت آمیل برومیدها در محیط های الکلی اسیدی و قلیایی
ML Dhar، ED Hughes، و CK Ingold
جی. شیمی. Soc. 1948، 2065-2072
DOI: 10.1039/JR9480002065
واکنش E1 از نظر مصنوعی برای سنتز الفین بسیار مفید نیست، زیرا نسبت حذف به محصولات جایگزین به طور قابل توجهی کمتر از واکنش E2 است. به عنوان مثال، حلولیز t-butyl bromide در اتانول خشک تنها 19٪ ایزوبوتیلن تولید می کند، در حالی که 93٪ عملکرد آلکن با 2M اتوکسید به دست می آید. - مکانیسم های واکنش های حذف سیزدهم. تأثیر باز، حلال و ساختار بر نسبت محصول در واکنش های حذف برخی توزیلات های ثانویه
Irving N. Feit و William H. Saunders
مجله انجمن شیمی آمریکا 1970، 92 (6)، 1630-1634
DOI: 1021/ja00709a035
جدول I در این مقاله نشان می دهد که بازده الفین در شرایط E1 کمتر از شرایط E2 است. شرایط E2 را می توان با استفاده از یک پایه قوی ارتقا داد و استحکام پایه برای پایه های به کار رفته به ترتیب افزایش می یابد. n-بوتوکسید < ثانیه-بوتوکسید < تی-بوتوکسید تأثیر شرایط واکنش بر استریوشیمی محصول (ترانس/سیس اولفین) نیز در اینجا مورد بررسی قرار گرفته است. - مکانیسم های واکنش های حذف. V. اثرات ایزوتوپ گوگرد در برخی از واکنشهای تی-بوتیل دی متیل سولفونیوم یدید
ویلیام اچ ساندرز و استوارت ای. زیمرمن
مجله انجمن شیمی آمریکا 1964، 86 (18)، 3789-3791
DOI: 1021/ja01072a038
این مقاله نمونهای از رقابت بین E2 و E1 را نشان میدهد که در صورت وجود پایه قوی به شدت از E2 حمایت میکند. در هر دو مورد، سرعت واکنش با افزایش دما افزایش می یابد. - مکانیسم و سینتیک واکنش های حذف
دی. هیوز و سی کی اینگولد
ترانس. فارادی Soc. 1941، 37657-685
DOI: 10.1039/TF9413700657
مروری بر تحقیقات اولیه واکنشهای E1 و E2 توسط هیوز و اینگولد که اصطلاحات E1، E2، S را ارائه کردند.ن1، اسن2″ – اینها اکنون نمادهای هیوز-اینگولد نامیده می شوند. این بررسی همچنین شرایط مطلوب واکنش های E1/E2 را خلاصه می کند، که هر ساله به دانشجویان کارشناسی در سراسر جهان آموزش داده می شود. - حذف در ایزومرهای سیس ترانس حلقوی
دکتر W. Hückel و Priv.‐Doz. دکتر ام. هاناک
آنژو. شیمی. بین المللی اد. 1967، 6 (6)، 534-544
DOI: 10.1002/anie.196705341
مطالعه بسیار جالبی برای مقایسه سرعت واکنش های E1 و E2 بین ایزومرهای سیس و ترانس در یک سیستم حلقوی. در جایی که E1 و E2 با هم رقابت می کنند، مقاله بیان می کند:برای اینکه واکنش E2 تا حد ممکن در رابطه با واکنش El مورد علاقه قرار گیرد، غلظت آلکوکسید باید زیاد باشد و گروه آلکیل آلکوکسید باید تا حد امکان بزرگ و تا آنجایی که منشعب می شود. بنابراین برای واکنش های E2، ترتیب اولویت متانول < اتانول < ایزوآمیل الکل ≈ ایزوپروپیل الکل < t- بوتانول < 2-n-بوتیل سیکلوهگزانول است.“
