پنج عامل کلیدی که بر اسیدیته تأثیر می گذارد
امروز ما در مورد آنچه پشت روند اسیدیته برای مولکول های مختلف وجود دارد صحبت خواهیم کرد و مهم ترین عوامل تعیین کننده این مقادیر را مورد بحث قرار خواهیم داد.
من قبلاً با لحن مدرسهای در مورد چگونگی pK نوشتهامآ یکی از مهمترین معیارهایی است که می توانید در شیمی آلی بیاموزید و برخی از pK پایه را ندانیدآ ارزشهای قبل از امتحان بسیار شبیه به رفتن به سمت میز پوکر بدون دانستن ارزش دستها است: پیراهن خود را گم خواهید کرد.
بیایید به سرعت اصول اسیدیته و بازی را مرور کنیم. در اینجا نسخه فشرده شده است:
- اسیدهای برونستد دهنده پروتون هستند، اسیدهای لوئیس گیرنده های جفت الکترون هستند. معکوس: باز برونستد = گیرنده پروتون، باز لوئیس = دهنده جفت الکترون.
- یک پایه مزدوج چیزی است که وقتی یک پروتون (H+) را از یک ترکیب جدا می کنید به دست می آورید. به عنوان مثال، HO– پایه مزدوج آب است. O2- پایه مزدوج HO است–. برعکس، اسیدهای مزدوج همان چیزی هستند که با اضافه کردن یک پروتون به یک ترکیب به دست می آورید. اسید مزدوج آب H است3O+.
- آزمون سریع: pH 1 اسیدی است یا بازی؟ pKآ شبیه pH است که مقادیر کم (و حتی منفی) اسیدهای قوی را نشان می دهد. به این دلیل که pKa بر اساس تعادل است:
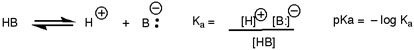
- بر اساس این، هر چیزی که پایه مزدوج را تثبیت کند، اسیدیته را افزایش می دهد. بنابراین pKآ همچنین معیاری است برای اینکه پایه مزدوج چقدر پایدار است. به عبارت دیگر، اسیدهای قوی باز مزدوج ضعیفی دارند و بالعکس.
با توجه به این موضوع، بیایید شروع کنیم.
فهرست مطالب
- فاکتور شماره 1 – شارژ.
- عامل شماره 2 – نقش اتم
- فاکتور شماره 3 – رزونانس
- فاکتور شماره 4 – اثرات القایی
- فاکتور شماره 5 – اوربیتال ها
1. فاکتور شماره 1 – شارژ.
حذف یک پروتون، H+، بار رسمی یک اتم یا مولکول را یک واحد کاهش می دهد. البته زمانی که یک اتم در وهله اول بار 1+ را تحمل میکند، آسانترین کار است و با منفی شدن بار کلی، به تدریج دشوارتر میشود. روند اسیدیته منعکس کننده این است:
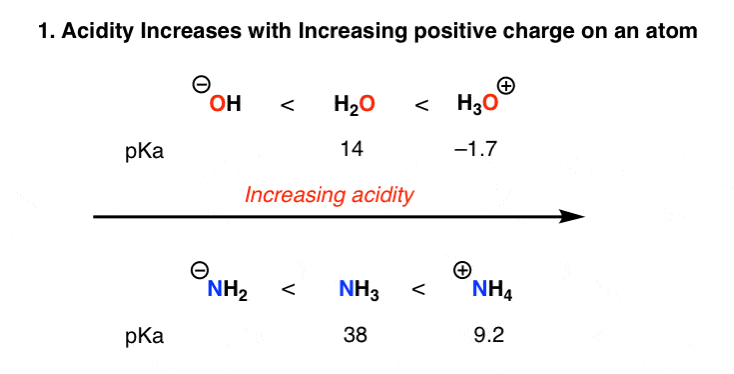
توجه داشته باشید که هنگامی که یک پایه مزدوج (B-) منفی شد، یک پروتون زدایی دوم دیانیون را ایجاد می کند (B 2-). در حالی که به دور از غیرممکن است، تشکیل دیانیون به دلیل تجمع بار منفی و دافعه های الکترونیکی مربوطه می تواند دشوار باشد.
2. عامل شماره 2 – نقش اتم
این نکته به دلیل وجود دو روند به ظاهر متضاد باعث سردرگمی زیادی می شود.
اولین نکته اینجاست: اسیدیته هر چه پیش می رویم افزایش می یابد در سراسر یک ردیف در جدول تناوبی این منطقی است، درست است؟ منطقی است که HF الکترونگاتیوتر از H است2O، NH3، و CH4 به دلیل الکترونگاتیوی بیشتر فلوئور در مقابل اکسیژن، نیتروژن و کربن. فلوئور دارای بار منفی یک فلوئور شاد است.
اما نکته به ظاهر عجیب اینجاست. HF خود یک اسید “قوی” نیست، حداقل نه به این معنا که به طور کامل در آب یونیزه می شود. HF اسید ضعیف تری نسبت به HCl، HBr و HI است. اینجا چه خبره؟
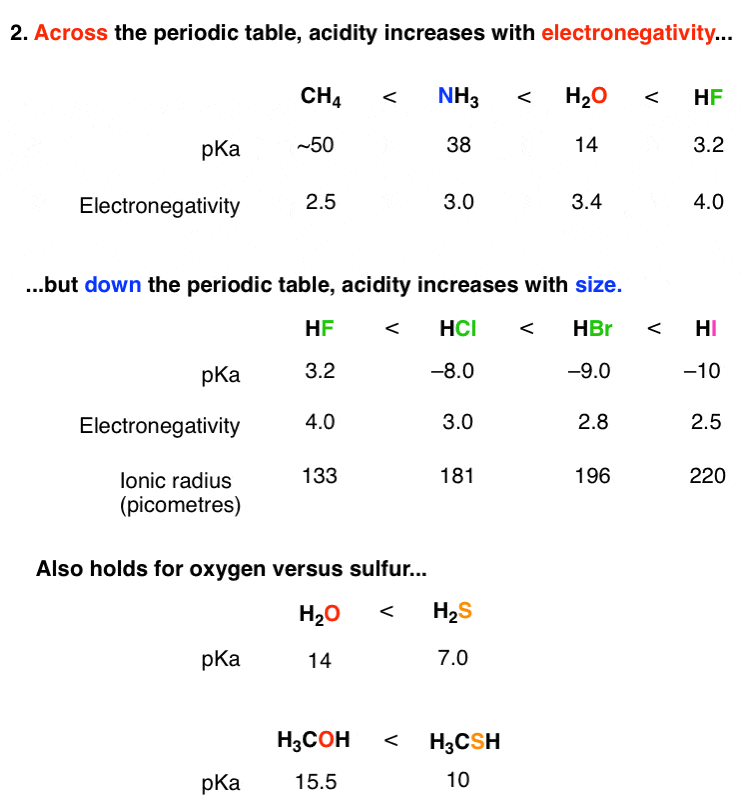
شما می توانید دو استدلال برای اینکه چرا این است. دلیل اول به پیوند HF کوتاهتر (و قوی تر) در مقایسه با هالیدهای هیدروژن بزرگتر مربوط می شود. دومی مربوط به پایداری پایه مزدوج آنیون فلوراید، F(-) یک جانور کوچک و شرور است که کوچکترین شعاع یونی آن در بین هر یون دیگری دارای یک بار منفی است. بنابراین، بار آن در حجم کمتری نسبت به هالیدهای بزرگتر پخش می شود، که از نظر انرژی نامطلوب است: یک چیز، F(-) التماس حلالیت است، که منجر به یک ترم آنتروپی کمتر در Δجی.
توجه داشته باشید که این روند برای H نیز صادق است2O و H2S، با H2S حدود 10 میلیون برابر اسیدی تر است.
3. فاکتور شماره 3 – رزونانس
یک عامل تثبیت کننده بزرگ برای یک پایه مزدوج این است که بار منفی بتواند از طریق رزونانس جابجا شود. نمونه های کلاسیک با فنل (C6اچ5OH) که حدود یک میلیون برابر اسیدی تر از آب است و با اسید استیک (pKآ از ~ 5).
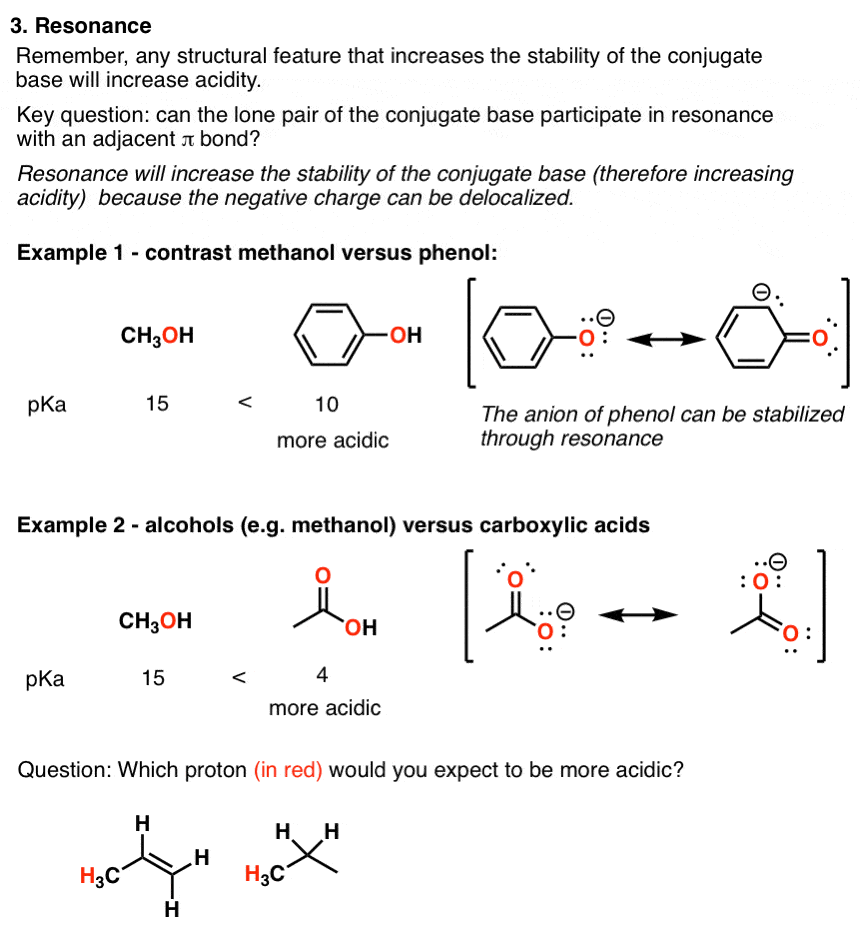
اما مراقب باشید – کافی نیست که یک سیستم π به سادگی در مجاورت یک پروتون باشد – الکترون های پایه مزدوج باید در یک اوربیتال باشند که امکان همپوشانی موثر را فراهم می کند. (برای یک سوال حقهبازی در این زمینه که به طور معمول مانع از پیشپرداخت هاروارد میشود، اینجا را ببینید.)
4. فاکتور شماره 4 – اثرات القایی
اتم های الکترومنفی می توانند بار منفی را به سمت خود بکشند که می تواند منجر به تثبیت قابل توجهی از بازهای مزدوج شود. این نمونه ها را بررسی کنید:
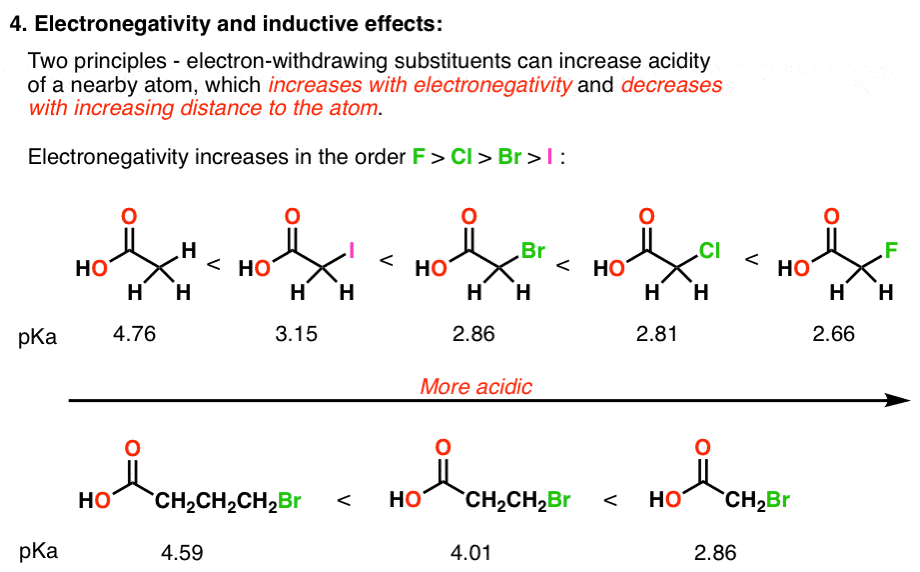
به طور قابل پیش بینی، این اثر به دو عامل اصلی مرتبط است: 1) الکترونگاتیوی عنصر (هرچه الکترونگاتیو تر، اسیدی تر) و فاصله بین عنصر الکترونگاتیو و بار منفی.
5. فاکتور شماره 5 – اوربیتال ها
باز هم، اسیدیته به خوبی به پایداری باز مزدوج مربوط می شود. و پایداری پایه مزدوج بستگی به این دارد که چقدر بتواند جفت الکترون های تازه یافته خود را در خود جای دهد. در اثری مشابه الکترونگاتیوی، هر چه نویسه s در اوربیتال بیشتر باشد، الکترونها به هسته نزدیکتر خواهند بود و انرژی کمتری (= پایدار! ) خواهند داشت.
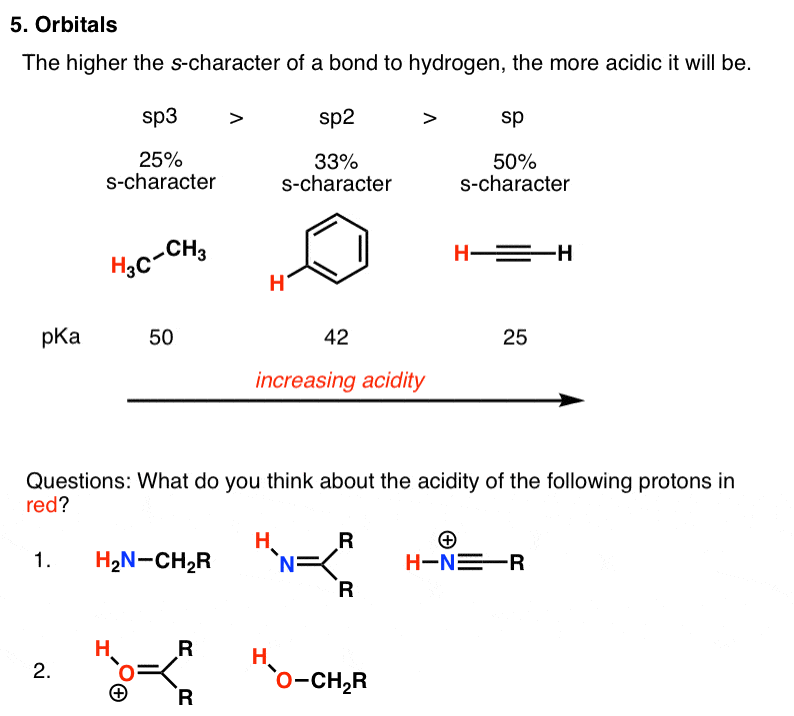
به تفاوت بین pK نگاه کنیدآ از استیلن و آلکان – 25! این 10 به توان 25 است، مانند “100 برابر بزرگتر از عدد آووگادرو”. فقط برای اینکه به شما ایده ای از مقیاس بدهم. این چیز شگفت انگیز در مورد شیمی است – محض دامنه در قدرت پدیده های مختلف هیبت انگیز است.
در واقع یک یادگاری وجود دارد که من پیدا کرده ام که می تواند به شما کمک کند این اثرات را به خاطر بسپارید. این به دکتر کریستین پرویس، مدرس ارشد در تمپ دانشگاه ایالتی آریزونا نسبت داده شده است.
سیهارج
آتام
آرطنین
Dipole منالقاء
Oبیتال ها
= تمرینات هوازی.
با احتیاط با حافظه های یادگاری قدم بردارید، اما شما می روید.
