چهار عامل کلیدی در ارزیابی ساختارهای تشدید
همه اشکال رزونانس از اهمیت یکسانی برخوردار نیستند. بنابراین چگونه ارزیابی کنیم که هر ساختار رزونانس چقدر “مهم” است؟
همانطور که در پست های قبلی دیدیم، چهار عامل کلیدی که اهمیت ساختارهای تشدید را در شیمی آلی تعیین می کنند عبارتند از:
- قانون شماره 1: هزینه ها را به حداقل برسانید
- قانون شماره 2: اکتت کامل مورد علاقه است
- قانون شماره 3: چقدر پایدار هستند بارهای منفی؟
- قانون شماره 4: چقدر پایدار هستند بارهای مثبت؟
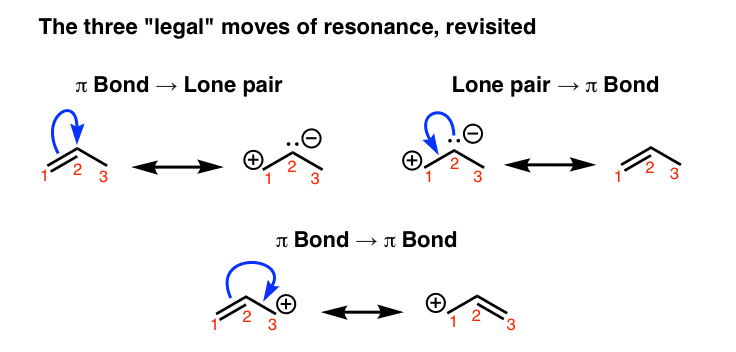
1. سه “حرکت” پیکان هلی الکترونی “قانونی” که برای ساختارهای تشدید متقابل استفاده می شود را به یاد بیاورید.
بعد از این همه پست در مورد رزونانس، فکر کردم خوب است که پستی داشته باشم که خلاصه ای از آنچه تاکنون در مورد آن بحث شده باشد.
یکی از مهارت های کلیدی در تجزیه و تحلیل واکنش پذیری یک مولکول این است که بتوانیم بفهمیم الکترون ها کجا هستند.
همانطور که در اینجا نوشتم، اگر با پیوندهای منفرد سر و کار داریم، پی بردن به تفاوت در الکترونگاتیوها یک موضوع نسبتاً ساده است.
با این حال، اگر پیوندهای متعدد (پیوند π) وجود داشته باشد، آنگاه با مشکل کوچکی مواجه می شویم: راه های متعددی برای توزیع الکترون ها روی یک مولکول (یعنی اشکال رزونانس متفاوت) وجود دارد. بنابراین، برای درک چگالی الکترون روی یک مولکول که در آن پیوندهای پی وجود دارد، ابتدا باید اهمیت اشکال مختلف رزونانس آن را درک کنیم.
چگونه میتوانیم اشکال تشدید را برای یک مولکول مشخص «پیدا کنیم»؟ انجام آن از طریق آزمون و خطا امکان پذیر است، اما یک راه مطمئن برای انجام این کار استفاده از فرمالیسم پیکان منحنی است، که راهی برای به تصویر کشیدن “حرکت” الکترون ها است.
سه روش “قانونی” برای حرکت الکترون ها با استفاده از فلش های منحنی وجود دارد: از پیوند پی به جفت تک، از جفت تک به پیوند پی و از پیوند پی به پیوند پی:
2. به یاد داشته باشید که ساختارهای تشدید در تعادل با یکدیگر نیستند – آنها نشان دهنده مشارکت در یک تشدید کلی “هیبرید” هستند.
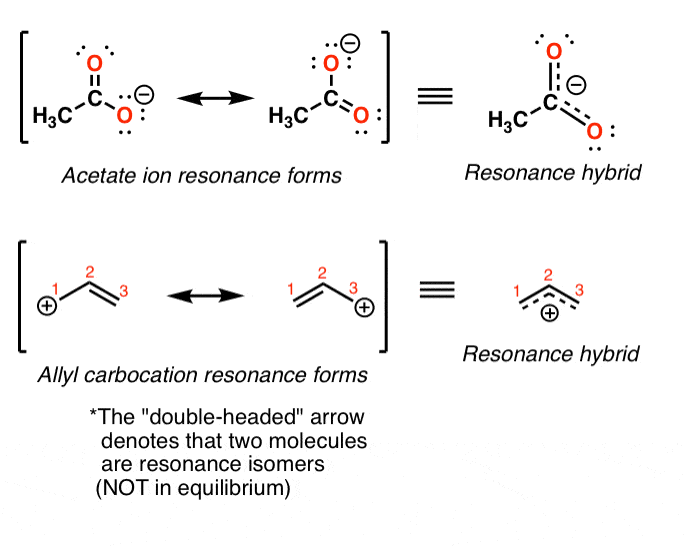
در اینجا یک نکته مهم در مورد فرم های رزونانس وجود دارد. این وسوسه انگیز (و بسیار اشتباه!) است که فکر کنیم این اشکال رزونانسی در “تعادل” بین یکدیگر هستند. از این اشتباه رایج اجتناب کنید!
در عوض، حالت “واقعی” مولکول “ترکیبی” از این اشکال تشدید خواهد بود.
برای مثال در مثالهای کاتیون استات و آلیل در زیر، ساختار “واقعی” مولکول از طریق ترکیب 50:50 از دو شکل تشدید نشان داده میشود.
3. همه اشکال رزونانس از اهمیت یکسانی برخوردار نیستند. بنابراین چگونه ارزیابی کنیم که هر یک چقدر “مهم” است؟
در مورد یون استات و کاتیون آلیل، هر دو شکل رزونانس از نظر انرژی برابر هستند، بنابراین “هیبرید” مخلوطی 1:1 از این دو است. با این حال، این فقط به ندرت اتفاق می افتد.
کتون زیر (استون یا “پروپانون”) را در نظر بگیرید که می توانیم 3 شکل رزونانس مختلف برای آن ترسیم کنیم.
در مواردی مانند این، چگونه اهمیت نسبی هر فرم رزونانس را ارزیابی می کنیم؟
4. قانون شماره 1: سازه های تشدید خنثی “مهم تر” از سازه های تشدید باردار هستند.
فرم های رزونانس می شوند کمتر قابل توجه است با افزایش تعداد هزینه ها (به پست قبلی مراجعه کنید).
به عنوان مثال، در کتون بالا، فرم رزونانس با هزینه های رسمی صفر مهم ترین خواهد بود.
از کجا بدانیم؟ ما می توانیم خواص فیزیکی مولکول را اندازه گیری کنیم (مثلاً نقاط جوش، خواص حلال، رسانایی) و ببینیم که آیا با یک گونه باردار سازگارتر است یا یک ترکیب خنثی.
تمام خواص فیزیکی پروپانون (استون) با این که یک مولکول (بیشتر) خنثی است، مطابقت دارد. به عنوان مثال استون دارای نقطه جوش 56 درجه سانتیگراد، به طور قابل توجهی کمتر از آب، و نقطه انجماد -95 درجه سانتیگراد است. گونه های باردار (مانند NaCl) را تقریباً به خوبی آب حل نمی کند. و رسانای الکتریسیته خوبی نیست.
این بدان معنا نیست که فرم رزونانس “دومین بهترین” اجرا نمی شود مقداری نقش. جوشش استون بسیار بالاتر از بوتان (-1 درجه سانتیگراد) است که وزن مولکولی مشابهی دارد به دلیل نیروهای جاذبه دوقطبی دوقطبی واندروالس، و همانطور که بعدا خواهیم دید، شکل رزونانس “دومین” می تواند تولید کند. یک سرنخ مهم در مورد واکنش پذیری یک مولکول.
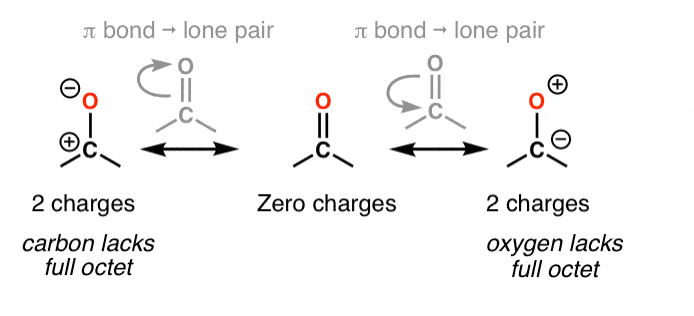
5. قانون شماره 2: اکتت های کامل به اکتت های خالی ارجحیت دارند (و هرگز، هرگز اکتت های خالی روی اکسیژن یا نیتروژن نداشته باشید!)
اشکال تشدید که در آن همه اتم ها دارای اکتت کامل هستند، مهم تر از اشکال تشدید هستند که در آن اتم(ها) فاقد اکتت کامل هستند. مهمتر از همه، این یک قانون کلی خوب است هرگز کمتر از یک اکتت کامل روی نیتروژن یا اکسیژن قرار ندهید، مانند مثال استون (بالا سمت راست). از آنجایی که این اتم ها بسیار الکترونگاتیو هستند، این اشکال تشدید بسیار ناپایدار هستند و ناچیز خواهند بود.
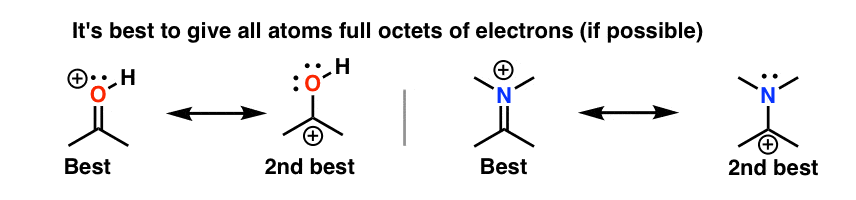
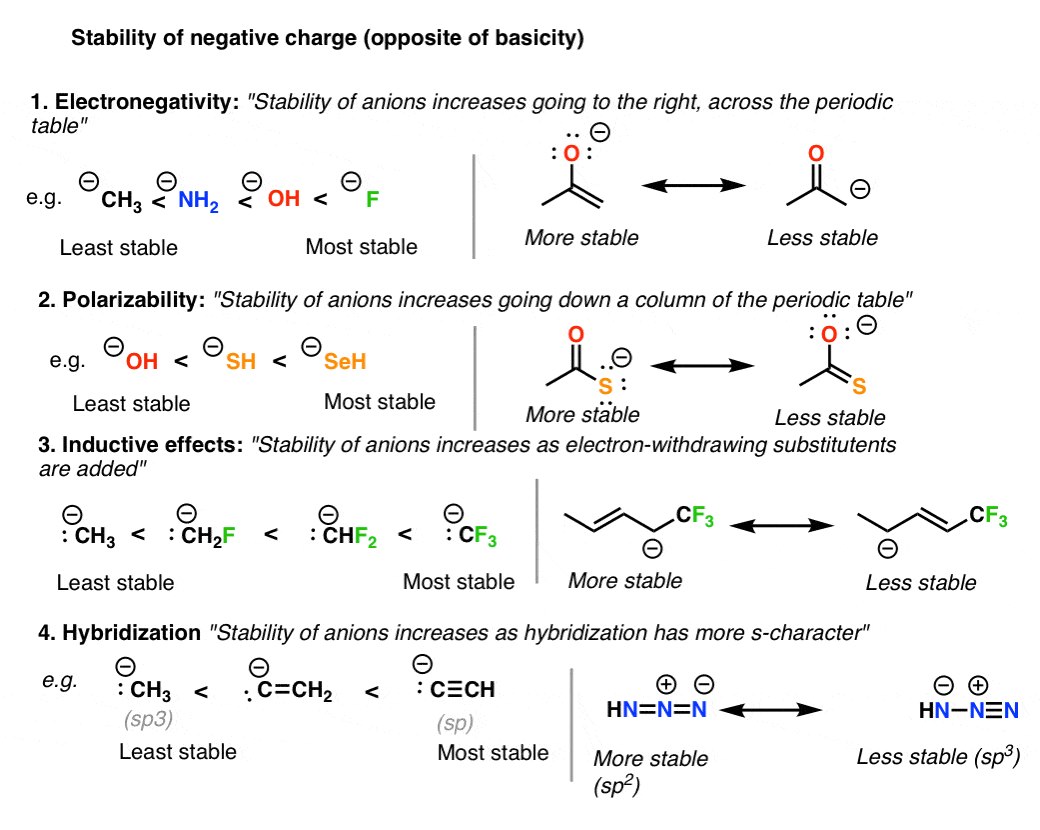
6. قانون شماره 3: بارهای منفی را بر روی اتم قرار دهید که به بهترین وجه قادر به تثبیت آن است (یعنی کمترین اتم پایه)
با توجه به اینکه ساختارهای رزونانس خنثی به طور کلی ترجیح داده می شوند، هنگامی که یک ساختار تشدید مطلقاً باید در جایی بار منفی داشته باشد، آن را روی اتمی قرار دهید که به بهترین وجه می تواند آن بار را تثبیت کند. از آنجایی که در اصل «پایه بودن متضاد پایداری است»، این همان چیزی است که می گوییم «بار منفی را روی حداقل اتم پایه قرار دهید».
خبر خوب در اینجا این است که اگر عوامل مؤثر بر اسیدیته را درک کنید، عواملی را نیز درک می کنید که بار منفی را تثبیت می کنند.
در اینجا چهار گرایش اصلی وجود دارد که باید در نظر گرفته شود:
- الکترونگاتیوی: در یک ردیف از جدول تناوبی، بار منفی با افزایش الکترونگاتیوی پایدارتر می شود.
- قطبی پذیری: پایین یک ستون از جدول تناوبی، بار منفی با افزایش قطبش پذیری پایدارتر می شود
- گروه های خارج کننده الکترون بار منفی را از طریق تثبیت می کنند اثرات القایی.
- هیبریداسیون: با افزایش کاراکتر s اتم بار منفی پایدارتر می شود. sp (پایدارترین) > sp2 > sp3 (کمترین ثبات
دوباره به این نکته توجه کنید ثبات نقطه مقابل اصل است.
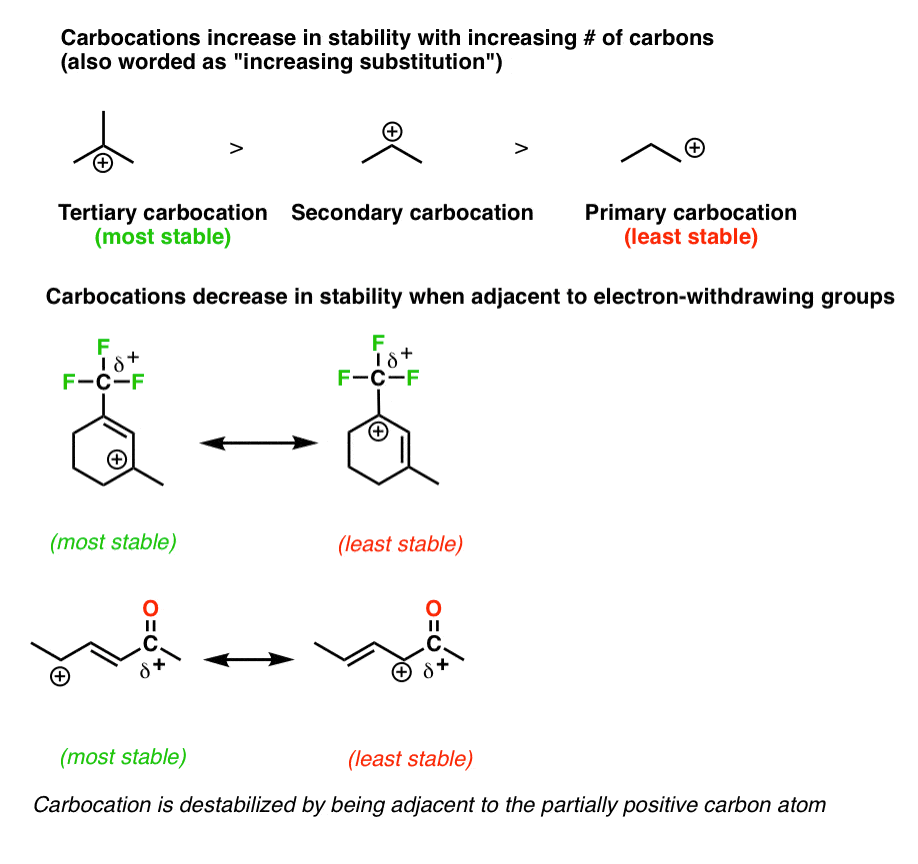
7. قانون شماره 4: هر اکتت خالی را روی اتم هایی که به بهترین وجه قادر به تثبیت آنها هستند (یعنی کربن و نه اکسیژن یا نیتروژن) قرار دهید.
همانطور که در بالا گفتیم، اکتت کامل بهترین هستند. با این حال، هنگامی که با یک ساختار تشدید سروکار دارید که در آن مطلقاً باید یک اتم با کمتر از یک اکتت کامل وجود داشته باشد، پس از این اصول پیروی کنید:
- اکتت خالی را روی آن قرار دهید کربن، هرگز اکسیژن یا نیتروژن
- اکتت خالی را روی آن قرار دهید بیشترین کربن جایگزین (پایداری کربوکاتیون را به خاطر بسپارید)
- اجتناب کردن در صورت امکان بار مثبت را در مجاورت گروه های الکترون خارج کننده قرار دهید
- بار مثبت را ترجیحاً روی آن قرار دهید آلکیل کربوکاتیون ها بر خلاف آلکنیل یا (به خصوص) آلکینیل کربن ها
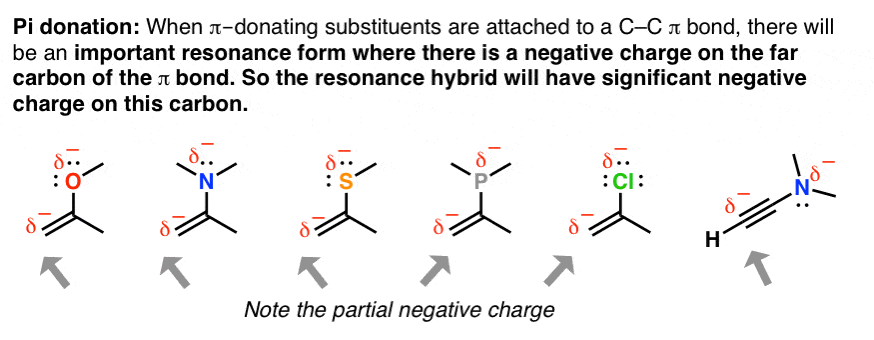
8. یک کاربرد رزونانس: “اهدای Pi”
هنگامی که پیوندهای دوگانه با یک جفت الکترون به یک اتم متصل می شوند، مولکول در جایی که وجود دارد شکل تشدید قابل توجهی خواهد داشت. بار منفی روی کربن مجاور به دلیل پدیده ای به نام “اهدای پی”. هنگامی که شروع به یادگیری در مورد واکنش های پیوندهای پی می کنید، این امر به ویژه مهم می شود.
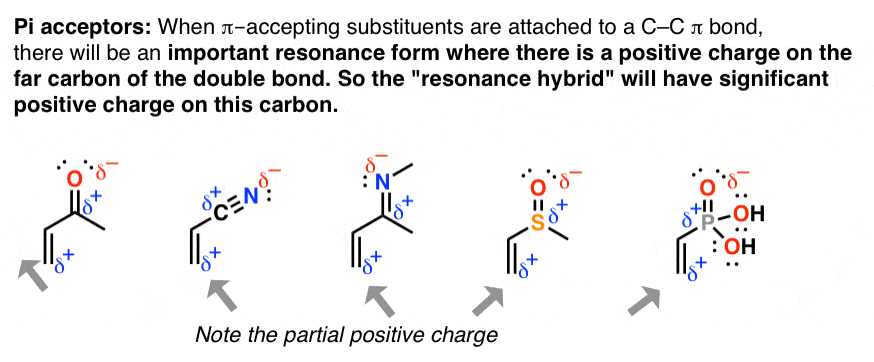
9. کاربرد دوم رزونانس: “پذیرنده های Pi”
هنگامی که پیوندهای دوگانه به یک پیوند π پلاریزه شده متصل می شوند، مولکول شکل تشدید قابل توجهی خواهد داشت که در آن بار مثبت روی کربن مجاور وجود دارد. این پدیده به عنوان رفتار «پذیرنده pi» شناخته می شود و این گروه ها به عنوان «پذیرنده pi» شناخته می شوند.
در حال حاضر، این کار را برای خلاصه ای از موضوعات مهم در طنین انجام می دهد. توقف بعدی (پس از پستی در مورد برخی اشتباهات رایج) اعمال این اصول در واکنش پذیری شیمیایی خواهد بود.
پست بعدی: اشتباهات رایج – چگونه فلش های منحنی رزونانس را نکشیم