چه عواملی بر ثبات رادیکال های آزاد تأثیر می گذارد؟
در آخرین پست معرفی کردیم رادیکال های آزاد – گونههای شیمیایی خنثی و دارای کمبود الکترون با یک اوربیتال تا حدی پر – و آموختند که آنها واسطههای بسیار واکنشپذیر در شیمی آلی هستند.
در این پست ما دو مورد از مهمترین مفاهیم مربوط به این گونه ها را پوشش خواهیم داد: آنها هندسه، و آنها ثبات. این مفهوم اخیر است که خواهیم دید برای درک بسیاری از واکنش های رادیکال آزاد در شیمی آلی مهم است. [Spoiler: the factors that affect free radical stability are the same factors that stabilize carbocations [discussed previously here]
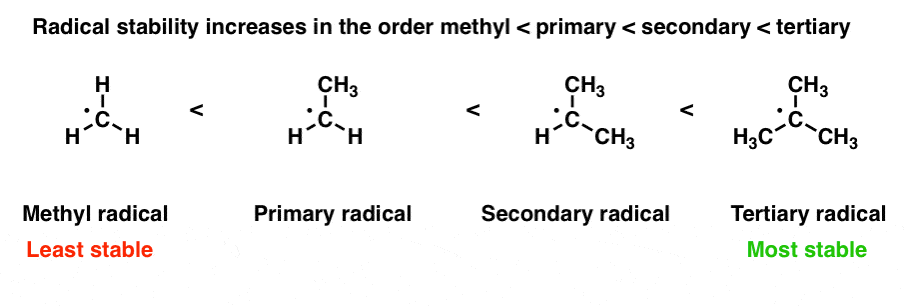
1. پایداری رادیکال های آزاد در راسته متیل < اولیه < ثانویه < سوم افزایش می یابد
بیایید ابتدا کمی در مورد ثبات صحبت کنیم و سپس به ساختار آنها برگردیم. با کمبود الکترون، ممکن است در مورد عواملی که ممکن است رادیکالهای آزاد را تثبیت میکنند، حدس بزنید. باز، ما در مورد اینکه چگونه می توان بخش قابل توجهی از شیمی آلی را به سادگی با درک این موضوع توضیح داد: 1) بارهای مخالف جذب می شوند (و مانند بارها دفع می شوند) و 2) پایداری بارها افزایش می یابد اگر بتوان آن را در یک مقدار بیشتر پخش کرد. جلد. اینها هنوز در اینجا اعمال می شوند!
گونه های فقیر از الکترون توسط اتم های همسایه ای که می توانند تثبیت شوند اهدا کنند چگالی الکترون [“if you’re poor, it helps to have rich neighbors”]. رایج ترین راه برای تفسیر “همسایگان ثروتمند” در اینجا مشاهده این است افزایش تعداد گروه های آلکیل رادیکال آزاد بر روی کربن حامل، پایداری آن را افزایش می دهد. پایداری رادیکال در مرتبه متیل < اولیه < ثانویه < سوم افزایش می یابد. [For a second, more conceptually complex example, see the bottom of the post]. [Note 1]
2. رادیکالهای آزاد با تغییر مکان تثبیت میشوند (“رزونانس”)
ثانیا، ما همچنین آموخته ایم که هر عاملی که می تواند منجر به کمبود الکترون شود غیر محلی شده [spread out] در یک منطقه بزرگتر نیز گونه های فقیر الکترونی را تثبیت می کند. به عنوان مثال، قبلاً دیده بودیم که بار مثبت یک کربوکاتیون زمانی که در مجاورت یک پیوند π باشد به طور قابل توجهی تثبیت می شود.
به این دلیل که کربوکاتیون sp2 هیبرید شده و دارای یک اوربیتال p خالی است که امکان همپوشانی با اوربیتالهای p مجاور را فراهم میکند و بنابراین بار مثبت را بر روی اتمهای کربن متعدد جابجا میکند، به روشی که به راحتی با رسم ساختارهای تشدید قابل درک است.
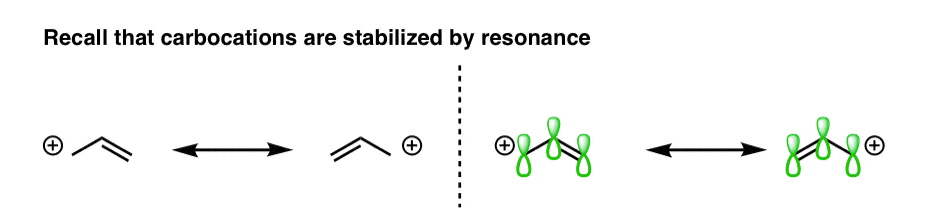
کربوکاتیونها مسطح هستند – بنابراین به راحتی میتوان دید که چگونه اوربیتال p میتواند با اوربیتالهای p مجاور یک پیوند دوگانه در یک راستا باشد. اما در مورد هندسه رادیکال های آزاد چطور؟
3. هندسه رادیکالهای آزاد یک “هرم کم عمق” است که امکان همپوشانی نیمه پر را فراهم می کند. پ-اوربیتال با پیوندهای پی مجاور
اگر الکترونها را در یک رادیکال آزاد آلکیل معمولی بیرون بکشیم، میبینیم که سه جفت پیوند و یک الکترون مجزای جفتنشده وجود دارد که در مجموع چهار اوربیتال اشغال شده است. در قیاس مثلاً آمین ها، ممکن است انتظار داشته باشیم که هیبریداسیون مولکول به صورت sp.3 و هندسه یک رادیکال آزاد هرمی مثلثی خواهد بود. این در واقع یک تقریب خوب است، با این تفاوت که “هرم” کمی کم عمق تر از مولکول هایی است که یک جفت کامل دارند.[Note 2]
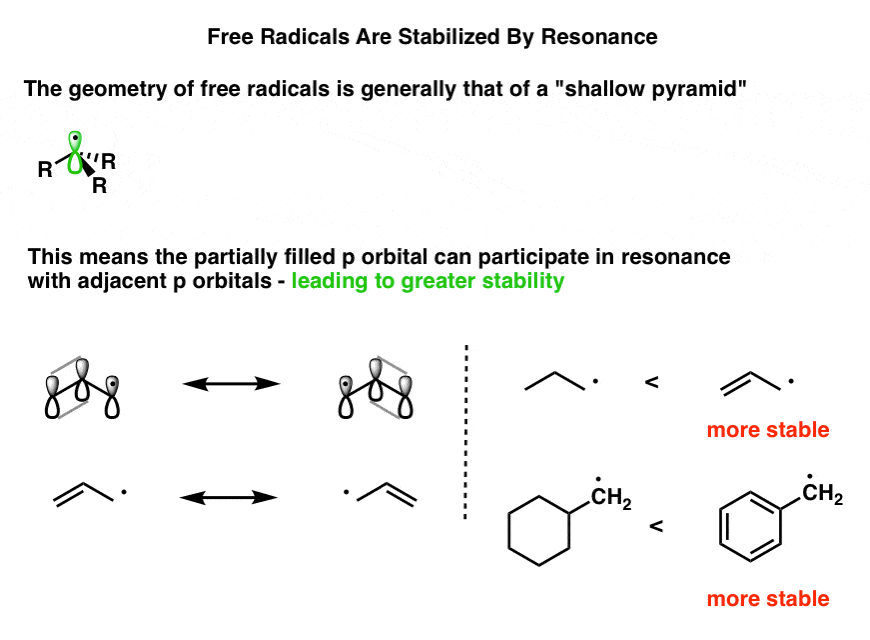
هنگامی که رادیکال آزاد در مجاورت یک پیوند π قرار می گیرد، اگر اوربیتال های p همه در یک راستا باشند تا بتوانند همپوشانی داشته باشند، تثبیت قابل توجهی حاصل می شود. [“conjugation”] با همدیگر. اگر “هرم کم عمق” مسطح شود، همپوشانی افزایش می یابد (و انرژی مولکول کاهش می یابد). این یک تقریب خوب است که یک رادیکال آزاد مجاور پیوند π را به عنوان “sp” در نظر بگیریم.2” هیبرید شده
پس این همه به چه چیزی خلاصه می شود؟ رادیکال آزاد با کمبود الکترون را می توان روی کربن های متعدد جابجا کرد. بنابراین، رادیکال های آزاد با رزونانس تثبیت می شوند.
4. همان عواملی که رادیکال های آزاد را تثبیت می کنند، کربوکاتیون ها را نیز تثبیت می کنند
اگر مقاله تثبیت کربوکاتیون ها را بخوانید، ممکن است متوجه چیزی شوید: همان عواملی که رادیکال های آزاد را تثبیت می کنند، همان عواملی هستند که کربوکاتیون ها را تثبیت می کنند!
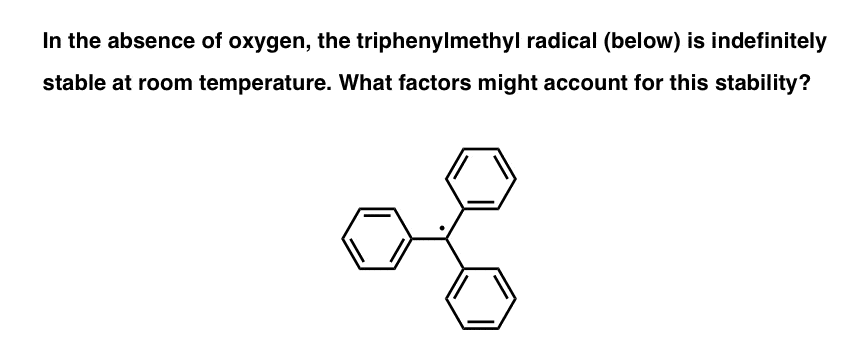
زمان آزمون: یکی از پایدارترین رادیکال های آزاد شناخته شده، رادیکال تری فنیل متیل است که توسط موزس گومبرگ در سال 1900 کشف شد. در غیاب اکسیژن، این رادیکال به طور نامحدود در دمای اتاق پایدار است. آیا می توانید عواملی را شناسایی کنید که ممکن است این رادیکال آزاد را به ویژه پایدار کند؟
مطلب بعدی: چه عواملی باعث بی ثباتی رادیکال های آزاد می شود؟
یادداشت
یادداشت 1. تثبیت رادیکال های آزاد توسط جفت های مجاور مجاور
علاوه بر گروه های آلکیل، رادیکال های آزاد نیز توسط گروه های مجاور با جفت های تنها مانند اکسیژن و نیتروژن تثبیت می شوند. در ابتدا، اکسیژن ممکن است مانند یک گروه اهداکننده الکترون به نظر نرسد، زیرا کاملاً الکترونگاتیو است. با این حال، اکسیژن میکند دارای دو جفت تک الکترون چگونه ممکن است اینها دخیل باشند؟
اتم اکسیژن مجاور می تواند چگالی الکترونی را به اوربیتال نیمه خالی p بدهد که یک برهمکنش تثبیت کننده است. تصویر مداری به این شکل است.
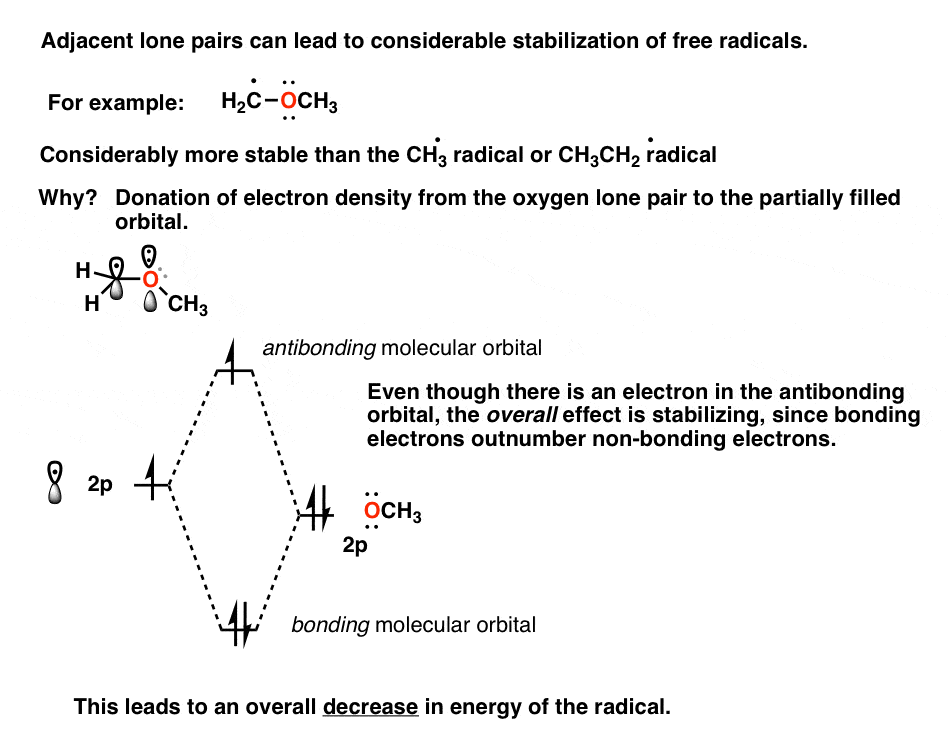
بله، یک الکترون در اوربیتال ضد پیوند وجود دارد، اما به طور کلی برهمکنش در حال تثبیت است زیرا تعداد الکترون های پیوندی در اینجا از الکترون های ضد پیوند بیشتر است.
تبصره 2. یک نکته برای دانش آموزان پیشرفته – “هرم کم عمق” مانعی برای وارونگی کمی دارد. این بدان معنی است که اگر یک رادیکال آزاد از یک مرکز کایرال فعال نوری تشکیل شود، به طور کلی racemization سریع رخ می دهد.
(پیشرفته) مراجع و مطالعه بیشتر
- نمونه ای از کربن سه ظرفیتی: تری فنیل متیل.
موسی گومبرگ
مجله انجمن شیمی آمریکا 1900، 22 (11)، 757-771
DOI: 10.1021/ja02049a006
این مقاله به عنوان مقاله معروفی در نظر گرفته می شود که زمینه شیمی رادیکال آزاد آلی را آغاز کرد. موزس گومبرگ (دانشگاه میشیگان) در تلاش برای سنتز هگزافنیل اتان بود، و بنابراین سعی کرد تری فنیل متیل کلرید (تریتیل کلرید) را با فلز روی کاهش دهد. در عوض، او یک محلول زرد رنگ دریافت کرد که وقتی در معرض هوا قرار گرفت، یک محصول حاوی اکسیژن بود. هنگامی که او این آزمایش را تحت یک CO انجام داد2 پتو (به یاد داشته باشید، Ar خالص در آن زمان به آسانی در دسترس نبود!)، او دریافت که محلول به طور نامحدود پایدار است، و استنباط کرد که رادیکال تری فنیل متیل است که هنگام قرار گرفتن در معرض هوا با اکسیژن واکنش می دهد و یک پراکسید تشکیل می دهد. در پایان مقاله، گومبرگ میگوید: «این کار ادامه خواهد یافت و من میخواهم میدان را برای خودم رزرو کنم». ACS در سال 2000 دانشگاه میشیگان را به عنوان یک نقطه عطف شیمیایی تاریخی ملی اعلام کرد و صدمین سالگرد این کشف را جشن گرفت و پروفسور ملانی سانفورد (U Michigan) در حال حاضر دارای کرسی شیمی موزس گومبرگ است. - تفسیر نظری برهمکنش های فوق ریز کربن-13 در طیف رزونانس اسپین الکترون
مارتین کارپلاس و جورج کی فرانکل
جی. شیمی. فیزیک 1961، 35، 1312
DOI: 10.1063/1.1732044
طیف EPR (رزونانس پارامغناطیس الکترونی) رادیکال متیل به این نتیجه می رسد که ساختار آن می تواند مسطح یا یک هرم بسیار کم عمق باشد. پروفسور کارپلاس اکنون در هاروارد است و جایزه نوبل شیمی را در سال 2013 به دلیل مشارکت در شیمی نظری دریافت کرد. - ساختار رادیکال ترت بوتیل
L. Bonazzola، N. Leray، و J. Roncin
مجله انجمن شیمی آمریکا 1977، 99 (25)، 8348-8349
DOI: 10.1021/ja00467a052 - پیکربندی رادیکال ترت بوتیل
D. Griller، KU Ingold، PJ Krusic، و H. Fischer
مجله انجمن شیمی آمریکا 1978، 100 (21)، 6750-6752
DOI: 10.1021/ja00489a035
رادیکال تی بوتیل به طور گسترده مورد مطالعه قرار گرفته است. در حالی که نتایج تجربی بر حسب ساختارهای مسطح و کمی هرمی تفسیر شده است، محاسبات نظری به نفع یک ساختار هرمی است. - واکنش اتم ها و رادیکال های آزاد در محلول I. مطالعه جایگزینی هیدروژن بر روی یک اتم کربن نامتقارن – کلرزنی آمیل کلرید فعال اولیه
هربرت سی. براون، ام اس خاراش و تی چائو
مجله انجمن شیمی آمریکا 1940، 62 (12)، 3435-3439
DOI: 1021/ja01869a040 - N-Bromosuccinimide. III. دوره استریوشیمیایی بروماسیون بنزیلی
HJ Dauben و Layton L. McCoy
مجله انجمن شیمی آمریکا 1959، 81 (20)، 5404-5409
DOI: 10.1021/ja01529a038
دو مقاله بالا نشان میدهند که واکنشهای رادیکال در مراکز کربن کایرال به دلیل وارونگی آسان رادیکال هرمی میانی منجر به راسمی شدن میشود. - محاسبات Ab Initio انرژیهای تثبیت تشدید نسبی رادیکالهای آلیل و بنزیل
دیوید ا.هروات و وستون تاچر بوردن
مجله شیمی فیزیک 1994، 98 (41)، 10460-10464
DOI: 1021/j100092a014
انرژی تثبیت یک گروه وینیل (در رادیکال آلیل) و یک گروه فنیل (در رادیکال بنزیل) به ترتیب 7/15 کیلوکالری بر مول و 5/12 کیلوکالری بر مول محاسبه شده است. - تأثیر پذیرندگان و اهداکنندگان مجاور بر پایداری رادیکالهای کربن محور
G. Bordwell، Xianman Zhang، و Mikhail S. Alnajjar
مجله انجمن شیمی آمریکا 1992، 114 (20)، 7623-7629
DOI: 10.1021/ja00046a003
جدول I در این مقاله حاوی انرژی های تثبیت رادیکال های متیل با جایگزین های مختلف است (به عنوان مثال ·CH2ایکس).
