اکنون در دسترس است – این جزوه عالی (رایگان) 3 صفحه ای در مورد چگونگی حل مشکلات رایج نقطه جوش را دانلود کنید. با 10 مثال از مسائل حل شده! (همچنین شامل تمام نکات کلیدی مورد بحث در این پست است)
MOC_Boiling_Point_Handout (PDF)
فهمیدن ترتیب نقاط جوش همه چیز در مورد آن است درک روندها. نکته کلیدی در اینجا این است که نقاط جوش قدرت نیروهای بین مولکول ها را منعکس می کند. هرچه بیشتر به هم بچسبند، انرژی بیشتری لازم است تا آنها را به عنوان گاز در اتمسفر منفجر کنند.
3 روند مهم وجود دارد که باید در نظر بگیرید.
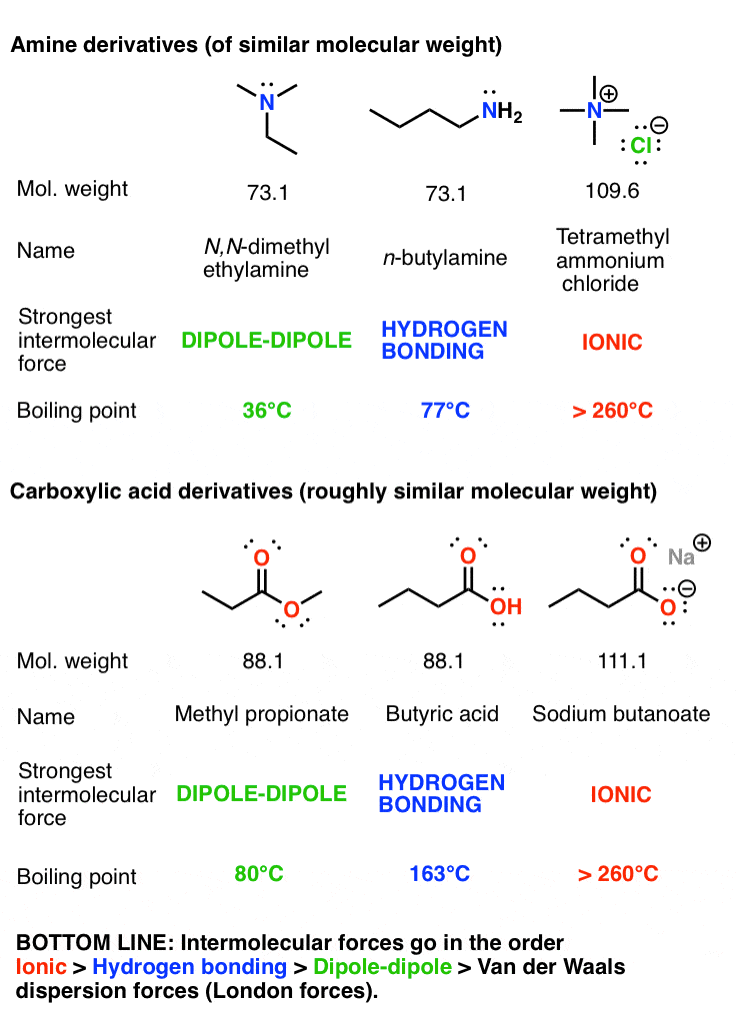
- قدرت نسبی چهار نیروی بین مولکولی عبارت است از: یونی > پیوند هیدروژنی > دوقطبی دوقطبی > نیروهای پراکندگی واندروالس. تأثیر هر یک از این نیروهای جذاب به گروه های عملکردی موجود بستگی دارد.
- با افزایش تعداد کربن ها، نقطه جوش افزایش می یابد.
- انشعاب باعث کاهش نقطه جوش می شود.
1. روند شماره 1: قدرت نسبی چهار نیروی بین مولکولی.
مشتقات مختلف الکل بوتان را که در زیر نشان داده شده است مقایسه کنید. مولکول های دی اتیل اتر، C4H10 O، توسط برهمکنش های دوقطبی-دوقطبی که به دلیل پیوندهای قطبی شده CO بوجود می آیند، در کنار هم نگه داشته می شوند. نقطه جوش آن (35 درجه سانتیگراد) را با ایزومر بوتانول (117 درجه سانتیگراد) مقایسه کنید. افزایش شدید نقطه جوش به دلیل این واقعیت است که بوتانول حاوی یک گروه هیدروکسیل است که قادر به پیوند هیدروژنی است. با این حال، نیروهای جاذبه در بوتانول در مقایسه با نیروهای جذبی نمک بوتاکسید، که ذوب می شود در دمای بسیار بالا (بیش از 260 درجه سانتیگراد) و در واقع قبل از تبدیل شدن به مایع تجزیه می شود.
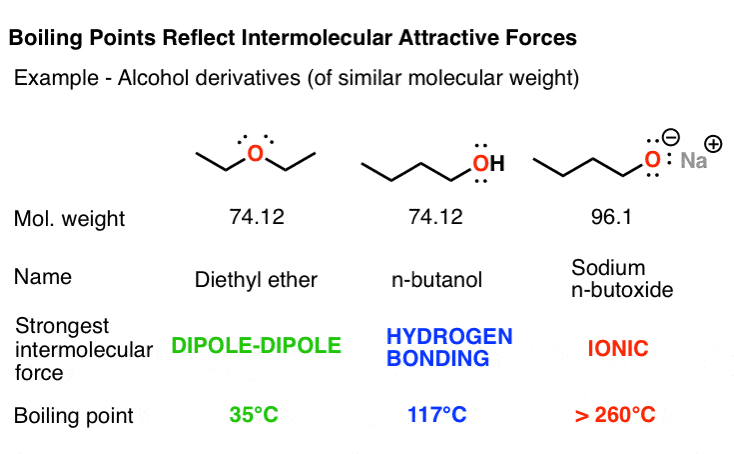
سپس به بوتان، C4H10 فکر کنید که هیچ گروه عملکردی قطبی ندارد. تنها نیروهای جذاب بین مولکولهای بوتان، نیروهای نسبتا ضعیف پراکندگی واندروالس است. نتیجه این است که بوتان در دمایی که آب در آن یخ میزند (0 درجه سانتیگراد)، بسیار کمتر از دی اتیل اتر میجوشد.
اخلاقیات داستان: در بین مولکول ها با وزن های مولکولی تقریبا مشابهنقطه جوش توسط گروه های عاملی موجود تعیین می شود.
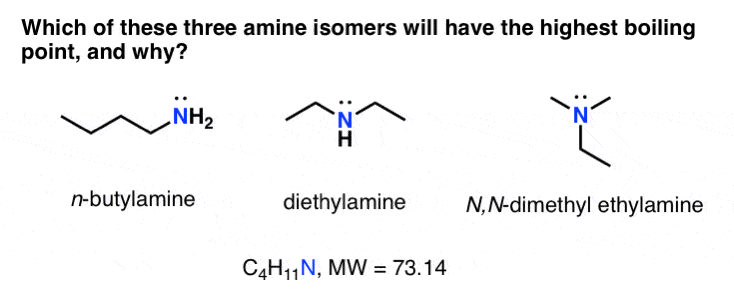
شما می توانید داستان مشابهی را برای ایزومرهای مشابه آمین و اسید کربوکسیلیک که در زیر نشان داده شده است بگویید.
برای بحث قبلی در مورد 4 نیروی بین مولکولی، اینجا را ببینید. برای مرجع در کتاب درسی رویش، اینجا را ببینید.
2. روند شماره 2 – برای مولکول هایی با یک گروه عملکردی معین، نقطه جوش با وزن مولکولی افزایش می یابد.
با افزایش وزن مولکولی در تمام این سری ها، به افزایش چشمگیر نقاط جوش نگاه کنید:
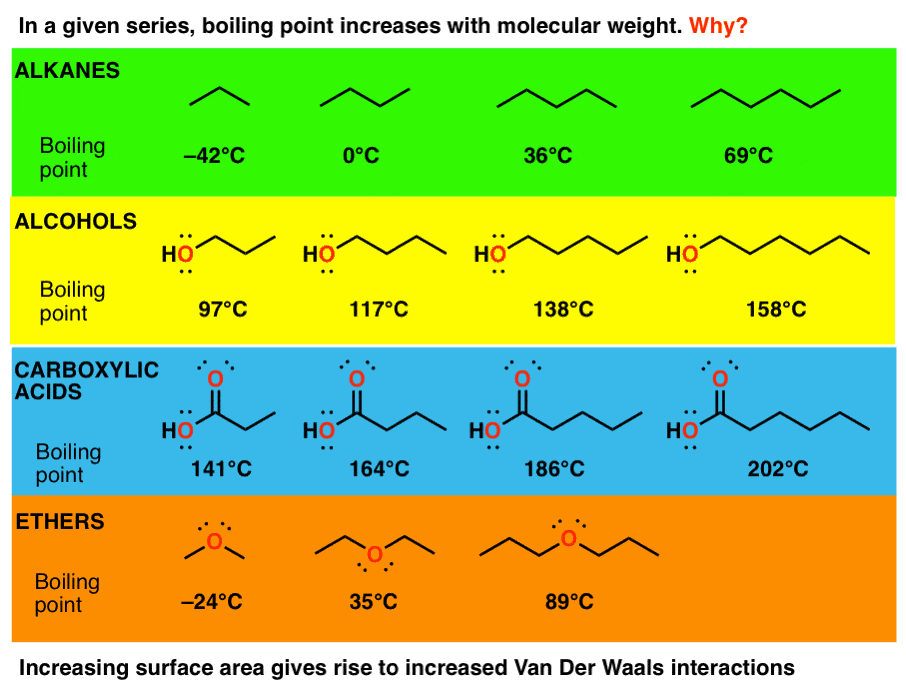
سوال اینجاست: چگونه، آیا دقیقاً نیروهای بین مولکولی با افزایش وزن مولکولی افزایش می یابد؟
خوب، نیروی کلیدی که در اینجا عمل می کند، نیروهای پراکندگی واندروالس هستند، که هستند متناسب با سطح. بنابراین با افزایش طول زنجیره، سطح سطح را نیز افزایش می دهید، به این معنی که توانایی تک تک مولکول ها را برای جذب یکدیگر افزایش می دهید.
در سطح شهودی، میتوانید این مولکولهای طولانی را با رشتههای اسپاگتی مقایسه کنید – هر چه رشتهها طولانیتر باشند، برای جدا کردن آنها کار بیشتری لازم است. با افزایش طول زنجیره، مناطقی وجود خواهد داشت که می توانند به خوبی در کنار یکدیگر قرار گیرند.
به طور جداگانه، هر تعامل ممکن است ارزش زیادی نداشته باشد، اما وقتی همه آنها را در طول یک زنجیره جمع کنید، نیروهای پراکندگی واندروالس می توانند اثرات فوق العاده ای داشته باشند.
3. نقش تقارن (یا عدم وجود آن) در نقطه ذوب و جوش
این یکی دیگر از محصولات جانبی وابستگی به سطح نیروهای پراکندگی واندروالس است – هر چه مولکولها میلهشکلتر باشند، بهتر میتوانند به هم ردیف شوند و به هم پیوند بخورند. برای مثال ماکارونی شهودی دیگر، چه چیزی بیشتر به هم می چسبد: اسپاگتی یا ماکارونی؟ هر چه مولکول کرویتر باشد، سطح آن کمتر خواهد بود و برهمکنشهای بین مولکولی واندروالسی کمتر عمل میکنند. نقطه جوش پنتان (36 درجه سانتیگراد) و 2،2-دی متیل پروپان (9 درجه سانتیگراد) را مقایسه کنید.
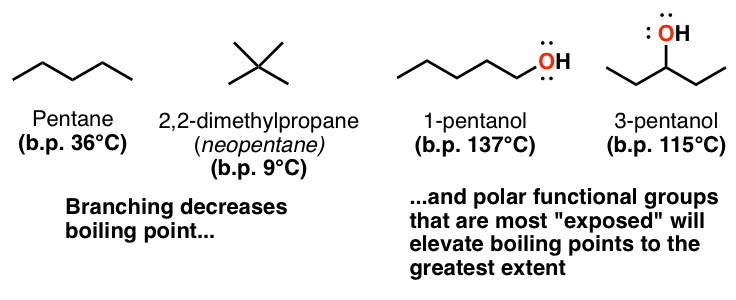
همچنین میتواند برای مولکولهای پیوند هیدروژنی مانند الکلها اعمال شود – برای مثال، نقاط جوش 1-پنتانول را با 2-pentanol و 3-pentanol مقایسه کنید. گروه هیدروکسیل 1-پنتانول بیشتر از 3-پنتانول (که توسط دو گروه آلکیل حجیم احاطه شده است) “در معرض” است، بنابراین بهتر می تواند با همنوعان خود پیوند هیدروژنی برقرار کند.
به طور خلاصه، سه عامل اصلی وجود دارد که باید در هنگام مواجهه با سوالی در مورد نقطه جوش به آنها فکر کنید. 1) چه نیروهای بین مولکولی در مولکول ها وجود خواهد داشت؟ 2) وزن های مولکولی چگونه با هم مقایسه می شوند؟ 3) تقارن ها چگونه با هم مقایسه می شوند؟
آخرین سوال سریع برای جاده (برای پاسخ به نظرات مراجعه کنید).
PS جدید! این جزوه رایگان 3 صفحه ای در مورد حل مشکلات رایج امتحان نقطه جوش را بررسی کنید!
MOC_Boiling_Point_Handout (PDF)
