واکنش های اسید و باز الکل ها
الکل ها ملایم هستند اسیدها الکل های آلیفاتیک معمولی (یعنی “آلکیل”) مانند اتانول، ایزوپروپانول و تی-بوتانول دارای pK استآ حدود 16-18، آنها را کمی اسیدی تر از آب می کند.
- الکل هایی که در صرف با باند پی یا حلقه معطر خواهد بود اسیدی تر از آنجایی که پایه مزدوج با رزونانس تثبیت شده است. یک مثال کلیدی فنل (C6اچ5اوه). (pKآ = 10).
- گروههای الکترونکش نزدیک، بار منفی پایه مزدوج را از طریق اثرات القایی تثبیت میکنند. به عنوان مثال، 2،2،2-تری فلوئورواتانول (pKآ = 12) به طور قابل توجهی اسیدی تر از اتانول (pK) استآ = 16).
الکل ها نیز ضعیف هستند پایه ها. آنها می توانند با اسیدهای قوی واکنش نشان دهند یون های اکسونیوم که دارای pK هستندآ از حدود -2.
یکی از کلیدهای واکنش الکل ها در حالی که به جلو می رویم این است که اسید مزدوج گروه ترک بهتری است و پایه مزدوج نوکلئوفیل بهتری است.
فهرست مطالب
- چهار نکته کلیدی برای مرور در مورد واکنش های اسید-باز
- واکنش های اسید-باز مطلوب و نامطلوب الکل ها (2 مثال)
- بررسی عوامل کلیدی تعیین کننده اسیدیته
- استفاده از این عوامل در اسیدیته الکل ها
- یک سوال تمرینی
- خلاصه: اسیدیته و پایه الکل ها
- خودت امتحان کن
1. چهار نکته کلیدی برای بررسی در مورد واکنش های اسید باز
- هر واکنش اسید-باز دارای 4 جزء است: یک اسید، آ پایه، آ اسید مزدوج، و الف پایه مزدوجوقتی اسید یک پروتون را از دست می دهد، تبدیل به باز مزدوج آن می شود. هنگامی که یک باز یک پروتون به دست می آورد، تبدیل به اسید مزدوج آن می شود. همانطور که در پست قبل گفته شد به باس مزدوج یک الکل an می گویند آلکوکسید. اسید مزدوج الکل را an می نامند یون اکسونیوم.
- ما معمولاً واکنش های اسید و باز را به عنوان یک تعادل توصیف می کنیم. در واکنش های اسید-باز، تعادل به سمتی خواهد رفت که اسید قوی تر و باز قوی تر اسید ضعیف تر و باز ضعیف تر تولید می کند.هنگامی که HCl را به NaOH اضافه می کنید، یک واکنش اسید-باز شدید رخ می دهد که منجر به تشکیل H می شود.2O (اسید ضعیف تر از HCl) و NaCl (باز ضعیف تر از NaOH). همانطور که بدون شک هنگام افزودن نمک خوراکی (NaCl) به آب متوجه شده اید، این واکنش به میزان قابل توجهی در جهت معکوس انجام نمی شود.
- اسیدیته را با استفاده از اصطلاحی به نام pK اندازه گیری می کنیمآ. این معیاری از ثابت تعادل برای گونه ای که پروتون را برای تشکیل قاعده مزدوج خود رها می کند. pKآ در مقیاس حدود 10- تا 50 است. شصت مرتبه قدر! هر چه pK بالاتر باشدآ اسیدیته آن کمتر است pK پایین ترآ (منفی تر) = اسیدی تر.
آب (pKآ از 15.7) اسید ضعیف تری نسبت به HCl (pK) استآ از 8-). - هرچه اسید قوی تر باشد، باز مزدوج ضعیف تر است. هرچه اسید ضعیف تر باشد، باز مزدوج قوی تر است. باز مزدوج اسید قوی HCl (pKآ -8) یون کلرید بی ضرر (Cl-)، یک باز بسیار ضعیف است. باز مزدوج اسید ضعیف H2O (pKآ 15.7) یون هیدروکسید قوی (HO-) است.
2. نمونه هایی از واکنش های اسید و باز الکل ها
در اینجا نمونه ای از واکنش اسید-باز مطلوب الکل ها آورده شده است. توجه داشته باشید که چگونه از اسید قوی تر و باز قوی تر به اسید ضعیف تر و باز ضعیف تر می رویم [pKa values tell us for sure] در اینجا، deprotonation بسیار مطلوب است. توجه داشته باشید که پایه مزدوج الکل را آلکوکسید می نامند.
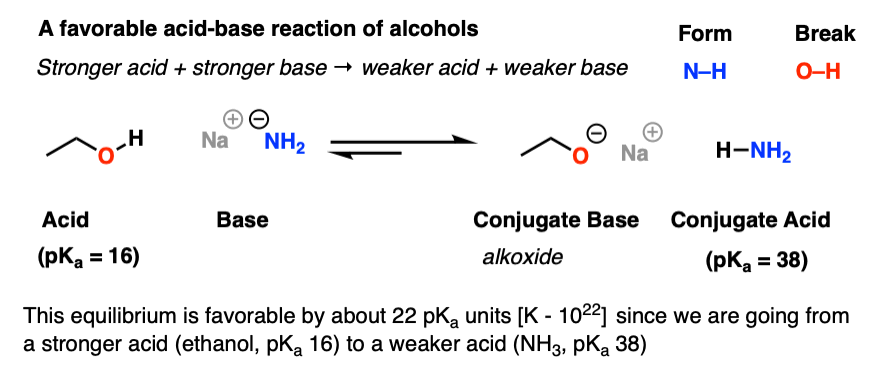
در اینجا نمونه ای از واکنش اسید-باز (بسیار) نامطلوب الکل ها آورده شده است: پروتوناسیون یک الکل توسط NH3. مهمترین دلیل نامطلوب بودن این امر این است که ما از اسید ضعیف تر (pKآ 38) و باز ضعیف تر به اسید قوی تر (pKآ -2) و پایه قوی تر. ثابت تعادل حدود 40 مرتبه بزرگی در جهت اشتباه است!
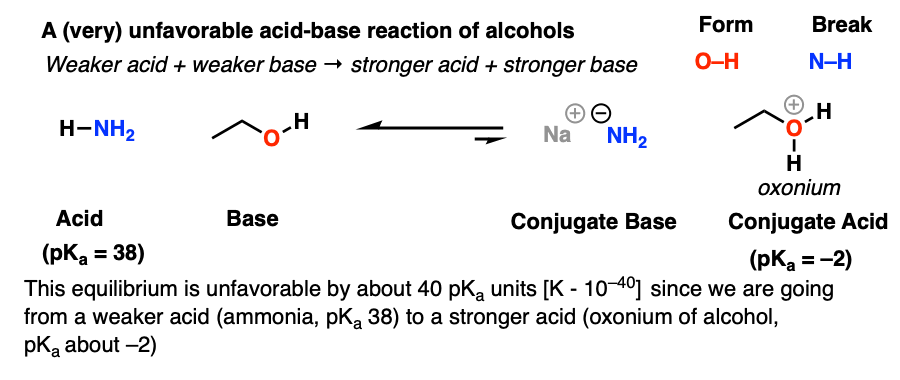
3. بررسی عوامل کلیدی تعیین کننده اسیدیته
به هر حال چه چیزی تعیین می کند که یک مولکول چقدر اسیدی است؟
عامل کلیدی در تعیین اسیدیته پایداری پایه مزدوج است. هر عاملی که باعث پایداری باز مزدوج شود، اسیدیته اسید را افزایش می دهد.
دقیقا چه معنی میدهد؟ معمولاً به این معنی است تثبیت بار منفی از آنجایی که باز مزدوج همیشه یک واحد بار «منفی» تر از اسید خواهد بود.
بار منفی چگونه تثبیت می شود؟ دو راه.
- ابتدا با نزدیک کردن بار به هسته با بار مثبت [“opposite charges attract”, remember]. در سراسر یک ردیف برای مثال، از جدول تناوبی، با رفتن از H، پایه کاهش می یابد3سی– به اچ2ن– به HO– به اف– زیرا الکترونگاتیوی اتم در حال افزایش است. این بار منفی نزدیکتر به هسته نگه داشته می شود و بنابراین پایدارتر است. یک قانون سرانگشتی خوب این است: «هر چه یک جفت تنها پایدارتر باشد، پایه کمتری دارد. به همین دلیل است گونه های خاصی توسط گروه های الکترون گیر مجاور اسیدی می شوند.
- دومین، با پخش شارژ روی حجم بزرگتر. شارژ پراکنده پایدارتر از شارژ متمرکز است. به عنوان مثال، در یک ردیف از جدول تناوبی، با رفتن از F، پایه کاهش می یابد– به Cl– به برادر– به من– زیرا آن بار منفی روی حجم بیشتری (اتم های بزرگتر) پخش می شود. گفته می شود اتم های بزرگتر «قطبی پذیرتر» هستند. [Note that this effect dominates rather than electronegativity in this case.] به همین دلیل است رزونانس به تثبیت شارژها کمک می کند. بار در چند اتم پخش می شود، بنابراین چگالی بار فردی کاهش می یابد.
4. استفاده از این اصول برای اسیدیته الکل
این اصول چگونه با الکل ها ارتباط دارند؟ در واقع بسیار ساده است. از آنجایی که ما همیشه یک اتم (اکسیژن) را با هم مقایسه خواهیم کرد، نیازی نیست نگران روندهای دوره ای باشیم و فقط باید روی آن تمرکز کنیم. رزونانس و گروه های الکترون گیر مجاور.
الکل هایی که در آن پایه مزدوج است رزونانس تثبیت شد اسیدی تر خواهد بود نمونه کلاسیک سیکلوهگزانول و فنل است.
سیکلوهگزانول دارای pK استآ یک الکل معمولی (حدود 16 عدد). pKآ فنل، با این حال، در مورد 10. بیایید نگاه کنیم:
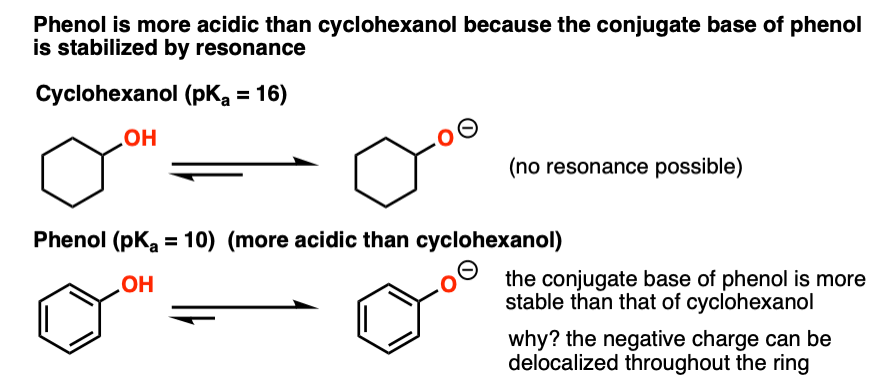
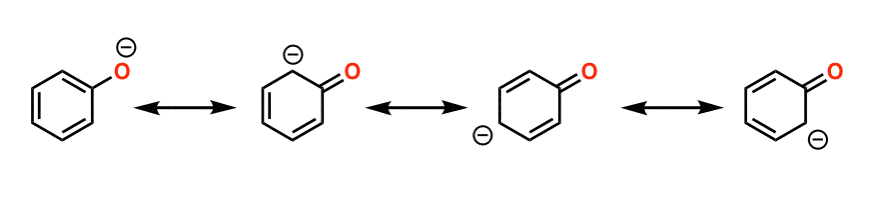
ببینید چگونه بار منفی روی اکسیژن فنل می تواند به داخل حلقه بازگردد؟ این بدان معناست که بار می تواند در سراسر مولکول پخش شود که در حال تثبیت است. هر عاملی که پایه مزدوج را تثبیت کند اسیدیته را افزایش می دهد.
در اینجا یک مثال دیگر است. مقایسه اتانول (pKآ 16) تا 2،2،2-تری فلوئورواتانول (pKآ حدود 12). به نظر شما چرا تری فلوئورواتانول اسیدی تر است؟
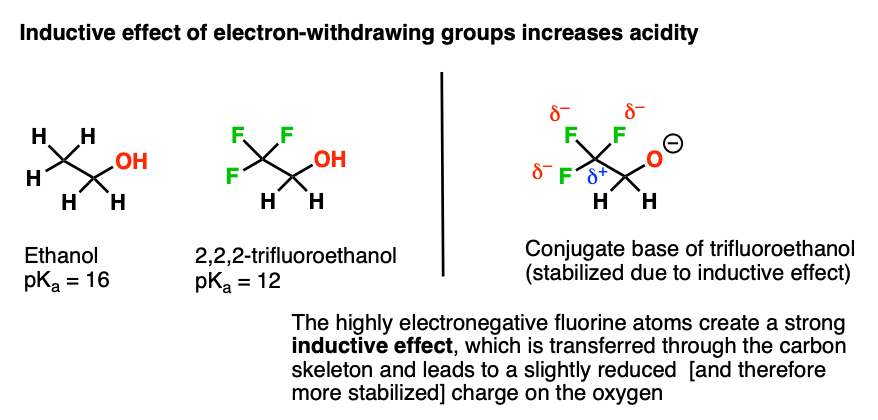
پایه های مزدوج آنها را مقایسه کنید. فلوئور در اینجا چه می کند تا پایه مزدوج را پایدارتر کند؟
این نمونه ای از یک است اثر القایی. فلوئور که به شدت الکترونگاتیو است، چگالی الکترون را از کربن همسایه دور می کند. آن کربن که اکنون الکترون ضعیفی دارد، چگالی الکترون را از کربن همسایه دور می کند. و این کربن، به دلیل اینکه کمی الکترونی ضعیف است، می تواند مقداری چگالی الکترون را از اکسیژن دور کند.
نتیجه خالص این است که اکسیژن چگالی الکترونی کمتری دارد که در حال تثبیت است. از نو، تثبیت پایه مزدوج -> افزایش اسیدیته.
این همچنین اگر تغییرات الکل را در جایی که فاصله بین OH و اتم فلوئور را تغییر میدهیم، مقایسه کنیم.
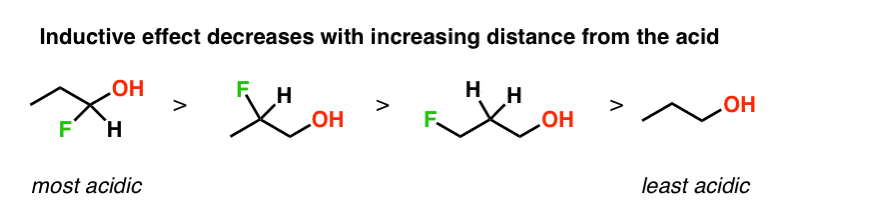
این به این دلیل است که هر چه از اتم الکترونگاتیو دورتر می شویم، مقدار اثر القایی کاهش می یابد.
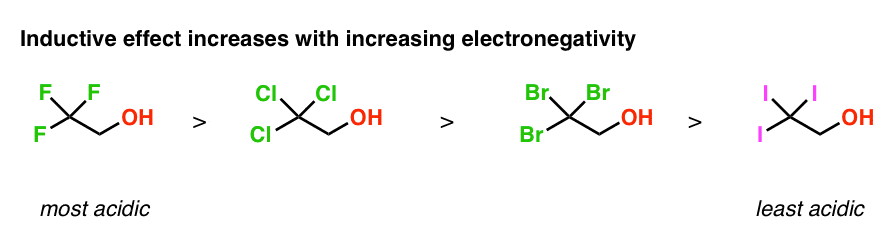
همچنین می توانیم از روندهای الکترونگاتیوی برای تعیین ترتیب اسیدیته در این مولکول ها استفاده کنیم. از آنجایی که فلوئور الکترونگاتیوتر از کلر است که الکترونگاتیوتر از برم که الکترونگاتیوتر از ید است، اثر القایی برای CF بالاترین خواهد بود.3 و کمترین برای CI3.
5. یک سوال تمرینی
در نهایت یک مثال آخر. حتی میتوانیم به مثالهایی فکر کنیم که این دو اثر با هم ترکیب شدهاند:
به نظر شما کدام یک ممکن است در اینجا اسیدی تر باشد؟
6. خلاصه: اسیدیته الکل ها
اکنون که عوامل کلیدی حاکم بر اسیدیته الکل ها را پوشش داده ایم، آمادگی بیشتری برای ورود به واکنش های مختلف آنها داریم. در پست بعدی شروع به بحث خواهیم کرد که چگونه اسیدیته و بازی بر شرایط واکنشی که می توانیم استفاده کنیم تأثیر می گذارد.
برای الکل ها، از آنجایی که ما همیشه با اکسیژن سروکار داریم، تنها عوامل مرتبط در اینجا هستند رزونانس و گروه های خارج کننده الکترون.
پست بعدی – سنتز اتر ویلیامسون
یادداشت
مقالات مرتبط
خودت امتحان کن
(پیشرفته) مراجع و مطالعه بیشتر
1. داده های اسیدی-بازی جمع آوری شده
این وب سایت از دانشگاه استونی دارای فهرست بزرگی از مطالعات در مورد اسیدیته و بازی ترکیبات آلی مختلف است.
در اینجا یک مرجع برجسته است. این مقادیر pKa به استونیتریل به عنوان حلال اشاره دارد، بنابراین به طور قابل توجهی با مقادیر اندازه گیری شده در محلول آبی متفاوت است، اگرچه روند کلی یکسان خواهد بود.
2. نقاط قوت اسیدها در استونیتریل
A. Kütt, S. Tshepelevitsh, J. Saame, M. Lõkov, I. Kaljurand, S. Selberg, I. Leito
یورو J. Org. شیمی. 2021، 2021، 1407.
DOI: doi.org/10.1002/ejoc.202001649
(دسترسی آزاد)
