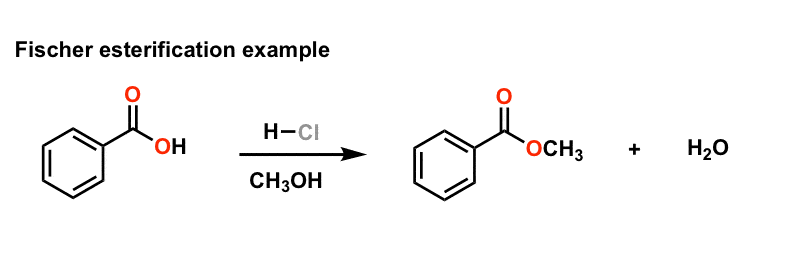
وقتی چند هفته پیش در مورد 10 مفهوم کلیدی در شیمی کربونیل صحبت کردم، موضوعی وجود داشت که می خواستم در مورد آن عمیق تر صحبت کنم اما از آن صرف نظر کردم. آن موضوع است کاتالیز اسیدی، و هر بحثی در مورد کربونیل ها بدون آن نادیده گرفته می شود. بیایید با انجام یک واکنش واقعاً ساده که احتمالاً در آزمایشگاه های خود انجام داده اید، به موضوع برگردیم. به آن می گویند استریفیکاسیون فیشر و دو نقش کلیدی که اسیدها می توانند در کمک به واکنش های شیمیایی ایفا کنند را نشان می دهد.
استریفیکاسیون فیشر واکنش بین یک اسید کربوکسیلیک و یک الکل برای ایجاد یک استر است. شما معمولاً واکنش را با حل کردن کربوکسیلیک اسید در الکلی که می خواهید استر با آن بسازید انجام دهید (مثلاً اتانول برای ساخت اتیل استر). دلیل اینکه شما این کار را انجام می دهید این است که این یک واکنش تعادلی است: محصول شما آب است، بنابراین با استفاده از الکل خود به عنوان حلال، واکنش معکوس را که هیدرولیز استر برای بازگرداندن اسید است، به طور موثری از بین می برید. مرحله نهایی تنظیم واکنش افزودن یک اسید قوی (مانند HCl یا اسید توزیک) و شروع گرمایش است. پس از یک یا دو ساعت در رفلاکس، حلال را جدا میکنید و voilá – استر خود را دارید.
عامل شماره 1: اسیدها باعث افزایش الکتریسیته می شوند
در اینجا مشاهده شماره 1 است. بدون کاتالیزور اسیدی، واکنش به طرز دردناکی کند است. شما می توانید این گرما را برای یک هفته بگذارید و واکنش به سختی به جایی می رسد. چگونه این را به بهترین شکل توضیح دهیم؟ خب دو دلیل داره بیایید مکانیزم را با جزئیات بررسی کنیم:
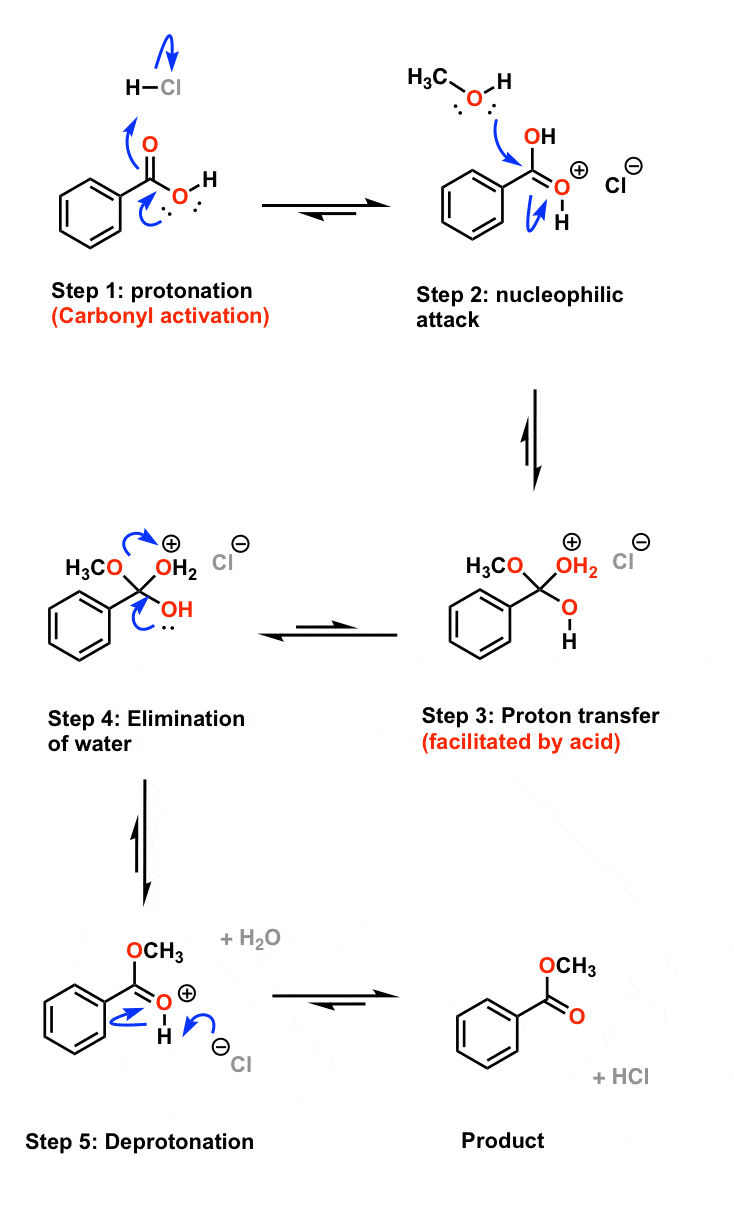
متوجه خواهید شد که اولین مرحله واکنش پروتونه شدن اکسیژن کربونیل توسط اسید قوی است. از نظر مکانیکی، ممکن است پروتونه کردن OH وسوسه انگیز باشد، زیرا می دانیم که این گروهی است که می رود. در حقیقت، اکسیژن کربونیل ابتدا پروتونه می شود زیرا هسته دوست ترین مکان است. اکنون، زمانی که کربونیل پروتونه می شود، مقداری از چگالی الکترون اکسیژنی که برای اهدا به کربن کربونیل در دسترس بود، توسط پیوند OH جدید جذب می شود. بنابراین، اثر خالص پروتونه شدن، تضعیف پیوند π اکسیژن کربن است. که ما را به این می رساند: پروتونه شدن کربونیل کربن کربونیل را به الکتروفیل قوی تری تبدیل می کند. [This is true for all carbonyls, by the way, not just carboxylic acids.] این بدان معنی است که با هر هسته دوستی که ممکن است در محلول موجود باشد، سریعتر واکنش نشان می دهد. در مورد ما، الکل.
البته توجه داشته باشید که در واکنش ما از متانول استفاده می کنیم که یک هسته دوست بسیار ضعیف است. این مهم است. برای واکنشی که شامل کاتالیز اسیدی است، استفاده از یک هسته دوست که تحت شرایط واکنش به طور برگشت پذیر پروتونه می شود، بسیار مهم است.. به عنوان مثال، اگر در این واکنش از گریگنارد یا حتی یک آمین استفاده کنیم، اسید به جای اکسیژن کربونیل به جفتهای آبدار آن نوکلئوفیلها (به طور غیرقابل برگشت) برخورد میکند و هسته دوست ما نان تست میشود. نتیجه: هیچ واکنشی در کربونیل وجود ندارد. بنابراین اگر میخواهیم از مزیت کاتالیز اسید استفاده کنیم، باید این را در نظر داشته باشیم.*
عامل شماره 2: اسید ترک گروه را بهتر می کند
بیایید به دومین عاملی که کاتالیز اسیدی را مؤثر میسازد نگاه کنیم. در قسمت 3 مکانیسم، پس از حمله الکل، ما با 3 پیوند کربن-اکسیژن باقی میمانیم. اکنون همانطور که می دانید، طبیعت در اکثر شرایط از یون هیدروکسیل OH به عنوان یک گروه ترک متنفر است. با این حال، هنگامی که یک کاتالیزور اسیدی وجود دارد، آن OH به راحتی به OH2 پروتونه می شود و گروه خروجی ما به آب تبدیل می شود که یک گروه ترک فوق العاده است. پس اصل دوم اینجاست: اسید تا حد زیادی حذف گروه ترک را تسهیل می کند. بیایید این را در منظر قرار دهیم: pKa H2O حدود 16 است. این تعادل بین H2O و OH¯ است – یعنی معیار خوبی برای OH¯ به عنوان یک گروه ترک. آن را با pKa H3O(+) مقایسه کنید که 1.7- است. اساساً چیزی که من می گویم این است که آب یک گروه خروجی بهتر از OH¯ در حدود 10 به توان 17 است. [This is your cue to say “Holy f*ck!”]. این قدرت کاتالیز اسید است.
بدون افزودن اسید، کربوکسیلیک اسید و الکل فقط در فلاسک واکنش به یکدیگر خیره می شوند، تصادفاً به یکدیگر برخورد می کنند و بدون تغییر به زندگی خود ادامه می دهند. کاتالیزور اسیدی ماده خاصی است که یک مهمانی واقعا لنگ را به چیزی تبدیل می کند که در حافظه بلند مدت شما سوخته است. مهارها به طور ناگهانی ناپدید می شوند. موانع کاهش یافته است. ناگهان، جهمیستری اتفاق می افتد!
