سیکلوبوتادین: نمودار مداری مولکولی، ضد آروماتیک بودن و ساختار
پیش از این، دیدیم که اوربیتالهای مولکولی بنزن چگونه به نظر میرسند، و این واقعیت که آنها تا حدی دوبلکس هستند (یا بهعنوان نامگذاری مناسب، “محوول”) به توضیح پایداری غیرعادی بنزن کمک میکند.
بیایید سکه را برگردانیم. چه در مورد سیکلوبوتادین، مولکولی که ما معمولاً آن را به عنوان آنتی آروماتیک طبقه بندی می کنیم. چرا اینقدر غیرعادی است ناپایدار?
دوباره، بررسی اوربیتال های مولکولی pi سرنخ های مفیدی به ما می دهند.
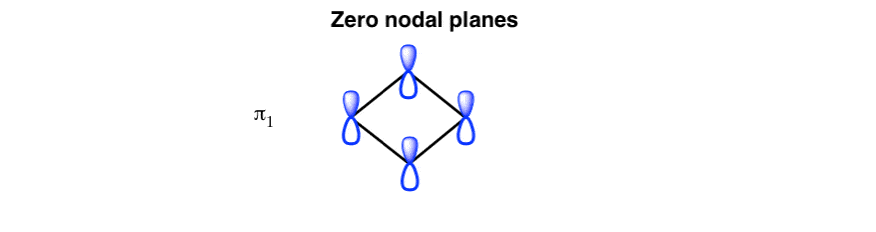
1. ایجاد نمودار مداری مولکولی سیکلوبوتادین: اوربیتال مولکولی کم انرژی دارای صفحات گرهی صفر است.
امروز، بیایید اوربیتال های سیکلوبوتادین را با استفاده از اصولی که در پست های قبلی مورد بحث قرار دادیم بسازیم و ببینیم که آیا می توانیم بینش مفیدی به دست آوریم.
سیکلوبوتادین دارای سیستم پی متشکل از 4 اوربیتال p اتمی منفرد است و بنابراین در مجموع باید دارای اوربیتال های مولکولی 4 پی.
اوربیتال مولکولی کم انرژی: صفحات گرهی صفر
به دنبال تشبیه «آپارتمانسازی» ما از دفعه قبل، اوربیتال مولکولی کمانرژی (در صورت تمایل، «طبقه همکف» سیکلوبوتادین) باید تمام فازهای اوربیتالهای p را تراز و سطوح گرهای صفر داشته باشد، مانند این:
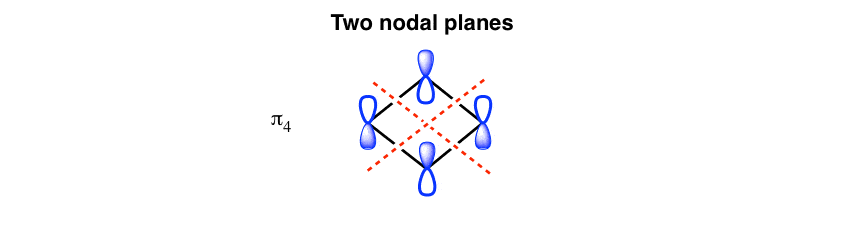
2. اوربیتال مولکولی پر انرژی دو صفحه گره دارد
برعکس، اوربیتال های pi با بالاترین انرژی (“پنت هاوس”) دارای تمام فازهای متناوب خواهند بود و بنابراین دارای دو هواپیماهای گره ای (همانطور که دفعه قبل گفتیم، “پنت هاوس” دقیقاً املاک و مستغلات مطلوبی برای الکترون ها نیست)
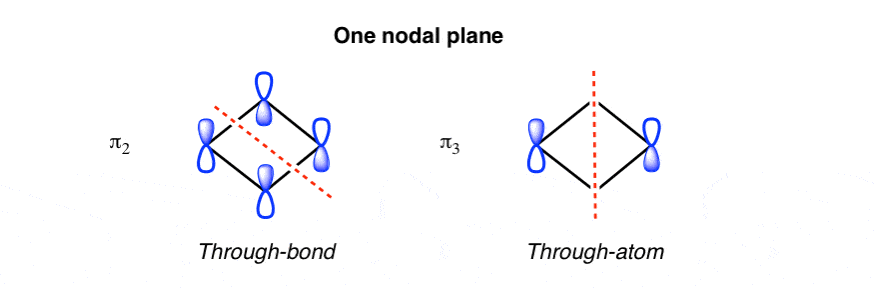
3. دو اوربیتال مولکولی پی میانی هر کدام یک صفحه گره دارند (دو روش مختلف)
که ما را با اوربیتال های pi میانی که هر کدام دارای a هستند، باقی می گذارد تنها هواپیمای گره ای همانند بنزن، دو راه برای قرار دادن یک صفحه گرهی منفرد روی سیکلوبوتادین، از طریق پیوندها یا از طریق اتم ها وجود دارد:
این چهار اوربیتال مولکولی ما را به ما می دهد. اکنون اجازه دهید آنها را با “مستاجرها” پر کنیم: الکترون های پی.
4. نمودار مداری مولکولی سیکلوبوتادین نشان می دهد که چرا سیکلوبوتادین بسیار ناپایدار است: دارای الکترون های جفت نشده با انرژی برابر است.
سیکلوبوتادین در مجموع دارای 4 الکترون پی است. بنابراین با رتبه بندی تمام اوربیتال های مولکولی pi بر اساس انرژی، و پر کردن اوربیتال ها بر اساس قانون Hunds، تصویر زیر را دریافت می کنیم:
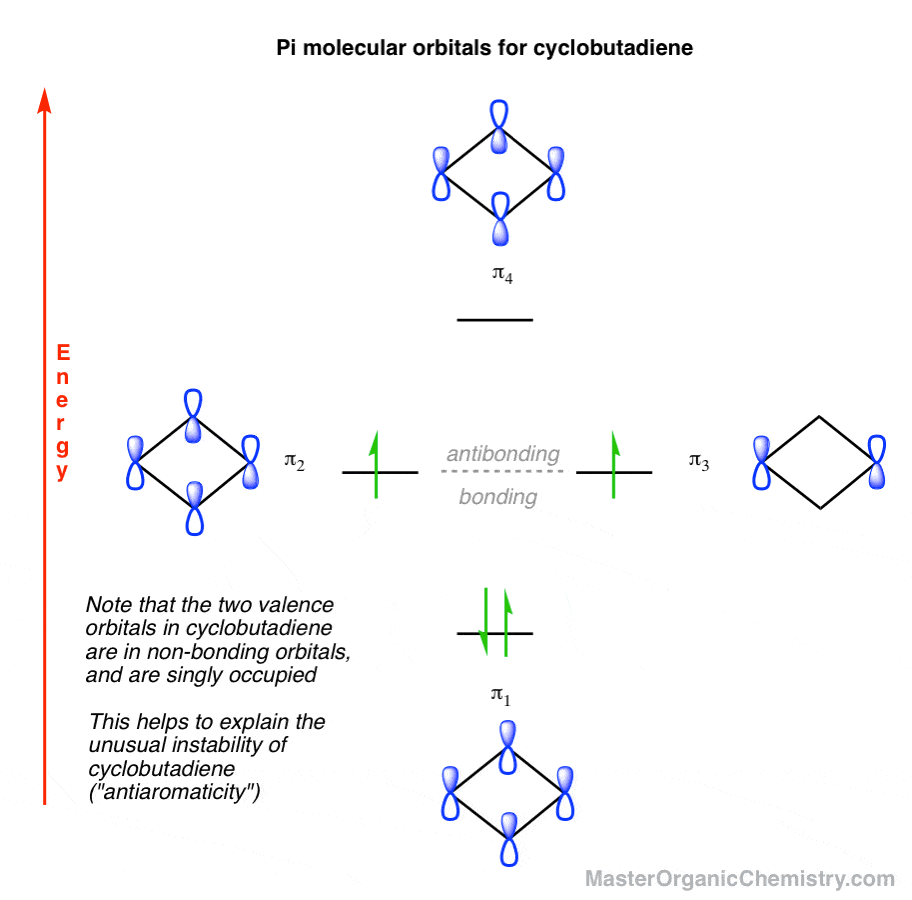
آیا می توانید ببینید که چرا سیکلوبوتادین ممکن است ناپایدار باشد؟
- اول، اوربیتالهای مولکولی سیکلوبوتادین که بیشترین اشغال را دارند، هستند غیر پیوندی اوربیتال ها، انرژی متوسط بین کمترین (π1، پیوند) و بالاترین (π4اوربیتال های انرژی ضد پیوند). «عدم پیوند» به این معنی است که پر کردن این اوربیتالها با الکترون منجر به تثبیت مولکول نمیشود.
- دوم، توجه داشته باشید که هر یک از اوربیتال های غیر پیوندی هستند به تنهایی مشغول. بنابراین این تصویر مداری پیش بینی می کند که سیکلوبوتادین باید دارای یک افراطی طبیعت ما عادت کردهایم رادیکالهای آزاد را بهعنوان واسطههای بسیار واکنشپذیر بدانیم… بنابراین میتوانید تصور کنید که گونهای حاوی دو رادیکال های آزاد حتی بیشتر واکنش نشان می دهند! [Note ]
5. خلاصه: نمودار مداری مولکولی سیکلوبوتادین
نکته اصلی در اینجا این است که تصویر مداری مولکولی pi از سیکلوبوتادین با مشاهدات ما که سیکلوبوتادین به طور غیرمعمولی ناپایدار است، مطابقت دارد. (همانطور که قبلاً اشاره شد، سیکلوبوتادین تنها به عنوان یک “گونه ایزوله شده از ماتریس” جدا شده است – یعنی گونه ای که در یک گاز بی اثر در دمای بسیار پایین منجمد شده است. گرم شدن تا دمای 80- درجه منجر به خود تخریبی می شود. توجه)
امیدواریم این دو پست به نشان دادن این که نمودارهای مداری مولکولی می توانند سرنخ های بسیار مفیدی در مورد پایداری مولکولی ارائه دهند، کمک کرده باشد!
در پست بعدی یک میانبر بسیار راحت را پوشش خواهیم داد که به ما کمک می کند نمودارهای مداری مولکولی را به سرعت در عرض چند ثانیه ترسیم کنیم (بله، واقعاً!) به نام حلقه های یخبندان یا، ساده تر، روش Polygon.
یادداشت
1. محاسبات پیشرفتهتر، بسیار فراتر از آنچه که در مورد آن بحث خواهیم کرد، پیشبینی میکنند که سیکلوبوتادین به شکل مستطیلی منحرف میشود که در نتیجه دو اوربیتال تک اشغال شده به دو اوربیتال با انرژی کمی متفاوت تبدیل میشوند، یکی دوبرابر و دیگری خالی. طول پیوند سیکلوبوتادین اندازه گیری شده است که شکل مستطیلی را تایید می کند.

توجه داشته باشید که الکترونهای پی مانند بنزن «دلوکالیزه» نیستند.
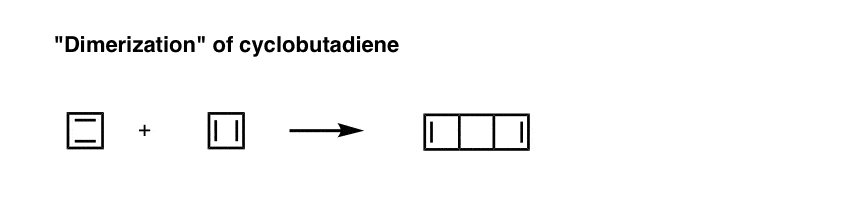
2. پس از گرم شدن (80- درجه برای این اهداف “گرم” در نظر گرفته می شود)، سیکلوبوتادین با خود از طریق فرآیند Diels-Alder واکنش می دهد تا گونه های “دایمریک” ایجاد کند.
3. اگر بنزن حدود 36 کیلوکالری در مول از سیکلوهگزاترین (تئوری) پایدارتر باشد، سیکلوبوتادین دقیقا چقدر ناپایدار است؟ در انرژی رزونانس منفی سیکلوبوتادین 54.7- کیلوکالری در مول، نسبت به 1،3-بوتادین محاسبه شده است. علاوه بر این، 30.7 کیلوکالری در مول سویه یافت می شود که بی ثباتی کلی 85.4 کیلوکالری در مول را نشان می دهد. [Ref]
(پیشرفته) مراجع و مطالعه بیشتر
- سیکلوبوتادین
Watts، JD Fitzpatrick و R. Pettit
مجله انجمن شیمی آمریکا 1965، 87 (14)، 3253-3254
DOI: 10.1021/ja01092a049
جالب توجه است، این مقاله قبل از مقاله ای در مورد واکنش سیکلوبوتادین-تری کربنیل آهن است. سیکلوبوتادین با اکسیداسیون آن کمپلکس آلی فلزی با استفاده از Ce تهیه می شود4+، که سپس در محل با یک آلکین به دام می افتد. - سیکلوبوتادین
توماس بالی، ساتورو ماسامونه
چهار وجهی 1980، 36 (3)، 343-370
DOI: 1016/0040-4020(80)87003-7
این مقاله از سال 1980 به بررسی کار انجام شده روی سیکلوبوتادین تا آن زمان می پردازد. این به 2 بخش تقسیم می شود – تلاش های مصنوعی تجربی و محاسبات نظری. درمان های دقیق MO و محاسبات نظری نشان می دهد که پایدارترین هندسه برای سیکلوبوتادین مستطیل شکل است. - سطوح انرژی بالقوه سیکلوبوتادین: محاسبات اولیه SCF و CI برای حالت های تک و سه گانه کم ارتفاع
A. Jafri و MD Newton
مجله انجمن شیمی آمریکا 1978، 100 (16)، 5012-5017
DOI: 10.1021/ja00484a016 - سطوح بالقوه برای پایین ترین حالت های منفرد و سه گانه سیکلوبوتادین
وستون تاچر بوردن، ارنست آر دیویدسون و پل هارت
مجله انجمن شیمی آمریکا 1978، 100 (2)، 388-392
DOI: 10.1021/ja00470a006 - مطالعه نظری ساختار سیکلوبوتادین
کولمار و وی. استاملر
مجله انجمن شیمی آمریکا 1977، 99 (11)، 3583-3587
DOI: 10.1021/ja00453a009 - حالت های پایه مولکول ها 36. مسئله سیکلوبوتادین و محاسبات MINDO/3 فرکانس های ارتعاش مولکولی
مایکل جی اس دوار و اندرو کومورنیکی
مجله انجمن شیمی آمریکا 1977، 99 (19)، 6174-6179
DOI: 10.1021/ja00461a002
تجزیه و تحلیل طیفهای IR محصول و آنالوگهای دوترهشده تولید شده از پیشسازهای نشاندار، نتیجهگیری نظری را تایید میکند که سیکلوبوتادین یک مولکول مستطیلی است: - سیکلوبوتادین مربع نیست
ساتورو ماسامونه، فرناندو آ. سوتو باچیلر، تاکاهیسا ماچیگوچی و جان ای. برتی
مجله انجمن شیمی آمریکا 1978، 100 (15)، 4889-4891
DOI: 1021/ja00483a043
آه، برای روزهایی که روزنامه ها عناوین ساده و تند داشتند (مراجعات 1 و 2 در بالا). - محاسبه مرتبه دوم مولر-پلست از ابتدا در مورد طیف ارتعاشی سیکلوبوتادین و مشتقات ایزوتوپی آن
آندس هس جونیور، پی. کارسکی و ال جی شااد
مجله انجمن شیمی آمریکا 1983، 105 (4)، 695-701
DOI: 10.1021/ja00342a003 - دیمر شدن سیکلوبوتادین یک مطالعه نظری CASSCF از ابتدا
یی لی و و KN Houk
مجله انجمن شیمی آمریکا 1996، 118 (4)، 880-885
DOI: 10.1021/ja921663m - Ab Initio محاسبه انرژی های تشدید. بنزن و سیکلوبوتادین
A. Hess, Jr. و LJ Schaad
مجله انجمن شیمی آمریکا 1983، 105 (26)، 7500-7505
DOI: 10.1021/ja00364a600
مقاله ای از دهه 80 با استفاده از روش های محاسباتی برای تعیین کمیت بی ثباتی ضد آروماتیک سیکلوبوتادین. این نویسندگان مقدار -54.7 کیلوکالری در مول برای انرژی رزونانس منفی سیکلوبوتادین به دست می آورند. - تعیین تجربی ضد آروماتیک بودن سیکلوبوتادین
آشوک ای. دنیز، کوین اس پیترز، گری جی اسنایدر
علوم پایه 1999، 286 (5442)، 1119-1122
DOI: 1126/science.286.5442.1119
این مقاله بسیار دقیقی است که از تکنیکهای طیفسنجی جدید برای تعیین بیثباتی ضد آروماتیک سیکلوبوتادین استفاده میکند. سیکلوبوتادین نسبت به مرجع فرضی دی ان مزدوج و بدون کرنش، در مجموع 87 کیلوکالری در مول بیثبات میشود که 32 کیلوکالری در مول آن را میتوان به کرنش حلقه و 55 کیلوکالری در مول را به ضد آروماتیک بودن نسبت داد (در مقایسه با 21 کیلو کالری در مول). برای تثبیت آروماتیک بنزن). - Quantentheoretische Beiträge zum Benzol problem
Die Elektronenkonfiguration des Benzols und Verwandter Verbindungen
اریش هوکل
Zeitschrift für Physik 1931، 70، 204-286
DOI: 10.1007/BF01339530
اریش هوکل با شرح و بسط نظریه الکترولیت های قوی در سال 1923 و بعداً با استفاده از یک نسخه ساده شده از نظریه کوانتومی برای الکترون های p در مولکول های مزدوج، که به عنوان نظریه اوربیتال مولکولی هوکل (HMO) شناخته شد، به رسمیت شناخته شد. اگرچه او هرگز به صراحت یک قانون “4n + 2” را تدوین نکرد، اما این از کار او آشکار بود. هاکل نشان داد که سیستم های تک حلقه ای با مزدوج پیوسته دارای 6، 10، 14 و غیره الکترون p از تثبیت اضافی بهره می برند و معطر هستند. اما دقیق تر است که به «قانون 4n + 2 p-الکترون هاکل» اشاره کنیم تا به «قانون هاکل». - یک دستگاه یادگاری برای انرژی های مداری مولکولی
آرتور آ. فراست و بوریس موسولین
جی. شیمی. فیزیک 1953، 21، 572
DOI: 10.1063/1.1698970
منشاء دستگاه یادگاری “دایره فراست” برای تعیین MO در سیستم های الکتروسیکلیک.
