خواصی مانند نقطه ذوب و جوش معیاری هستند که نشان می دهد نیروهای جاذبه بین اتم ها یا مولکول ها چقدر قوی هستند. (ما به اینها می گوییم بیننیروهای مولکولی – نیروها بین مولکول ها بر خلاف داخلنیروهای مولکولی – نیروهای درون یک مولکول. )
همه چیز از این اصل کلی سرچشمه می گیرد: با قطبی شدن پیوندها، بارهای روی اتم ها بیشتر می شود که منجر به جاذبه های بین مولکولی بیشتر می شود که منجر به نقاط جوش بالاتر می شود.
چهار دسته اصلی از برهمکنشهای بین مولکولها وجود دارد و همگی تظاهرات متفاوتی از «جذب بارهای مخالف» هستند.
اکنون در دسترس است – این جزوه عالی (رایگان) 3 صفحه ای در مورد چگونگی حل مشکلات رایج نقطه جوش را دانلود کنید. با 10 مثال از مسائل حل شده! (همچنین شامل تمام نکات کلیدی مورد بحث در این پست است)
MOC_Boiling_Point_Handout (PDF)
چهار نیروی کلیدی بین مولکولی به شرح زیر است:
پیوندهای یونی > پیوند هیدروژنی > برهمکنش های دوقطبی-دوقطبی واندروالس > نیروهای پراکندگی واندروالس
بیایید به آنها به صورت جداگانه، از قوی ترین تا ضعیف ترین نگاه کنیم.
فهرست مطالب
- نیروهای یونی
- پیوند هیدروژنی
- تعاملات دوقطبی-دوقطبی وان دروالس
- نیروهای پراکنده واندروالس (“نیروهای لندن”)
- خط پایین
1. نیروهای یونی
یونی برهمکنش های بین اتم ها یا مولکول های باردار (“یون”) است. یونهای دارای بار مثبت مانند Na(+)، Li(+)، و Ca(2+)، کاتیون نامیده میشوند. یون های دارای بار منفی، مانند Cl(-)، Br(-)، HO(-) آنیون نامیده می شوند (من همیشه این را با یادآوری اینکه “N” در “Anion” مخفف “منفی” است) متوجه شدم.) نیروهای جاذبه بین یون های دارای بار مخالف توسط قانون کولن توضیح داده می شود که در آن نیرو با افزایش بار افزایش می یابد و با افزایش فاصله بین این یون ها کاهش می یابد. ماهیت بسیار قطبی (باردار) مولکول های یونی در نقاط ذوب بالای آنها (NaCl دارای نقطه ذوب 801 درجه سانتیگراد است) و همچنین در حلالیت بالای آنها در آب (به هر حال برای نمک های فلزات قلیایی؛ فلزاتی که بارهای متعدد تشکیل می دهند منعکس می شود. دوست دارید بقایایی را روی وان حمام خود بگذارید)
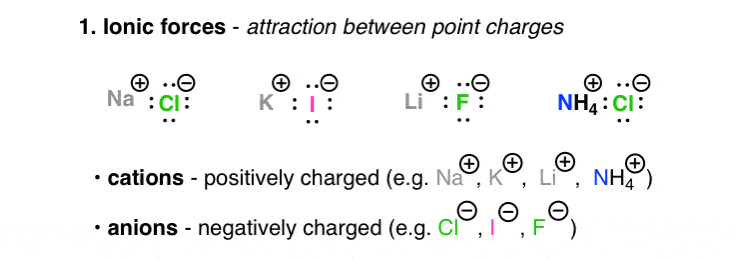
2. پیوند هیدروژنی
پیوند هیدروژنی در مولکول های حاوی عناصر بسیار الکترونگاتیو F، O یا N که مستقیماً به هیدروژن متصل می شوند، رخ می دهد. از آنجایی که H دارای الکترونگاتیوی 2.2 است (در مقایسه با 0.9 برای Na و 0.8 برای K)، این پیوندها به اندازه پیوندهای یونی کاملاً قطبی نیستند و دارای برخی خصوصیات کووالانسی هستند. با این حال، پیوند به هیدروژن همچنان قطبی شده و دارای دوقطبی خواهد بود.
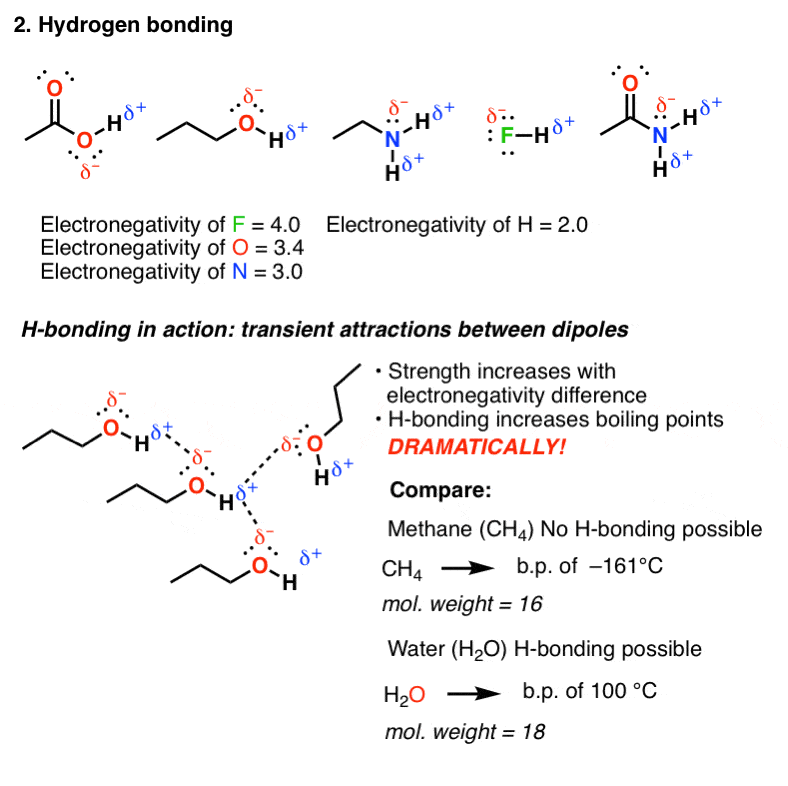
دوقطبی یک مولکول می تواند با دوقطبی مولکول دیگر هماهنگ شود و منجر به برهمکنش جذابی شود که ما آن را پیوند هیدروژنی می نامیم. به دلیل حرکت سریع مولکولی در محلول، این پیوندها گذرا (کوتاه عمر) هستند، اما دارای استحکام باند قابل توجهی از (9 کیلوژول در مول (2 کیلو کالری در مول) (برای NH) تا حدود 30 کیلوژول بر مول (7 کیلو کالری) هستند و همانطور که ممکن است انتظار داشته باشید، با افزایش الکترونگاتیوی گروه متصل به هیدروژن، استحکام پیوند افزایش می یابد.
بنابراین، به یک معنا، HO و NH “چسبنده” هستند – مولکول های حاوی این گروه های عاملی بر اساس وزن مولکولی خود، نقاط جوش بالاتری نسبت به آنچه انتظار دارید، دارند.
3. فعل و انفعالات دوقطبی-دوقطبی وان دروالس
گروه های دیگر در کنار هیدروژن می توانند در پیوند کووالانسی قطبی با اتم های به شدت الکترونگاتیو دخیل باشند. به عنوان مثال، هر یک از این مولکول ها دارای یک دوقطبی است:
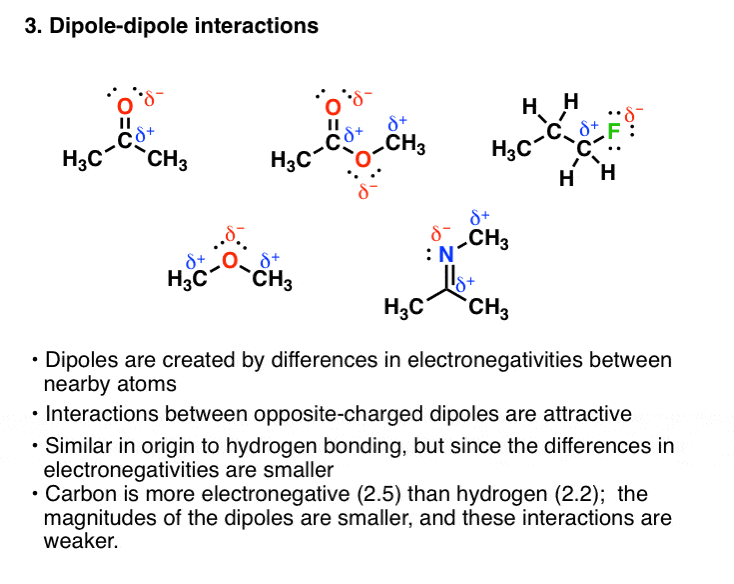
این دوقطبی ها می توانند به شیوه ای جذاب با یکدیگر تعامل داشته باشند که باعث افزایش نقطه جوش نیز می شود. با این حال، از آنجایی که اختلاف الکترونگاتیوی بین کربن (الکترونگیتی = 2.5) و اتم الکترونگاتیوی (مانند اکسیژن یا نیتروژن) به اندازه هیدروژن نیست (الکترونگیتی = 2.2)، برهمکنش قطبی آنقدر قوی نیست. بنابراین به طور متوسط این نیروها نسبت به پیوند هیدروژنی ضعیف تر هستند.
4. نیروهای پراکنده واندروالس (“نیروهای لندن”)
ضعیف ترین نیروهای بین مولکولی، نیروهای پراکندگی یا نیروهای لندن نامیده می شوند. اینها نشان دهنده جاذبه بین دوقطبی های آنی در یک مولکول در مورد اتمی مانند آرگون فکر کنید. این یک گاز بی اثر است، درست است؟ اما اگر آن را تا 186- درجه سانتیگراد خنک کنید، در واقع می توانید آن را به آرگون مایع متراکم کنید. این که یک مایع تشکیل می دهد به این معنی است چیزی آن را با هم نگه می دارد آن “چیزی” نیروهای پراکندگی است. به الکترون های لایه ظرفیت فکر کنید. به طور متوسط، آنها به طور مساوی پراکنده شده اند. اما در هر لحظه، ممکن است بین تعداد الکترون ها در یک طرف و تعداد الکترون ها در طرف دیگر عدم تطابق وجود داشته باشد که می تواند منجر به فوری تفاوت در مسئولیت

کمی شبیه بسکتبال است. به طور متوسط، برای توزیع یکنواخت بازیکنان، هر بازیکن یک به یک پوشش داده می شود. اما در هر لحظه، ممکن است یک موقعیت دو تیمی داشته باشید که در آن توزیع بازیکنان به صورت ناهموار است (این همچنین به این معنی است که کسی باز است). در پوسته ظرفیت، این “برآمدگی” دوقطبی ایجاد می کند و این دوقطبی ها هستند که مسئول جذب بین مولکولی هستند.
این قطبی پذیری اصطلاحی است که ما برای توصیف اینکه چگونه اتم ها می توانند این دوقطبی های آنی را به آسانی تشکیل دهند استفاده می کنیم. قطبش پذیری با اندازه اتمی افزایش می یابد. به همین دلیل است که نقطه جوش آرگون (186- درجه سانتیگراد) بسیار بالاتر از نقطه جوش هلیوم (-272 درجه سانتیگراد) است. با همین قیاس، نقطه جوش ید، (II، 184 درجه سانتیگراد) بسیار بالاتر از نقطه جوش فلوئور (FF، -188 درجه سانتیگراد) است.
برای هیدروکربن ها و سایر مولکول های غیر قطبی که فاقد دوقطبی قوی هستند، این نیروهای پراکندگی در واقع تنها نیروهای جذاب بین مولکول ها هستند. از آنجایی که دوقطبی ها ضعیف و گذرا هستند، به تماس بین مولکول ها بستگی دارند – به این معنی که نیروها با مساحت سطح افزایش می یابد. یک مولکول کوچک مانند متان دارای نیروهای بین مولکولی بسیار ضعیف است و نقطه جوش پایینی دارد. با این حال، با افزایش وزن مولکولی، نقطه جوش نیز بالا می رود. به این دلیل که سطحی که این نیروها می توانند روی آن عمل کنند افزایش یافته است. بنابراین، دنیروهای پرش با افزایش وزن مولکولی افزایش می یابد. به طور جداگانه، هر تعامل ارزش زیادی ندارد، اما اگر در مجموع، این نیروها می توانند بسیار مهم باشند. چگونه یک مارمولک مارمولک می تواند روی دیوار راه برود؟ به پاهایش نگاه کن

[Determining trends for hydrocarbons can get a little bit tricky depending on the exact structure – symmetry also plays a role in boiling points and melting points. I talked about this in detail previously.]
5. خط پایین
- نقطه جوش معیاری از نیروهای بین مولکولی است.
- با افزایش پلاریزاسیون پیوندها، نیروهای بین مولکولی افزایش می یابد.
- قدرت نیروهای بین مولکولی (و در نتیجه تاثیر بر نقاط جوش) یونی > پیوند هیدروژنی > دوقطبی دوقطبی > پراکندگی است.
- نقطه جوش با وزن مولکولی و با مساحت سطح افزایش می یابد.
برای بحث دیگری در مورد این اصول به Chemguide مراجعه کنید
یادآوری – راهنمای مطالعه رایگان نقطه جوش را فراموش نکنید (حاوی تمام نکات کلیدی مورد بحث در این پست)
MOC_Boiling_Point_Handout (PDF)
