ممکن است از Gen chem (و بدون شک اولین هفته شما از o-chem) به یاد بیاورید که اوربیتال های کربن در دو طعم وجود دارند: s و p.
اوربیتال های s باید به عنوان اوربیتال های کروی شکل آشنا باشند. به عنوان مثال، الکترون های هیدروژن در یک مدار 1s قرار دارند.
اوربیتال های p شبیه به شکل هشت یا حلقه هستند. الکترونهای موجود در اوربیتالهای p نسبت به اوربیتالهای s کمی دورتر از هسته هستند، بنابراین انرژی آنها کمی بالاتر است. بنابراین اوربیتال های p تنها پس از پر شدن اوربیتال های s با الکترون پر می شوند.
هیبریداسیون مفهومی است که در اینجا به آن می پردازیم.
آنچه از تجزیه و تحلیل ساختار مولکولهایی مانند CH4 مشاهده میشود این است که این شکلها نمیتوانند از قرار گرفتن الکترونها در اوربیتالهای s یا p به تنهایی به وجود بیایند، بلکه در عوض نتیجهای از مخلوط شدن الکترونها در اوربیتالهای s و p برای تشکیل هستند. ترکیبی اوربیتال ها اگر تشبیهی به این کنید که چگونه میتوانیم با مخلوط کردن نسبتهای مختلف اسپریت و پپسی یک نوشیدنی غیرالکلی ترکیبی بسازیم، این اوربیتالهای جدید کاملاً s یا کاملاً p نیستند، بلکه ترکیبی از هر دو هستند. “طعم” هر پیوند به نسبت نسبی محتوای مداری s و p بستگی دارد:
sp3 = 25% کاراکتر s، 75% کاراکتر p
sp2 = 33% کاراکتر s، 66% کاراکتر p
sp = 50% کاراکتر s، 50% کاراکتر p.
این اوربیتال های ترکیبی هستند که پیوندهای سیگما (پیوند σ) را تشکیل می دهند. اوراق قرضه سیگما از مستقیم، از جلو، با سر، رو در رو همپوشانی اوربیتال ها این اوربیتال ها ترکیبی از اوربیتال های s و p خواهند بود.
[What’s happened to the missing p orbitals for sp2 and sp hybridized carbon? Well, these p orbitals aren’t involved in hybridization or in sigma bonding – instead, they maintain 100% p character, are available to form π bonds, which are created by the side-by-side overlap of orbitals. π bonding involves p orbitals exclusively.*]
از آنجایی که کربن می تواند در یکی از این سه حالت هیبریداسیون وجود داشته باشد، بنابراین می توانیم شش نوع پیوند سیگما کربن-کربن داشته باشیم:
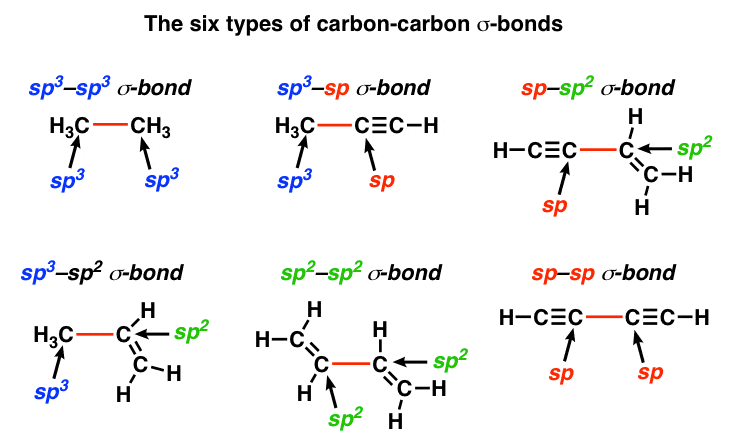
اکنون، به یاد بیاورید که برای هر عدد کوانتومی معین، اوربیتالهای s انرژی کمتری نسبت به اوربیتالهای p دارند. الکترونهای موجود در اوربیتالهای s نسبت به الکترونهای اوربیتالهای p نزدیکتر به هسته نگه داشته میشوند. به طول نسبی و نقاط قوت پیوند برای هر یک از این شش موقعیت نگاهی بیندازید.

اصل کلی: هر چه صفت پیوند بیشتر باشد، پیوند محکم تر خواهد بود.
[Note that this is also why the protons in acetylene are more acidic than those in ethene and ethane – the electrons in the conjugate base are more tightly held, making them more stable. If it seems contradictory that the bond is both stronger and yet more easily broken, remember that bond energies measure homolytic cleavage]
اکنون، تعداد پیوندهای π که می توانند تشکیل شوند به تعداد آنها بستگی دارد هیبرید نشده اوربیتال p موجود است – 1 برای کربن های هیبرید شده sp2، 2 برای کربن های هیبرید شده sp (دو پیوند π در حالت دوم با یکدیگر زاویه قائمه خواهند داشت).
بر خلاف اوربیتال های سیگما، تنها یک راه برای تشکیل پیوند CC π وجود دارد – از همپوشانی دو اوربیتال p.
سوال: نسبت به اوراق قرضه سیگما، به نظر شما پیوندهای pp (پیوندهای π) قویتر هستند یا ضعیفتر؟
1) درصد s شخصیت آنها چیست؟
2) انرژی لازم برای شکستن پیوند CC در اتان:
انرژی لازم برای شکستن پیوند C=C در اتن:
*متن سبز = نه تمام حقیقت! (اما به اندازه کافی برای دوره شما نزدیک است)
(پیشرفته) مراجع و مطالعه بیشتر
-
جداول طول پیوند تعیین شده توسط ایکس– پراش پرتو و نوترون قسمت 1. طول پیوند در ترکیبات آلی. آلن، FH; کنارد، او. واتسون، دی جی برامر، ال. Orpen، AG; تیلور، آر. جی. شیمی. Soc.، Perkin Trans. 2، 1987، S1-S19
DOI: 10.1039/P298700000S1
این مقاله یک مرجع مفید، طول پیوند ترکیبات آلی مختلف تعیین شده از دادههای پراش کریستال اشعه ایکس را جمعآوری میکند.
