واکنش E1 – سه شواهد کلیدی و یک مکانیسم
آخرین بار در این راهنما در مورد واکنش های حذف، در مورد دو نوع واکنش حذف صحبت کردیم. در این پست، یک نوع واکنش حذف را کمی عمیقتر بررسی میکنیم و بر اساس آنچه آزمایشها به ما میگویند، فرضیهای برای نحوه عملکرد آن ارائه میکنیم.
فهرست مطالب
- چگونه توضیح دهیم که در این واکنش حذفی چه اتفاقی می افتد (که آن را “E1” می نامیم)
- اولین سرنخ در مورد مکانیسم “حذف E1”: میزان فقط به غلظت بستر (نه پایه) بستگی دارد.
- دومین سرنخ در مورد مکانیسم واکنش حذف E1 – نرخ برای بسترهای سوم سریعترین است
- سومین سرنخ در مورد مکانیسم واکنش حذف E1: با واکنش SN1 رقابت می کند
- قرار دادن آن در کنار هم: مکانیسم E1 از طریق از دست دادن گروهی که ترک میکند، و سپس پروتونهسازی میشود.
- (پیشرفته) مراجع و مطالعه بیشتر
1. چگونه توضیح دهیم که در این واکنش حذف (که آن را “E1” می نامیم چه اتفاقی می افتد)
در اینجا واکنش است. ابتدا به پیوندهایی که در حال شکل گیری و شکسته شدن هستند نگاه کنید. این یک واکنش حذف کلاسیک است – ما در حال تشکیل یک پیوند جدید C-C(π) و شکستن یک پیوند C-H و C-گروه ترک (در اینجا Br) هستیم.
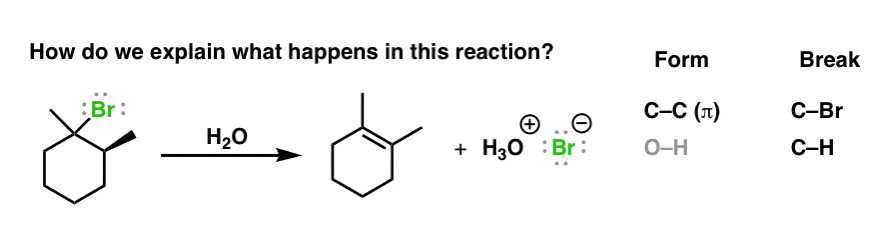
اما اکنون ما میخواهیم بیشتر از آنچه اتفاق میافتد بدانیم. ما می خواهیم بفهمیم چگونه اتفاق می افتد. ترتیب تشکیل باند و شکستن پیوند چیست؟ برای درک چگونگی وقوع آن، باید به آنچه داده ها به ما می گویند نگاه کنیم. به این دلیل که شیمی یک علم تجربی است. ما به شواهد نگاه می کنیم، و سپس به عقب کار می کنیم.
2. اولین سرنخ در مورد مکانیسم “حذف E1”: نرخ فقط به غلظت بستر (نه پایه) بستگی دارد.
بیایید به اولین سرنخ مهم برای این واکنش نگاه کنیم. ما می توانیم سرعت واکنش را به راحتی اندازه گیری کنیم. هنگامی که غلظت سوبسترا را تغییر می دهیم، سرعت واکنش متناسب با آن افزایش می یابد. به عبارت دیگر، یک وابستگی درجه اول نرخ به غلظت بستر وجود دارد.
با این حال، اگر غلظت پایه را تغییر دهیم (در اینجا، H2O) سرعت واکنش به هیچ وجه تغییر نمی کند.
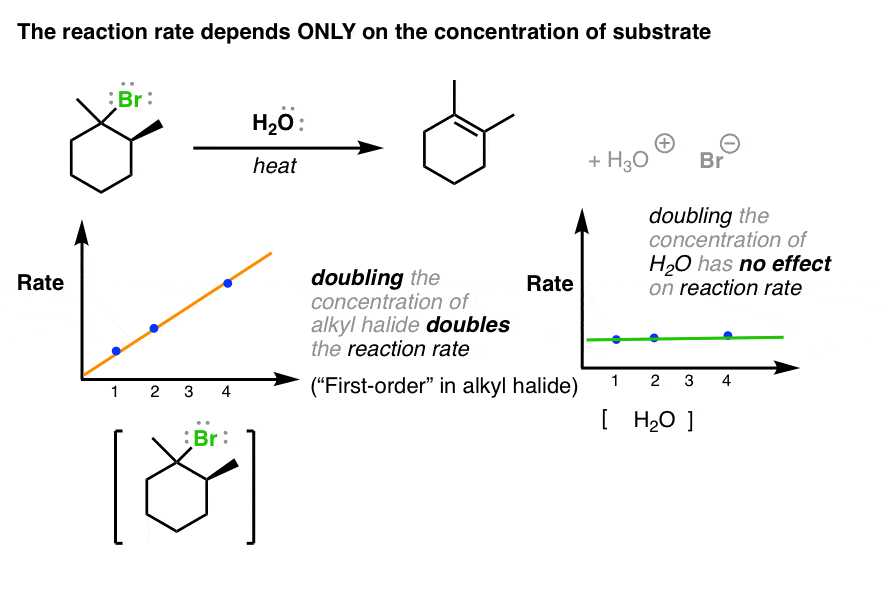
چه اطلاعاتی می توانیم از این نتیجه بگیریم؟ بنابراین مرحله تعیین کننده سرعت برای این واکنش (هر چه که باشد) انجام می شود نه پایه را درگیر کند. هر مکانیزمی که ترسیم کنیم باید این واقعیت را توضیح دهد.
3. دومین سرنخ در مورد مکانیسم واکنش حذف E1 – نرخ برای زیرلایه های سوم سریع ترین است
یکی دیگر از شواهد جالبی که میتوانیم از این واکنش به دست آوریم، تغییر دادن آن است نوع زیرلایه، و ثابت سرعت حاصل را اندازه گیری کنید. بنابراین اگر آلکیل هالید ساده را در سمت چپ (زیر) که کربن متصل به Br نیز به 3 کربن متصل است را در نظر بگیریم (به این می گویند درجه سوم آلکیل هالید)، سرعت بیشتر از آلکیل هالید میانی است (الف ثانوی آلکیل هالید) که خود سریعتر از a است اولیه آلکیل هالید (علاوه بر Br تنها به یک کربن متصل است).
بنابراین نرخ به ترتیب پیش می رود سوم (سریعترین) > ثانویه >> اولیه (کندترین)
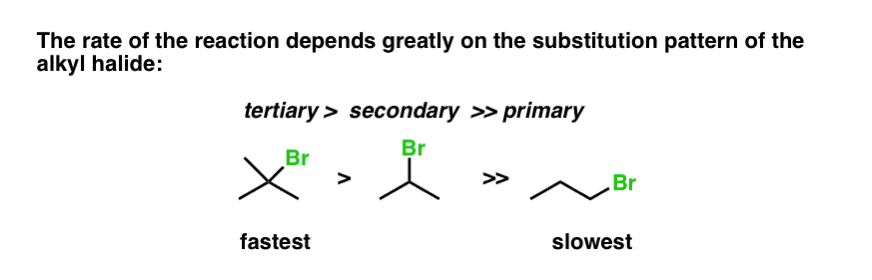
هر مکانیسمی که برای این واکنش ترسیم کنیم، باید این واقعیت را نیز مد نظر داشته باشد. چه چیزی می تواند اتفاق بیفتد که بسترهای سوم سریعتر از اولیه باشند؟
4. سومین سرنخ در مورد مکانیسم واکنش حذف E1: با واکنش SN1 رقابت می کند.
آخرین سرنخ جالب در مورد مکانیسم این واکنش مربوط به محصولات جانبی است که اغلب به دست می آیند. به عنوان مثال، هنگامی که آلکیل هالید زیر تحت این شرایط واکنش قرار می گیرد، محصول حذف مورد انتظار را به دست می آوریم. با این حال، ما همچنین واکنش های جایگزینی را در ترکیب محصول دریافت می کنیم. به یاد داشته باشید – واکنش های جایگزینی شامل شکستن C- (گروه ترک) و تشکیل C- (نوکلئوفیل) است. چیزی که این آلکیل هالید شروع خاص را به ویژه جالب می کند این است که کربن متصل به Br a است stereocenter و اگر در اینجا با یک انانتیومر منفرد از ماده اولیه شروع کنیم، توجه می کنیم که محصول جایگزینی تشکیل شده یک مخلوطی از استریو ایزومرها توجه داشته باشید که هر دو وارونگی و حفظ استریوشیمی در مرکز استریو رخ داده است.
ما قبلاً این الگو را دیدهایم – این یک S استن1 واکنش!
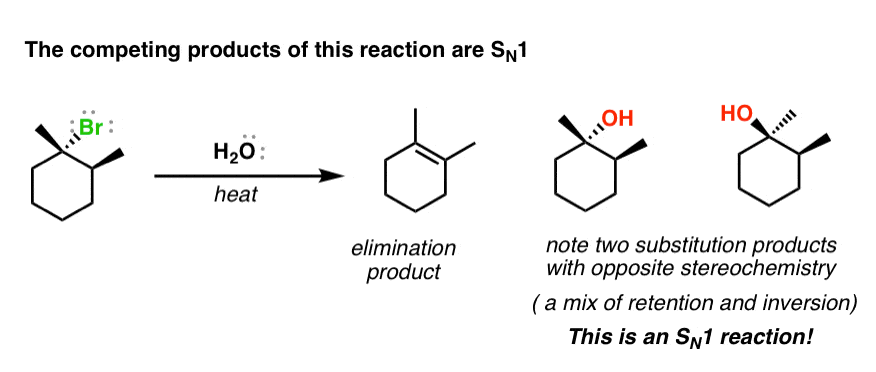
این قسمت آخر سرنخ بسیار مهمی است. اگر یک واکنش SN1 در مخلوط واکنش رخ می دهد، نگاه کردن به مکانیسم SN1 می تواند به ما کمک کند تا در مورد اینکه چه نوع مکانیسمی ممکن است در این مورد وجود داشته باشد تا محصول حذف را به ما بدهد، فکر کنیم.
5. قرار دادن آن در کنار هم: مکانیسم E1 از طریق از دست دادن یک گروه خارج شده و سپس deprotonation پیش می رود.
با در نظر گرفتن همه این سرنخ ها، بهترین راه برای توضیح آنچه اتفاق می افتد چیست؟ این:
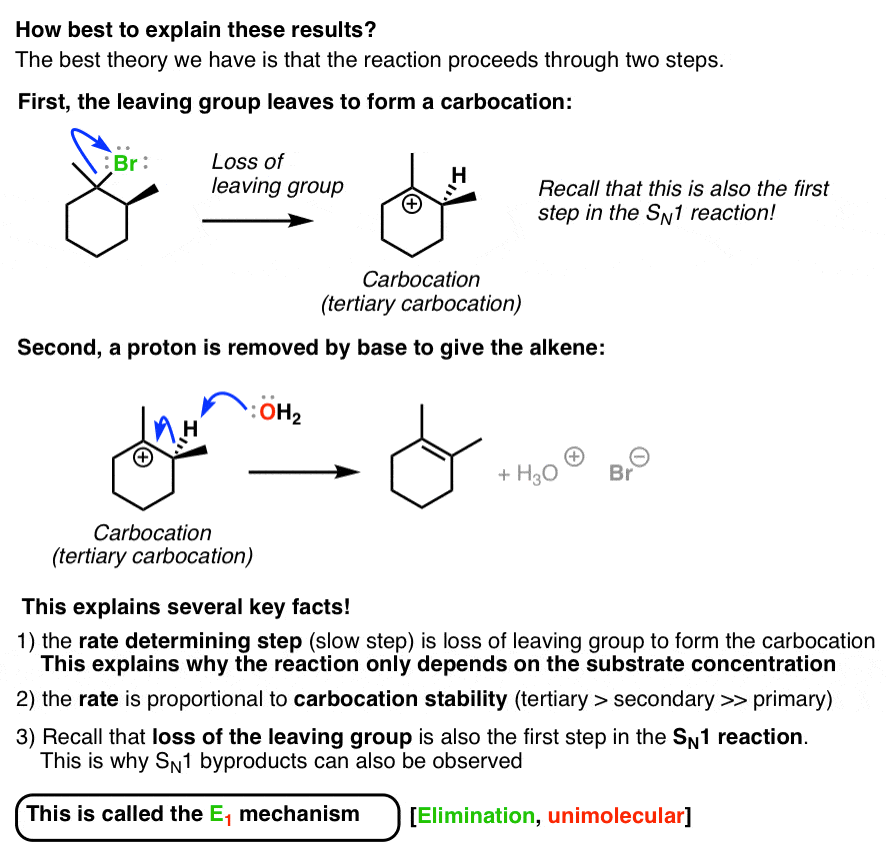
پیشنهاد شده است که واکنش در دو مرحله انجام شود: ابتدا گروه ترک را ترک می کند، تشکیل کربوکاتیون دومین، پایه یک پروتون را حذف می کند، آلکن را تشکیل می دهد. این به خوبی با سه سرنخ ذکر شده در بالا مطابقت دارد. [Also note that the more substituted alkene is formed here, following Zaitsev’s rule].
مشابه Sن1 مکانیسم، این به عنوان نامیده می شود مکانیزم E1 (حذف، تک مولکولی).
بنابراین در نوع دیگر واکنش حذف چه می گذرد؟ این موضوع برای پست بعدی است!
پست بعدی: مکانیسم E2
(پیشرفته) مراجع و مطالعه بیشتر
- مکانیسم های واکنش های حذفتوسط ساندرز و کوکریل، 1973، پ. 210.
در این کتاب آمده است:سه عامل اصلی وجود دارد که به مکانیسم E1 کمک می کند: بستری که کربوکاتیون نسبتاً پایدار می دهد، حلال یونیزه کننده، و عدم وجود بازها یا هسته دوست های قوی.“. - هیدرولیز آلکیل هالیدهای ثانویه و سوم
ادوارد دی. هیوز
مجله انجمن شیمی آمریکا 1935، 57 (4)، 708-709
DOI: 10.1021/ja01307a033
یک مقاله اولیه و احتمالاً اولین مقاله ای که اصطلاح “E1” را در خود دارد. این مقاله همچنین اشاره می کند که واکنش E1 با S رقابت می کندن1 واکنش برای چندین بستر. - حذف تک مولکولی و اهمیت رسانایی الکتریکی، راسمی شدن و جایگزینی هالوژن هالیدهای آلی در محلول.
هیوز، ای.، اینگولد، سی و اسکات، ای.
طبیعت 1936، 138، 120-121
DOI: 1038/138120b0
این مقاله آزمایشهای هدایت الکتریکی زیرلایههای سوم و ثانویه را در SO توصیف میکند2 با HCl در حمایت از مکانیسم E1. - جفت یون در حذف
کوسیورا و اس. وینستین
مجله انجمن شیمی آمریکا 1963، 85 (11)، 1702-1703
DOI: 10.1021/ja00894a046
در حلال های بسیار قطبی و تفکیک شونده (مانند الکل های آبی) کربوکاتیون نسبتا “آزاد” است و مقدار محصول آلکن مستقل از ماهیت گروه ترک است. در این مقاله، پروفسور وینستین نشان میدهد که در حلالهای قطبی کمتر، کربوکاتیون کمتر «آزاد» است و جفتهای یونی محکم تشکیل میشوند. در نتیجه نسبت حذف/جایگزینی می تواند به شدت به پایه بودن گروه ترک وابسته باشد. یافتههای کلیدی در اینجا این است که گروههای ترک پایه بیشتر (Cl-، Br-) منجر به محصولات E1 بیشتر از گروههای ترک پایه کمتر (I-, S(CH3)2) میشوند. علاوه بر این، نسبت محصولات E1 در حلالهای قطبی کمتر نسبت به حلالهای دارای تفکیک بیشتر بیشتر است. - مکانیسم واکنش های حذف بخش X. سینتیک حذف الفین از برومیدهای ایزوپروپیل، ثانیه-بوتیل، 2-n- آمیل و 3-n- آمیل در محیط های الکلی اسیدی و قلیایی
ML Dhar، ED Hughes، و CK Ingold
جی. شیمی. Soc. 1948، 2058-2065
DOI: 10.1039/JR9480002058
جدول III در این مقاله نشان می دهد که بسترهای ثانویه به طور کلی بسترهای ضعیفی برای واکنش های E1 هستند – بازده از 4.7٪ تا 17.4٪ متغیر است. - مکانیسم واکنش های حذف قسمت هشتم اثرات دما بر نرخ ها و نسبت های محصول در واکنش های جانشینی و حذف تک مولکولی و دو مولکولی آلکیل هالیدها و نمک های سولفونیم در حلال های هیدروکسیل
KA Cooper، ED Hughes، CK Ingold، و BJ MacNulty
جی. شیمی. Soc. 1948، 2049-2054
DOI: 10.1039/JR9480002049
اینگولد در مورد چگونگی تأثیر دما بر نسبت حذف/جایگزینی در اینجا میگوید:[..] برای هر جفت فرآیندهای دو مولکولی همزمان، حذف در هر یک از موارد بررسی شده دارای انرژی فعال سازی آرنیوس است که بالاتر از جایگزینی همراه با 1-2 کیلو کالری بر گرم مول است. بنابراین حذف همیشه ضریب دمایی بیشتری دارد، به طوری که افزایش دما نسبت های تشکیل الفین را افزایش می دهد..”
