واکنش های حذف توسط گرما مورد علاقه است
چند پست قبل دیدیم که چگونه واکنش های حذف اغلب در رقابت با واکنش های جایگزینی است.
چگونه بفهمیم که یک مسیر واکنش بر دیگری ترجیح داده می شود؟ همانطور که خواهیم دید، چندین مؤلفه برای پاسخگویی کامل به این سؤال وجود خواهد داشت، اما امروز در مورد یک قانون ساده در آینده صحبت خواهیم کرد.
فهرست مطالب
- با توجه به مساوی بودن، واکنشهای حذف بر واکنشهای جایگزینی با افزایش حرارت ترجیح داده میشوند.
- گرمایش منجر به افزایش تدریجی حذف در مقابل جایگزینی می شود
- واکنش های حذف منجر به افزایش تعداد گونه ها در محلول می شود. واکنش های جایگزینی انجام نمی شود
- افزایش تعداد گونه ها در محلول به معنای آنتروپی بیشتر است، به این معنی که عبارت –TΔS در معادله گیبس با افزایش دما (T) مقدار آن افزایش می یابد.
- (پیشرفته) مراجع و مطالعه بیشتر
1. با توجه به مساوی بودن، واکنشهای حذف بر واکنشهای جایگزینی با افزایش گرما ترجیح داده میشوند.
فرض کنید شما چنین واکنشی دارید. امکان تشکیل محصولات جایگزین یا حذف وجود دارد. [I’m keeping the identity of the base, substrate vague here since I don’t have a concrete experimental example to provide (although I’d greatly appreciate one)].
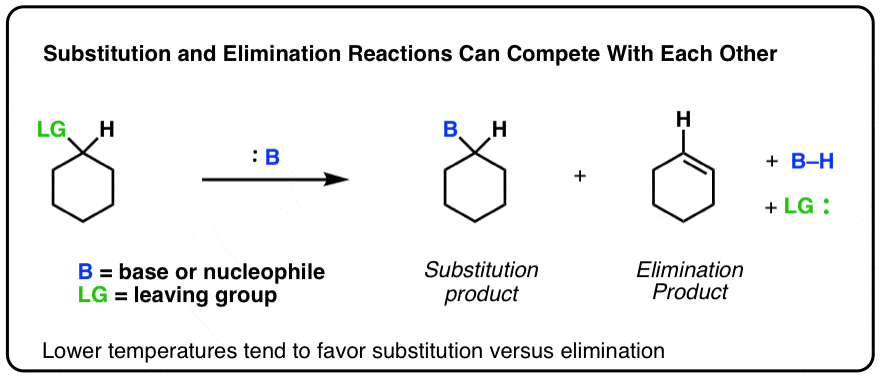
با افزایش دما، مقدار نسبی محصولات حذف نسبت به محصولات جایگزین افزایش می یابد. می توانید تصور کنید که شبیه این است.
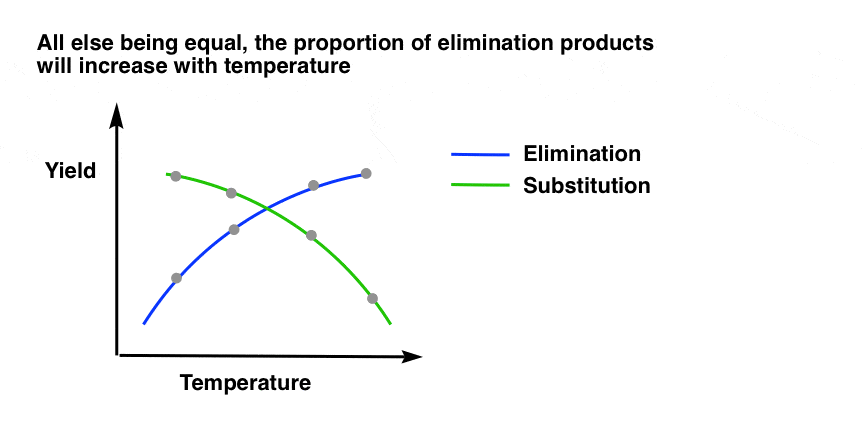
2. گرمایش منجر به افزایش تدریجی حذف در مقابل جایگزینی می شود
دوباره به نحوه عملکرد شیمی آلی توجه کنید. اینطور نیست که اعمال گرما یک کلید روشن/خاموش باشد که منجر به یک واکنش از 100% جایگزینی به 100% حذف شود. در عوض، افزایش دما منجر به a تدریجی افزایش محصولات حذفی نسبت به جایگزینی به این دلیل که دما به تدریج منجر به افزایش ثابت سرعت حذف در مقابل ثابت سرعت برای جایگزینی می شود.
پس اینجا چه خبر است؟
در اینجا یک چیز وجود دارد که می توانیم با اطمینان بگوییم: در دمای پایینانرژی فعال سازی برای واکنش جانشینی کمتر از واکنش حذف است. به یاد داشته باشید که هر چه انرژی فعال سازی کمتر باشد، سرعت واکنش بیشتر است. این ممکن است به توضیح توزیع محصول ما کمک کند: با افزایش دما، انرژی بیشتری در دسترس است، به طوری که مواد اولیه می توانند از سد فعال سازی بالا بروند تا واکنش های حذف را نیز ارائه دهند. این با آنچه مشاهده می شود مطابقت دارد.
با این حال، یک دلیل اساسیتر وجود دارد که چرا با افزایش گرما ممکن است محصولات حذف بیشتری را ببینیم، و این به برخی از خواصی است که ما در مورد ترمودینامیک میدانیم که ثابتهای سرعت (و انرژیهای فعالسازی) را به دما وابسته میکنند.
3. واکنش های حذف منجر به افزایش تعداد گونه ها در محلول می شود. واکنش های جایگزینی انجام نمی شود
بیایید دوباره به واکنش های (عمومی) نگاه کنیم:
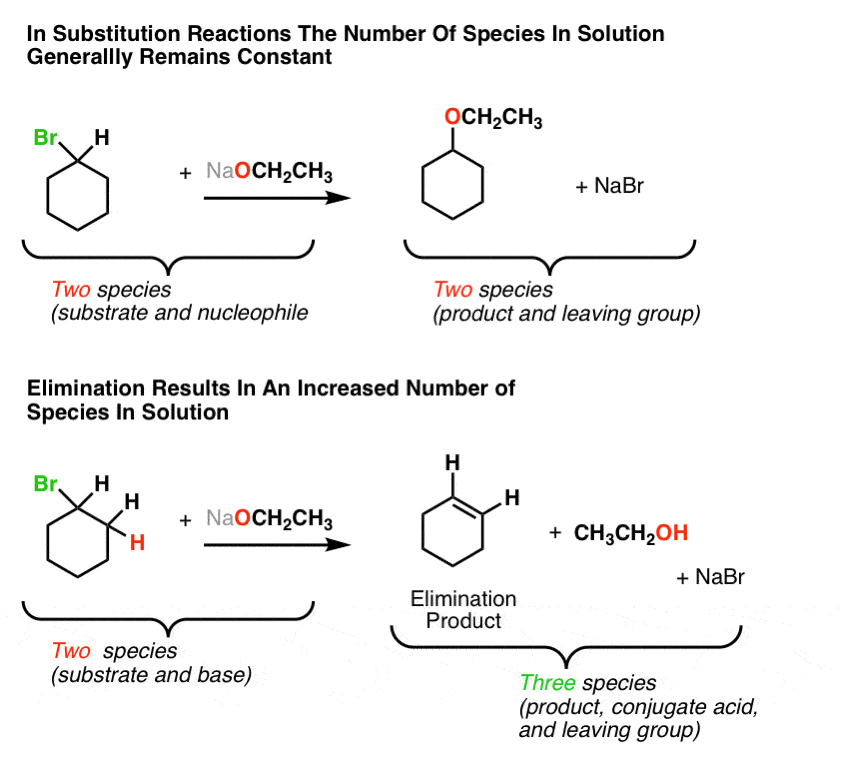
ما در اینجا متوجه چه چیزی می شویم؟ توجه داشته باشید که واکنش جایگزینی ما از 2 گونه در ماده اولیه به 2 گونه در محصول می رسیم. اما در واکنش حذف، ما از 2 گونه در ماده اولیه به 3 گونه در محصول می رسیم. افزایش!
4. افزایش تعداد گونه ها در محلول به معنای آنتروپی بیشتر است، به این معنی که عبارت –TΔS در معادله گیبس با افزایش دما (T) در مقدار آن افزایش می یابد.
از آنجایی که ما در اینجا یک گونه جدید را در محلول به دنیا می آوریم، این منجر به یک افزایش آنتروپی. و اگر به شیمی عمومی فکر می کنید، معادله گیبز این رابطه را به ما می گوید:
ΔG = ΔH – T ΔS
به یاد داشته باشید که هرچه ΔG منفی تر باشد، واکنش مطلوب تر است. با افزایش دما، این اصطلاح TΔS شروع به بزرگتر شدن و بزرگتر شدن میکند. این باعث می شود Δ G بیشتر و بیشتر منفی شود. در برخی موارد، با افزایش دما، ΔG برای حذف منفی تر از دلتا G برای جایگزینی می شود. به عبارت دیگر مطلوب تر.

هر چند باید مراقب یک چیز بود! هنگامی که ما در مورد ΔG بحث می کنیم، واقعا باید در مورد ΔG صحبت کنیم وضعیت گذار، نه محصول نهایی. [Why not? Because the stability of products isn’t related to reaction rate (if it was, our bodies would have combusted to CO2 and H2O a long time ago!)]. ما به شرایط ترمودینامیکی حالت گذار یک علامت ویژه می دهیم – یک خنجر کوچک روی آنها قرار می دهیم. مانند این: ΔG‡ . این “انرژی فعال سازی گیبس” نحوه تعریف انرژی فعال سازی یک واکنش است.
بنابراین با تجزیه و تحلیل این عبارت می توانید ببینید که انرژی فعال سازی می تواند با دما تغییر کند!
در دماهای پایین، انرژی فعال سازی گیبس برای جایگزینی (ΔG‡) از نظر انرژی کمتر (منفی تر) از انرژی حذف است. ولی در دمای بالا، انرژی فعال سازی گیبس (ΔG‡) برای حذف شروع می شود پایین تر در انرژی نسبت به واکنش های جایگزینی، و از این رو مقدار محصول حذف را افزایش می دهیم.
ΔG‡= ΔH‡–TΔS‡
از نو، نکته پایانی این است که، اگر همه چیز برابر باشد، گرما تمایل به واکنشهای حذف را دارد.
مطلب بعدی: دو نوع واکنش حذفی
(پیشرفته) مراجع و مطالعه بیشتر
- مکانیسم واکنش های حذف قسمت هفتم اثرات حلال بر نرخ ها و نسبت های محصول در واکنش های جانشینی و حذف تک و دو مولکولی آلکیل هالیدها و نمک های سولفونیم در حلال های هیدروکسیل
KA Cooper، ML Dhar، ED Hughes، CK Ingold، BJ MacNulty و LI Woolf
جی. شیمی. Soc. 1948، 2043-2049
DOI: 10.1039/JR9480002043 - مکانیسم واکنش های حذف قسمت هشتم اثرات دما بر نرخ ها و نسبت های محصول در واکنش های جانشینی و حذف تک مولکولی و دو مولکولی آلکیل هالیدها و نمک های سولفونیم در حلال های هیدروکسیل
KA Cooper، ED Hughes، CK Ingold، و BJ MacNulty
جی. شیمی. Soc. 1948، 2049-2054
DOI: 10.1039/JR9480002049
این مقاله کلیدی اینجاست. اینگولد می گوید:[..] برای هر جفت فرآیندهای دو مولکولی همزمان، حذف در هر یک از موارد بررسی شده دارای انرژی فعال سازی آرنیوس است که بالاتر از جایگزینی همراه با 1-2 کیلو کالری بر گرم مول است. بنابراین حذف همیشه ضریب دمایی بیشتری دارد، به طوری که افزایش دما نسبت های تشکیل الفین را افزایش می دهد.“ - مکانیسم واکنش های حذف بخش X. سینتیک حذف الفین از برومیدهای ایزوپروپیل، ثانیه-بوتیل، 2-n- آمیل و 3-n- آمیل در محیط های الکلی اسیدی و قلیایی
ML Dhar، ED Hughes، و CK Ingold
جی. شیمی. Soc. 1948، 2058-2065
DOI: 10.1039/JR9480002058
مثال خوبی از تأثیر گرما در حذف. جدول 1 در این مقاله نشان می دهد که حلولیز 2-بروموبوتان با 1 مولار NaOEt در اتانول 82 درصد بازده آلکن در دمای 25 درجه سانتیگراد می دهد، اما حلولیز مشابه در دمای 80 درجه سانتیگراد 91.4 درصد بازده آلکن را به دست می دهد.
