نحوه تعیین هزینه های جزئی
آخرین بار در مورد این صحبت کردیم که چگونه الکترون ها “پول” شیمی هستند و هر واکنشی تراکنش الکترون ها بین اتم ها است. این بدان معناست که اگر واقعاً میخواهیم واکنشی را بفهمیم، باید بفهمیم که الکترونها کجا هستند (و نیستند).
هنگام انجام این کار باید از دو عامل استفاده کرد. اولی این است الکترونگاتیوی. این چیزی است که پست امروز در مورد آن است: استفاده از الکترونگاتیوی برای تعیین چگالی الکترون. (دومین رزونانس BTW است – در پست های بعدی بیشتر در مورد آن)
من فرض می کنم شما می دانید که چگونه ساختارهای لوئیس را ترسیم کنید و مفاهیم الکترونگاتیوی و اتهام رسمیو همچنین قادر به تفسیر نقشه های خطی است، اما تمام. اگر در آن سطح نیستید، از آن مفاهیم نسخه پشتیبان تهیه کنید و بخوانید.
فهرست مطالب
- چگونه بفهمیم الکترون ها کجا هستند؟ ابتدا ساختار لوئیس را ترسیم کنید
- دوم، استفاده از الکترونگاتیوی برای تعیین بارهای جزئی
- شارژ رسمی با چگالی الکترون یکسان نیست
- خط پایین: برای تعیین چگالی الکترون از الکترونگاتیوهای نسبی استفاده کنید، نه بارهای رسمی
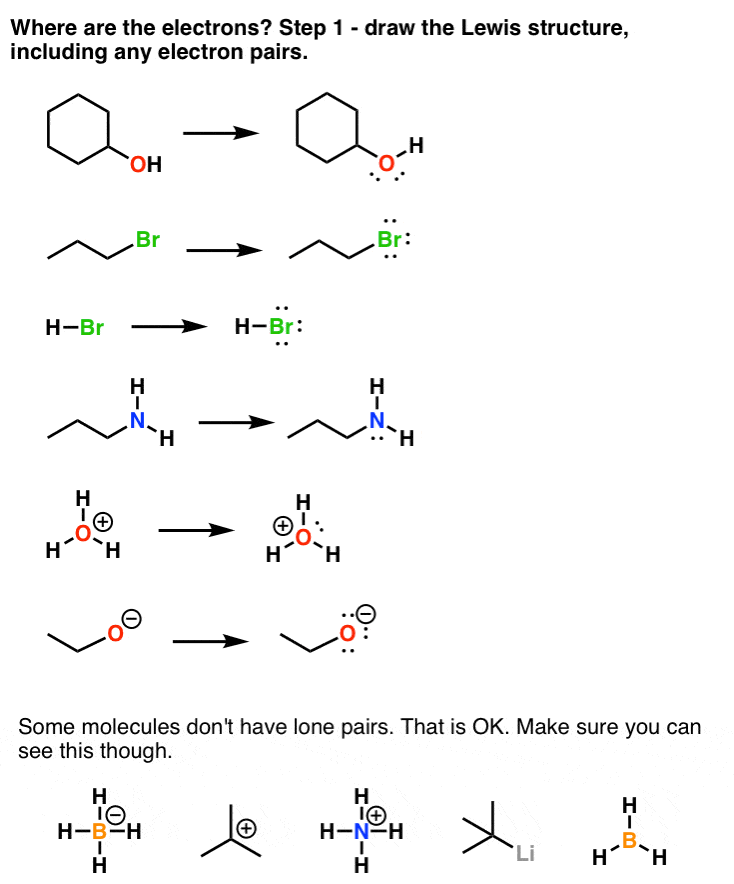
1. چگونه بفهمیم الکترون ها کجا هستند؟ ابتدا ساختار لوئیس را ترسیم کنید
خوب. بیایید با سوال اول شروع کنیم: چگونه بفهمیم الکترون ها در یک مولکول کجا هستند؟
اولین مهارت توانایی ترسیم ساختارهای لوئیس مناسب برای یک مولکول است. برای موفقیت در شیمی آلی باید کاملاً بتوانید این کار را در خواب انجام دهید. ساختار لوئیس باید تمام الکترونهای اطراف یک اتم را شامل شود، از جمله جفتهای تک الکترونهایی که اغلب پنهان هستند، در صورت امکان. بیایید نگاهی بیندازیم.
2. دوم، استفاده از الکترونگاتیوی برای تعیین بارهای جزئی
مهارت دوم در این است که بتوانید به کار بگیرید الکترونگاتیوی برای تعیین هزینه های جزئی در اوراق قرضه
ببینید، نقشههای ما از ساختارهای شیمیایی گاهی اوقات میتواند مانع از آنچه هست شود واقعاً با الکترون ها پیش می رود.
اگر فقط به خود نقاشی ها توجه کنیم، خطوطی که بین اتم ها ترسیم می کنیم – “پیوندهای کووالانسی” – جفت الکترونی هستند که به طور مساوی بین این دو تقسیم شده اند.
با این حال، تفاوت بین اشتراک ایدهآلشده الکترونها در پیوند کووالانسی در مقابل واقعیت چگالیهای الکترونی متفاوت، برای استفاده از یک قیاس، بی شباهت به تفاوت بین یک دولت کارگری سوسیالیستی اتوپیایی و روسیه شوروی نیست.
الکترونگاتیوی را به یاد دارید – به عبارت دیگر، رتبهبندی «طمع» یک اتم برای الکترون؟ در یک پیوند، عنصر الکترونگاتیو بیشتر سهم بیشتری از الکترون ها و بخشی جزئی خواهد داشت منفی بار برای انعکاس این چگالی الکترونی بیشتر. عنصر الکترونگاتیو کمتر یک جزئی خواهد داشت مثبت باری که فقدان چگالی الکترون را منعکس می کند.
بیایید به چند مولکول ساده نگاه کنیم و دوقطبی های پیوندهای آنها را با مقایسه الکترونگاتیوی نسبی تجزیه و تحلیل کنیم.
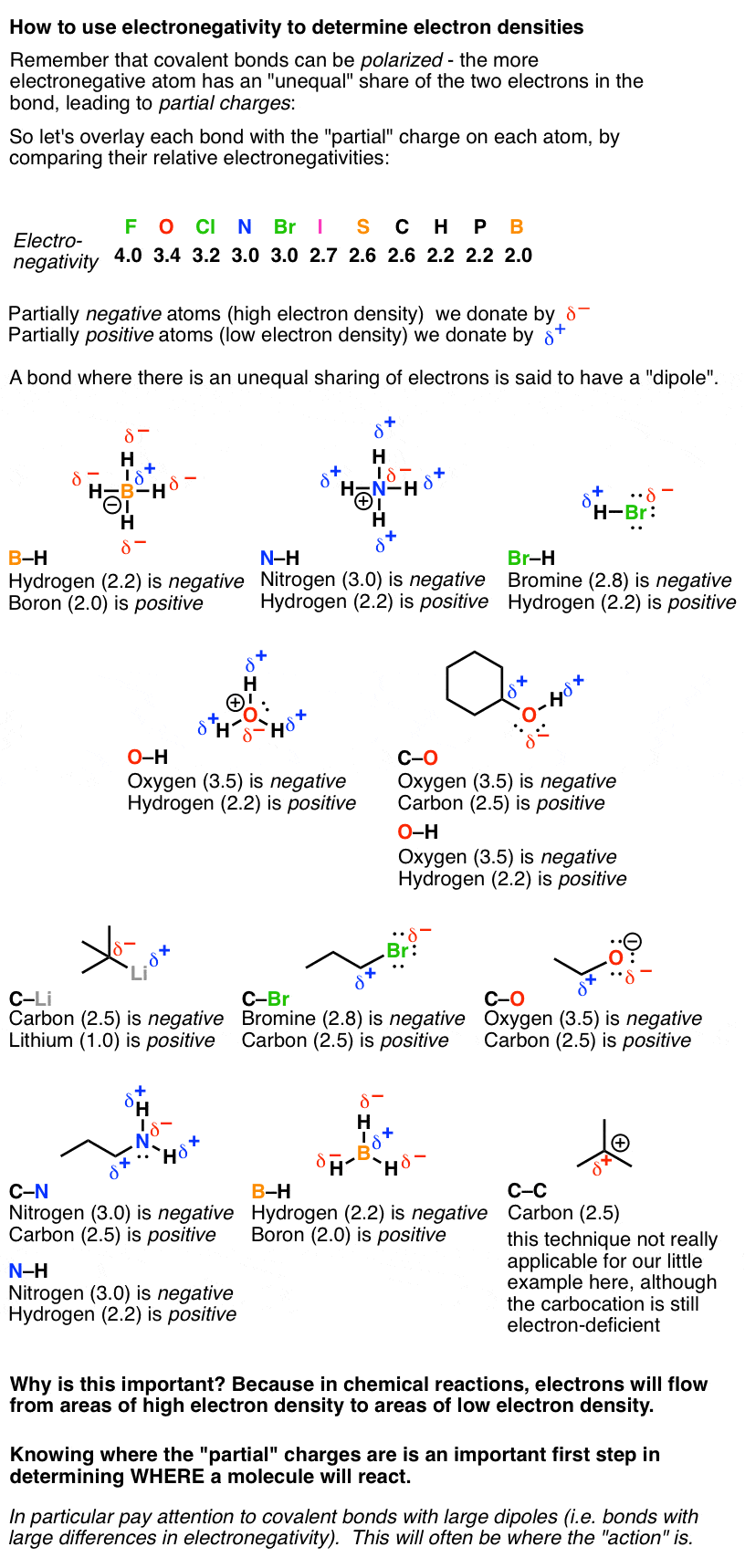
چرا گذر از همه اینها مهم است؟ زیرا در واکنشهای شیمیایی، الکترونها از نواحی با چگالی الکترون بالا به مناطق با چگالی الکترونی پایین سرازیر خواهند شد. دانستن محل بارهای جزئی اولین قدم مهم در تعیین محل واکنش مولکول است. پیوندهای کووالانسی با دوقطبیهای بزرگ (یعنی تفاوتهای بزرگ در الکترونگاتیوی) ارزش توجه به آنها را دارند: غالباً، «عمل» در اینجاست.
ممکن است بگویید “صبر کن”. من فکر میکردم چگالی الکترونها توسط بارهایشان منعکس میشوند، مانند H3O+، BF4–، و NH2– !» نه نه نه نه نه. این یکی از اولین توپ های منحنی واقعی است که در شیمی آلی به سمت شما پرتاب می شود و به طور مداوم به دانش آموزان تناسب می دهد.
3. شارژ رسمی مانند الکترون D نیستانسیت
“هزینه رسمی” ما را کمی معضل می کند. هنگامی که یک مولکول بار (اعم از مثبت یا منفی) را تحمل می کند، برای اهداف حسابداری، باید یک اتم را به عنوان “حمل کننده” آن بار مشخص کنیم. با این حال، درک این نکته مهم است که این “حفظ حساب” با چگالی الکترون، که منابع واقعی واکنش پذیری است، یکسان نیست. مطمئناً، نمونههای زیادی از مولکولها وجود دارد که بار در واقع نشان دهنده چگالی الکترون است. اما مجدداً، نمونه های متقابل زیادی نیز وجود دارد – مانند BH4(-)، NH4(+)، اچ3O (+) و دیگران.
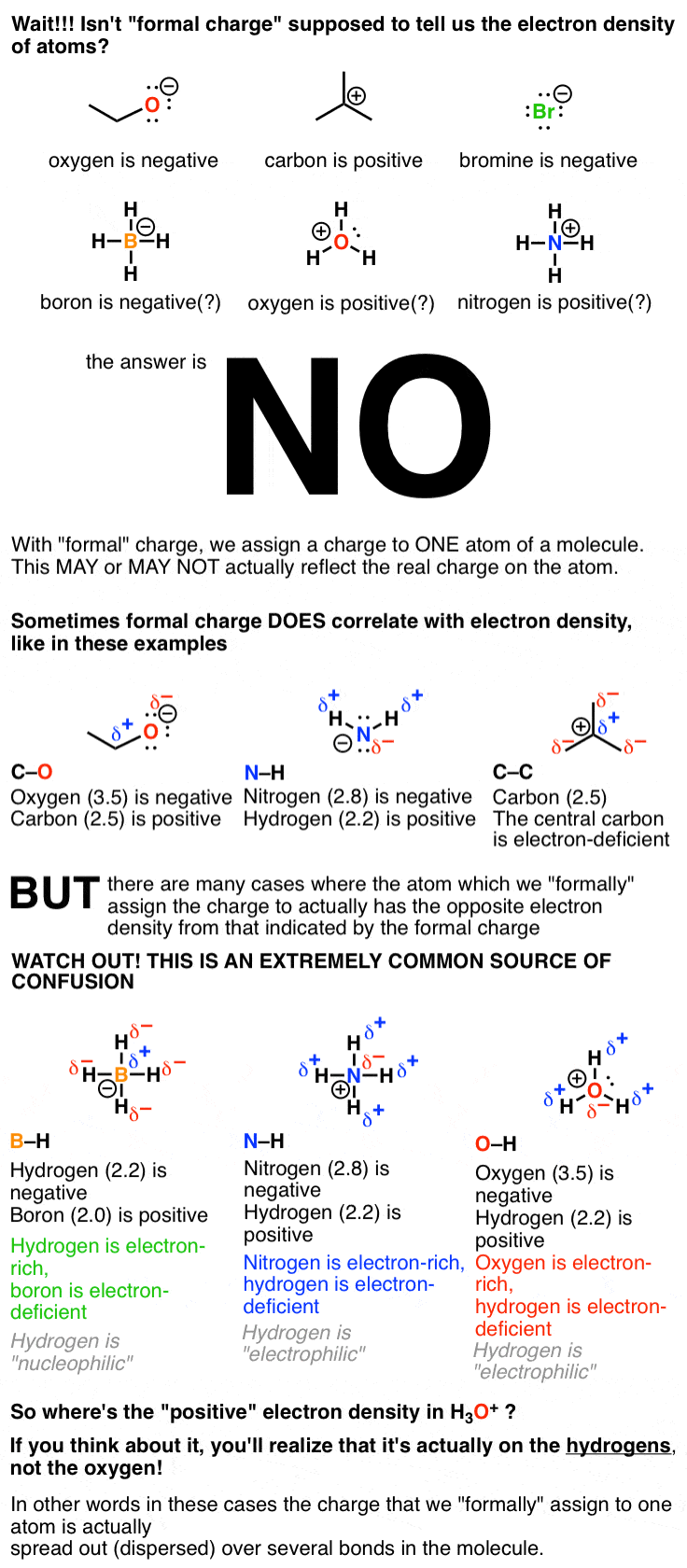
مطمئن شوید که این را درک کرده اید زیرا ممکن است در اولین بار به سختی بتوان ذهن خود را به این موضوع پی برد.
O در H3O+ ممکن است بار “رسمی” 1+ داشته باشد، اما در واقع غنی ترین اتم الکترون (یعنی دارای بار منفی) روی مولکول است!
بنابراین اگرچه مولکول H3O(+) دارای یک بار +1 است، که بار مثبت در واقع است نه روی خود اکسیژن، اما در اطراف مولکول، اما به ویژه در اطراف هیدروژن ها “گسترش” – پراکنده شده است. (برای دیدن نقشه انرژی پتانسیل H اینجا را کلیک کنید3O(+)). با این حال، برای «حفظ حساب»، به دلیل این فرض اساسی در نمودارهای پیوند مبنی بر اینکه الکترونها به طور مساوی بین اتمها تقسیم میشوند، بار 1+ را روی اکسیژن نسبت میدهیم.
4. خط آخر: برای تعیین چگالی الکترون از الکترونگاتیوهای نسبی استفاده کنید، نه بارهای رسمی
خط پایین: اگر اچ3O(+) با یک گونه غنی از الکترون واکنش می دهد، آن الکترون ها به سمت می روند هیدروژن ها (از آنجایی که الکترون ضعیفی دارند)، نه اکسیژن!!
اگر از بار رسمی برای تعیین چگالی الکترون استفاده کنید، به طور منظم پیچ میخورید.
بیایید به پایان برسانیم اعمال کردن این مفهوم نسبت به برخی از تعاملات بالقوه جذاب و دافعه بین مولکول ها است. اینها هستند نه به منظور به تصویر کشیدن واکنش های واقعی، اگرچه همانطور که بعدا خواهیم دید، واکنش ها با یک برهمکنش جذاب بین دو مولکول آغاز می شود. برعکس، جایی که ما دو ردیف می کنیم پسندیدن بارها (مثبت-مثبت و منفی-منفی) اینها مکان هایی هستند که دافعه در آنها رخ می دهد (و واکنش بین این اتم ها رخ نمی دهد).
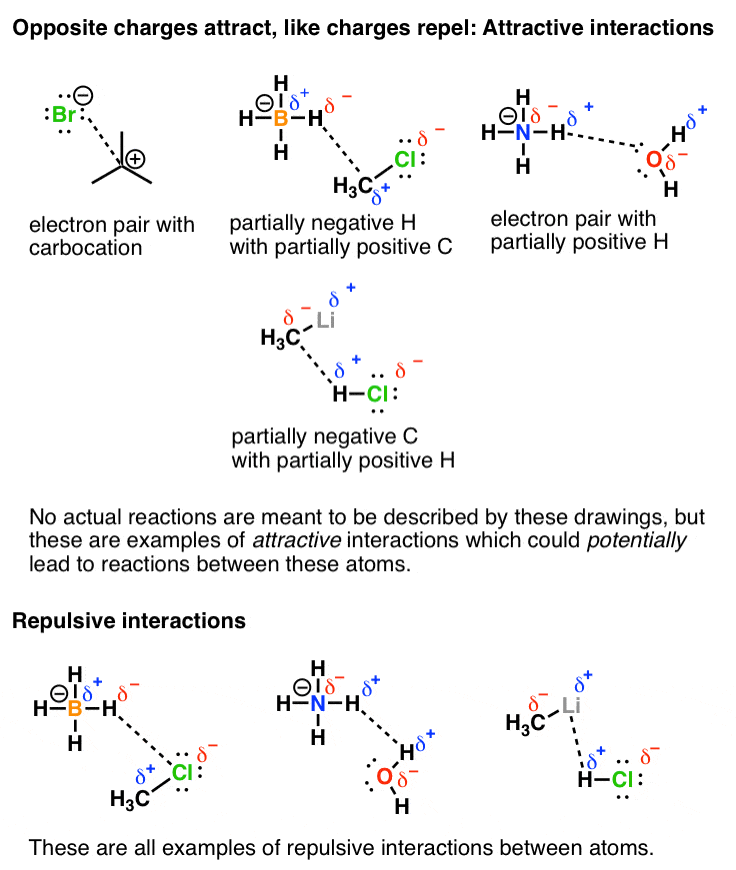
خط پایانی شماره 2: اگر الکترونگاتیوی ها و نحوه نسبت دادن بارهای جزئی را یاد بگیرید، همیشه می توانید بفهمید که نواحی غنی از الکترون و نواحی ضعیف الکترونی یک مولکول کجا هستند و ما می توانیم این را در مورد واکنش ها اعمال کنیم.
وقتی اوضاع کمی پیچیده تر می شود رزونانس ممکن است. اطلاعات بیشتر در مورد آن در پست بعدی
توجه داشته باشید که چگونه در قسمت آخر اسلاید سوم چند کلمه جدید – “الکتروفیل” و “هسته دوست” برای نشان دادن “فقیر از الکترون” و “غنی از الکترون” به ترتیب وارد کردم. خیلی بیشتر در مورد اینها بعدا.
در اینجا یک منبع آنلاین عالی درباره موضوع پتانسیل الکترواستاتیک در شیمی آلی از کالج رید وجود دارد.
پست بعدی: مقدمه ای بر رزونانس
