مکانیسم واکنش SN1
قبلاً دیدیم که دو دسته مهم از واکنشهای جایگزینی هسته دوست وجود دارد که در قوانین نرخ، وابستگی به الگوی جایگزینی و استریوشیمی محصولات متفاوت هستند. پس از گذر از مکانیسم SN2، امروز به عقب برمی گردیم و به دومین مکانیسم مهم برای واکنش های جایگزینی نگاه می کنیم. به آن می گویند مکانیسم SN1
بیایید ابتدا به آنچه داده ها به ما می گویند نگاه کنیم.
فهرست مطالب
- استریوشیمی واکنش SN1: ترکیبی از احتباس و وارونگی مشاهده شده است
- قانون نرخ واکنش SN1 به طور کلی مرتبه اول است
- نرخ واکنش با جایگزینی در کربن افزایش مییابد (ثالثیه >> ثانویه > اولیه)
- مکانیسم واکنش گام به گام واکنش SN1
- یادداشت
- (پیشرفته) مراجع و مطالعه بیشتر
1. استریوشیمی واکنش SN1: ترکیبی از احتباس و وارونگی مشاهده شده است
اگر با یک محصول خالص انانتیومر (یعنی یک انانتیومر) شروع کنیم، این واکنش ها منجر به مخلوطی از محصولات می شود که در آن استریوشیمی مشابه ماده اولیه (نگهداری) یا مخالف (وارونگی) است. به عبارت دیگر، درجاتی از نژاد پروری اتفاق خواهد افتاد.
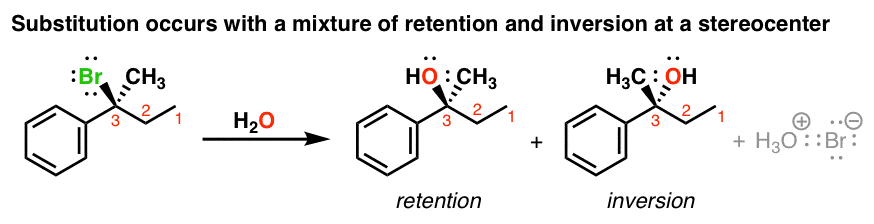
این را با S مقایسه کنیدن2 که همیشه باعث وارونگی استریوشیمی می شود! واضح است که چیز متفاوتی باید در اینجا اتفاق بیفتد.
2. قانون نرخ واکنش SN1 به طور کلی مرتبه اول است
ما همچنین می توانیم قانون سرعت این واکنش ها را اندازه گیری کنیم. وقتی این کار را انجام می دهیم، متوجه می شویم که نرخ است فقط بستگی به غلظت بستر دارد، اما نه بر غلظت نوکلئوفیل
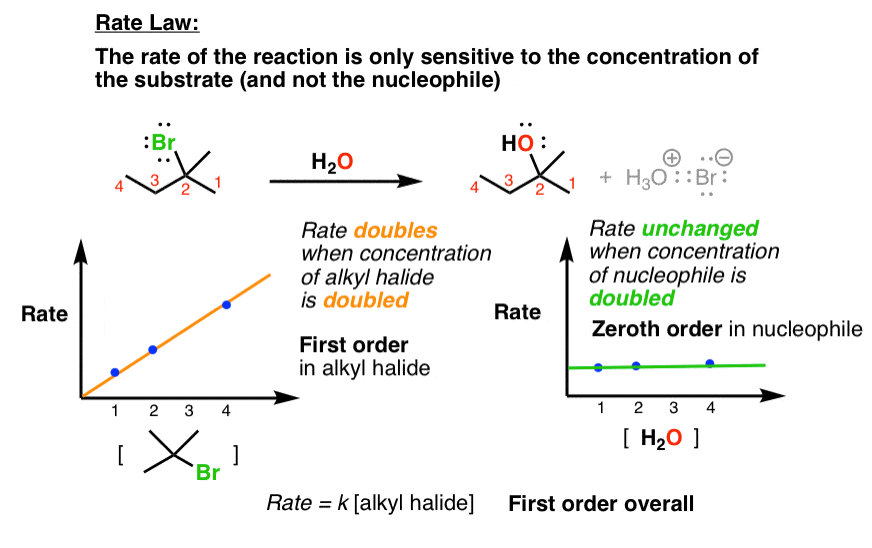
عجیب و غریب. به یاد داشته باشید که Sن2 به هر دو بستگی دارد. چرا ممکن است این واکنش فقط به غلظت سوبسترا بستگی داشته باشد؟
3. نرخ واکنش با جایگزینی در کربن افزایش می یابد
هنگامی که ما به طور ماهرانه انواع سوبستراها (مانند آلکیل هالیدها) را که در این واکنش ها استفاده می کنیم تغییر می دهیم، متوجه می شویم که بسترهای سوم (برای مثال، تی-بوتیل بروماید) به میزان قابل توجهی هستند سریعتر نسبت به آلکیل برومیدهای ثانویه، که به نوبه خود سریعتر از اولیه هستند.
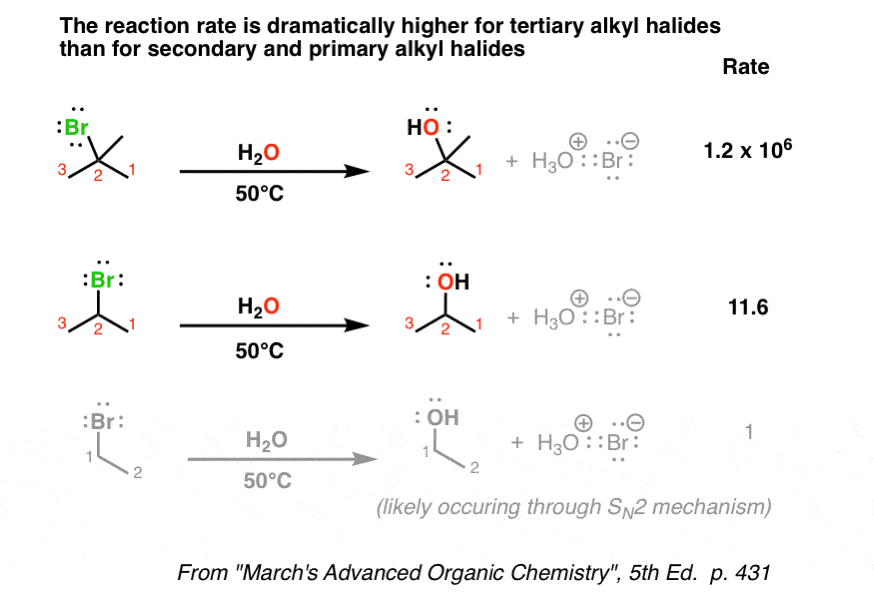
آن را با مورد S مقایسه کنیدن2، جایی که اولیه سریعتر از ثانویه بود و درجه سوم به سختی واکنش نشان داد. اسرار امیز!
4. مکانیسم واکنش گام به گام واکنش SN1
بهترین فرضیه ای که برای این واکنش داریم این است مکانیسم گام به گام. در مرحله اول گروه خروجی با تشکیل یک کربوکاتیون خارج می شوند. در مرحله دوم، یک نوکلئوفیل به کربوکاتیون حمله می کند و محصول را تشکیل می دهد.
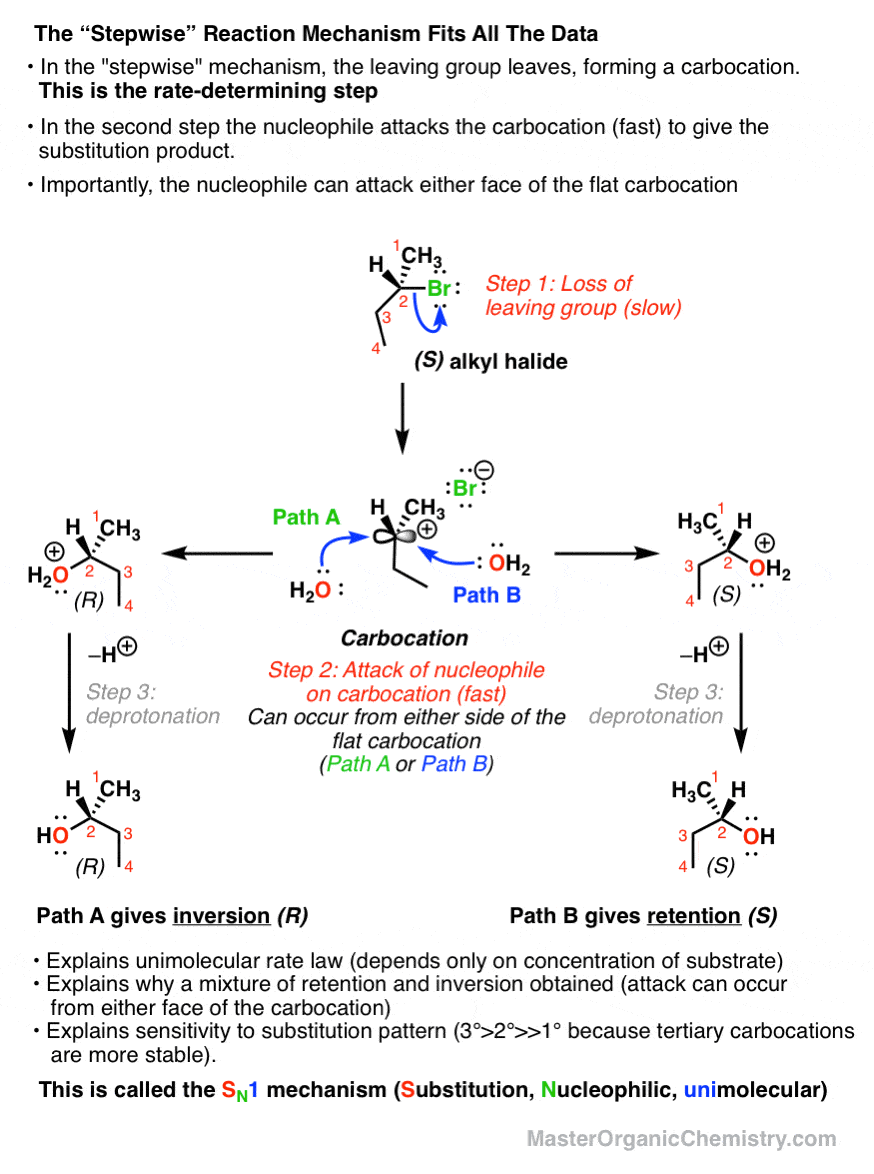
این همه مشاهدات ما را به خوبی توضیح می دهد. اول از همه، گام آهسته باید تشکیل کربوکاتیون (ناپایدار) باشد – که فقط به بستر بستگی دارد، نه هسته دوست. علاوه بر این، از آنجایی که پایداری کربوکاتیونها به شدت به الگوی جایگزینی بستگی دارد (کربوکاتیونهای سوم پایدارتر از ثانویه هستند، که پایدارتر از اولیه هستند)، این نیز به راحتی وابستگی سرعت واکنش به الگوی جایگزینی را توضیح میدهد. هر عاملی که کربوکاتیون را تثبیت کند، سرعت خروج گروه ترک را افزایش می دهد.
همچنین به ما در درک استریوشیمی کمک می کند. از آنجایی که هسته دوست مسطح است، حمله ممکن است از هر دو صورت رخ دهد. به این معنی که ما مخلوطی از محصولات ماندگاری و وارونگی را بدست می آوریم.
بنابراین به این می گویند اسن1 مکانیسم – جایگزینی، هسته دوست، تک مولکولی – در تضاد با Sن2 (جایگزینی، هسته دوست، دو مولکولی).
به نظر می رسد که اگر یک گروه خوب (مانند یک هالوژن) در اختیار داشته باشید، همه چیز جواب می دهد. اما اگر یک گروه خروجی خوب نداشته باشید چه؟ در پست بعدی در مورد چگونگی تبدیل یک گروه ضعیف به یک گروه خوب صحبت خواهیم کرد.
پست بعدی: اسید مزدوج گروه ترک بهتری است
یادداشت
*توجه – آلکیل هالید اولیه نشان داده شده در اینجا مطمئناً فقط از طریق یک S واکنش می دهدن2 مکانیسم.
نکته پایانی – اگرچه اغلب گفته می شود که Sن1 با “راسمی شدن” استریوسترها پیش می رود، در عمل ممکن است به دلیل اثرات “جفت شدن یون”، تقسیم 50/50 از استریوسنتز به دست نیاید. به عبارت دیگر، گروه ترک می تواند ترک کند، اما به طور کامل از مجاورت کربوکاتیون جدا نمی شود، که می تواند مانع از حمله یک هسته دوست به الکتروفیل از آن صورت شود. به همین دلیل، کمی صحیح تر است که بگوییم این کار با “آمیخته ای از حفظ و وارونگی” به جای “راسمی شدن” پیش می رود.
(پیشرفته) مراجع و مطالعه بیشتر
-
56. مکانیسم جایگزینی در اتم کربن اشباع. بخش V. هیدرولیز از ترت– بوتیل کلرید
ادوارد دی. هیوز.
جی. شیمی. Soc. 1935، 235
DOI: 10.1039/JR9350000255
مطالعه اصلی که در آن هیدرولیز از تی– بوتیل کلرید در آلکیل هالید مرتبه اول و در باز مرتبه صفر است که مکانیسمی را که اکنون به نام SN1 می شناسیم ایجاد می کند. - مکانیسم جایگزینی در یک اتم کربن اشباع. بخش نهم نقش حلال در هیدرولیز مرتبه اول آلکیل هالیدها
Leslie C. Bateman و Edward D. Hughes
جی. شیمی. Soc. 1937، 1187-1192
DOI: 10.1039/JR9370001187
در هیدرولیز آلکیل برومیدها توسط آب در اسید فرمیک، نرخ های نسبی در 100 درجه عبارتند از MeBr 1.00، EtBr 1.71، iPrBr 44.7 و tBuBr ca. 10^8. - سینتیک واکنش و وارونگی والدن بخش اول. هیدرولیز و الکلیز همگن β-n-اکتیل هالیدها
ادوارد دی. هیوز، کریستوفر کی. اینگولد و استادمن استندیش
جی. شیمی. Soc. 1937، 1196-1201
DOI: 10.1039/JR9370001196 - سینتیک واکنش و وارونگی والدن قسمت چهارم اثر نمک های نقره در حلال های هیدروکسیل بر روی β-n-اکتیل بروماید و آلفا فنیل اتیل کلرید
ادوارد دی. هیوز، کریستوفر کی. اینگولد و استادمن استندیش
جی. شیمی. اجتماعی، 1937، 1236-1243
DOI: 10.1039/JR9370001236
این دو مقاله واکنش های 2-اکتیل هالیدها را بررسی می کنند تا ببینند آیا S خالص است یا خیرن1 یا Sن2 مسیر روی یک بستر را می توان به سادگی با تغییر شرایط واکنش مورد علاقه قرار داد. - همبستگی نرخ حلولیز
ارنست گرونوالد و اس. وینستین
مجله انجمن شیمی آمریکا 1948، 70 (2)، 846-854
DOI: 1021/ja01182a117
این مقاله بسیار مهمی است که برای اولین بار «معادله گرونوالد-وینستین» را مورد بحث قرار می دهد. این معادله بسط معادله همت است که اثرات حلال (یعنی قدرت یونیزاسیون) را در نظر می گیرد. - واکنش پذیری ترکیبات سر پل آدامانتان
پل فون آر. شلایر و رابرت دی. نیکلاس
مجله انجمن شیمی آمریکا 1961، 83 (12)، 2700-2707
DOI: 1021/ja01473a024
کربوکاتیونهای سر پل عموماً کاملاً ناپایدار هستند زیرا نمیتوانند هندسه مسطح لازم برای تثبیت فوقکنجوگیتی خوب را به دست آورند. با کمال تعجب، در این مقاله مشخص شد که واکنش SN1 1-bromoadamantane تنها حدود 1000 برابر کندتر از t-butyl bromide است، البته (البته) فقط با حفظ پیکربندی. - مبنای مشترک بازآرایی های درون مولکولی. VI.1 واکنش های نئوپنتیل یدید
فرانک سی. ویتمور، ال ویتل، و ای اچ پاپکین
مجله انجمن شیمی آمریکا 1939، 61 (6)، 1586-1590
DOI: 1021/ja01875a073
مقاله اولیه نشان می دهد که Sنواکنش های 1 را می توان با واکنش یک آلکیل هالید با نمک های نقره القا کرد. در این مورد، کاتیون نئوپنتیل به سرعت به حالت قابل توجهی پایدارتر می شود تیکاتیون آمیل و آن محصولات به دست می آیند. - مکانیسم جایگزینی در یک اتم کربن اشباع. قسمت بیست و نهم. نقش مانع فضایی (بخش D) مکانیسم واکنش نئوپنتیل بروماید با اتیل الکل آبی
I. داستروفسکی و ED هیوز
جی. شیمی. اجتماعی، 1946، 166-169
DOI: 10.1039/JR9460000166
این نمونه ای از S استن1 واکنش با بازآرایی نئوپنتیل بروماید در اتیل الکل آبی می دهد تیآمیل الکل (و تیآمیل اتیل اتر). - مکانیسم جایگزینی در یک اتم کربن اشباع. قسمت XXXV. اثر دما بر رقابت بین جایگزینهای حلکننده تک مولکولی و غیر حلکننده دی-پی-تولیل متیل کلرید. فعال سازی در مرحله سریع جایگزینی غیرحلولولیتیک تک مولکولی
Audrey R. Hawdon، ED Hughes و CK Ingold
جی. شیمی. اجتماعی، 1952، 2499-2503
DOI: 10.1039/JR9520002499
امکان اجرای Sن1 واکنش در حضور نوکلئوفیل اضافه شده، مانند هیدرولیز کلریدهای بنزیل در حضور آزید سدیم اضافه شده. بنابراین می توان نرخ جداگانه تشکیل کربوکاتیون و تولید آزید را اندازه گیری کرد. - متانولیز هیدروژن فعال نوری 2،4-دی متیل هگزیل-4-فتالات
فون ای. دورینگ و هارولد اچ. زایس
مجله انجمن شیمی آمریکا 1953، 75 (19)، 4733-4738
DOI: 10.1021/ja01115a035
نمونه اولیه Sن1 واکنش بدون نژاد سازی کامل پروفسور دورینگ مکانیزمی را در مقاله پیشنهاد می کند که خواندن آن جالب است. - استریوسنتزهای کواترنر از طریق یک S کاتالیزوری انانتیو همگران1 واکنش
Wendlandt، AE، Vangal، P. & Jacobsen، EN
طبیعت 556، 447-451 (2018)
DOI: 1038/s41586-018-0042-1
این یک نمونه نادر از S نامتقارن استن1 واکنش – معمولاً Sنواکنش 1 به عنوان دادن محصولات غیر کایرال آموزش داده می شود، اما در این مورد خاص می توان کایرالیته را القا کرد زیرا کربوکاتیون بسیار تثبیت شده است (ثالثیه، بنزیلیک و پروپارژیلیک).
