مکانیسم E2 – واکنش E2 (حذف، بیومولکولی) چگونه کار می کند
پس از گذراندن مکانیسم E1 برای واکنشهای حذف، یکی از راههایی را که در آن واکنشهای حذف میتوانند رخ دهند، توضیح دادهایم. با این حال، هنوز مجموعه دیگری از داده ها وجود دارد که برخی از واکنش های حذف را توصیف می کند که ما هنوز به اندازه کافی توضیح نداده ایم.
فهرست مطالب
- نمونه ای از واکنش “E2”: چگونه توضیح دهیم که در این واکنش چه اتفاقی می افتد؟
- سرنخ شماره 1 در مورد مکانیسم واکنش E2: میزان به غلظت هر دو بستر و پایه بستگی دارد
- سرنخ شماره 2 درباره مکانیسم واکنش E2: استریوشیمی پیوند C-H و گروه ترک همیشه “ضد” است
- قرار دادن آن در کنار هم: مکانیسم واکنش E2
- (پیشرفته) مراجع و مطالعه بیشتر
1. نمونه ای از واکنش “E2”: چگونه توضیح دهیم که در این واکنش چه اتفاقی می افتد؟
در اینجا نمونه ای از واکنشی است که من در مورد آن صحبت می کنم:
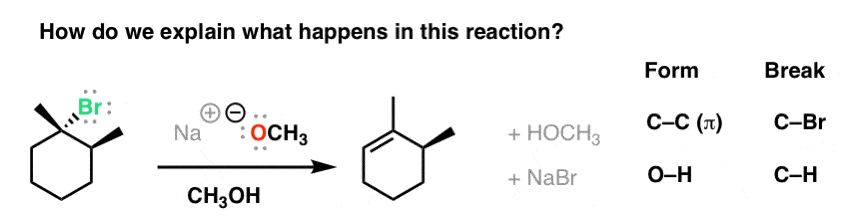
نکته جالب در مورد این واکنش این است که از همان قوانینی که برای واکنش E1 دیدیم پیروی نمی کند. ما در اینجا در مورد دو تفاوت کلیدی صحبت خواهیم کرد.
2. سرنخ شماره 1 در مورد مکانیسم واکنش E2: سرعت به غلظت هر دو بستر و پایه بستگی دارد
به یاد داشته باشید که واکنش E1 یک مرحله تعیین کننده سرعت “تک مولکولی” دارد (یعنی سرعت فقط بستگی به غلظت بستر دارد؟)
خوب، وقتی به قانون نرخ این واکنش نگاه می کنیم، متوجه می شویم که به دو عامل بستگی دارد. این بستگی به غلظت دارد هر دو لایه و پایه.
این بدان معناست که هر مکانیزمی که برای این واکنش پیشنهاد می کنیم باید این داده ها را توضیح دهد.
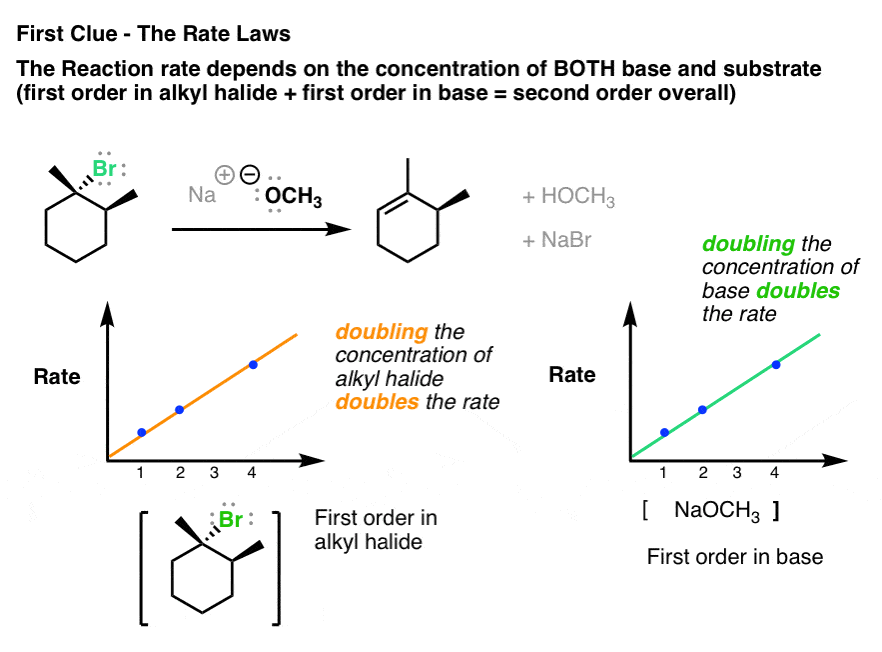
به هر حال، ببینید چگونه مفید سینتیک شیمیایی می تواند باشد؟ آنها آزمایشهای سادهای هستند – سرعت واکنش را در مقابل غلظت اندازهگیری میکنند – و شما این نمودارهای زیبا را از آن دریافت میکنید. من حتی نمیتوانم تاکید کنم که این دادهها چقدر میتوانند در درک مکانیسمهای واکنش مهم باشند. بسیار ساده، بسیار زیبا و بسیار مفید.
نکته دیگر – ممکن است متوجه شوید که پایه در اینجا (CH3O–) یک پایه قوی تر از آنچه برای واکنش E1 می بینیم است (در ادامه در مورد آن بیشتر خواهد شد).
3. سرنخ شماره 2 درباره مکانیسم واکنش E2: استریوشیمی پیوند C-H و گروه ترک “ضد” است
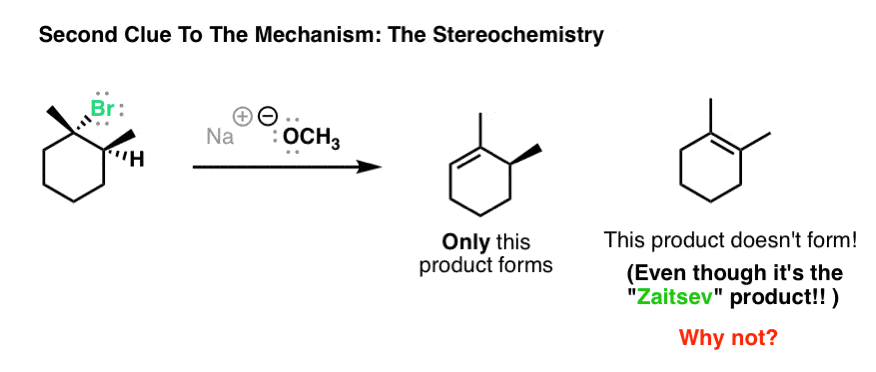
در اینجا دومین اطلاعات کلیدی است – و ما در مورد E1 صحبت نکردیم. واکنش زیر بسیار وابسته به استریوشیمی ماده اولیه است.
هنگامی که ما این آلکیل هالید را با پایه قوی، CH درمان می کنیم3اوا، به این نتیجه جالب توجه کنید. این چه چیز عجیبی است؟ خوب، به نظر می رسد که این در مواجهه با حکومت زایتسف است، درست است؟ چرا آلکن تترا جایگزین را در اینجا دریافت نمی کنیم؟
راز کمی عمیق تر می شود. اگر به جای شروع با آلکیل هالید بالا، آن را با دوتریوم “برچسب” کنیم – یعنی یکی از هیدروژن ها را با همزاد ایزوتوپ سنگین آن که اساساً خواص شیمیایی یکسانی دارد جایگزین کنیم – این الگوی جالب را می بینیم:
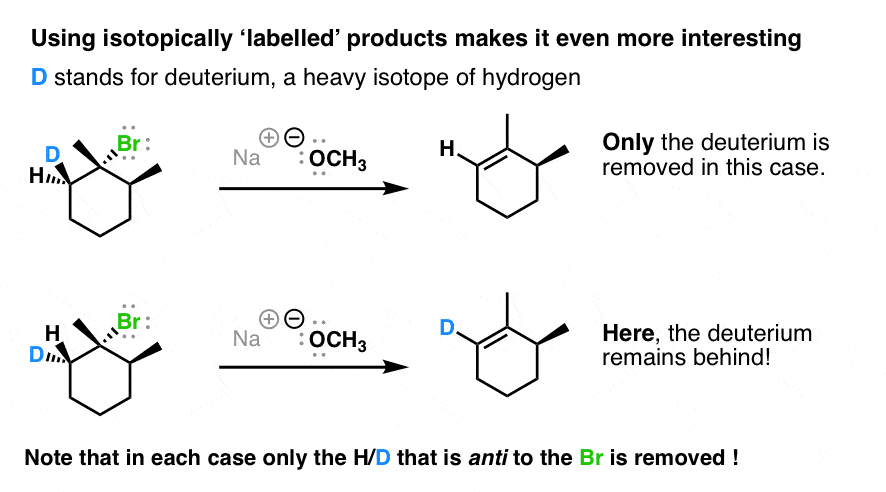
توجه داشته باشید که چگونه گروهی که در طرف مقابل حلقه سیکلوهگزان با گروه خروجی (Br) قرار دارد همیشه شکسته می شود.
در واقع، اگر از مولکول بالا استفاده کنیم و فقط یک اصلاح انجام دهیم، اکنون عملاً انجام می دهیم انجام دادن محصول Zaitsev را دریافت کنید!
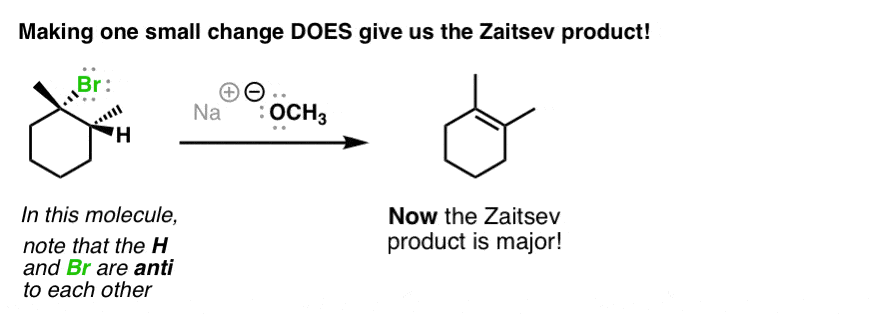
ببینید چه خبر است؟ هیدروژنی که شکسته می شود همیشه مخالف یا “ضد” گروه ترک است.
پس چگونه این دو عامل را توضیح دهیم؟
4. قرار دادن آن در کنار هم: مکانیسم واکنش E2
در اینجا یک فرضیه برای نحوه عملکرد این واکنش حذف وجود دارد. همه پیوندهایی که شکل میگیرند و میشکنند، و همچنین قانون نرخ، و – مهمتر – استریوشیمی را به حساب میآورد.
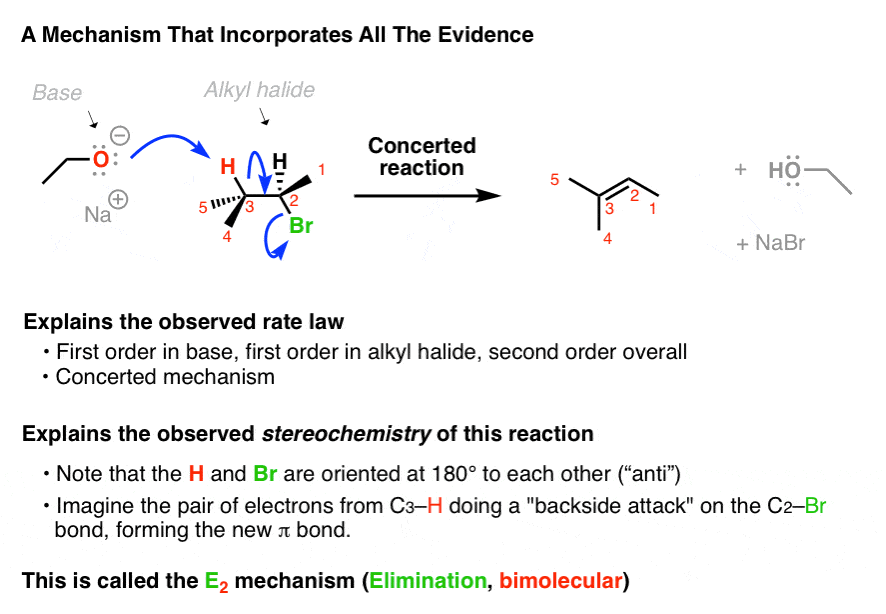
در این مکانیسم، باز، پروتون را از آلکیل هالید که جهت گیری شده است، خارج می کند ضد به گروه ترک، و گروه ترک میرود – همه در یک مرحله هماهنگ
از آنجایی که این یک واکنش حذفی است، و قانون نرخ “دو مولکولی” است، ما این مکانیسم را می نامیم E2.
در پست بعدی به طور مستقیم واکنش های E1 و E2 را با هم مقایسه خواهیم کرد.
پست بعدی: مقایسه واکنش های E1 و E2
(پیشرفته) مراجع و مطالعه بیشتر
- – ماهیت اثر متناوب در زنجیره های کربنی. قسمت هجدهم. مکانیسم متیلاسیون کامل و ارتباط آن با هیدرولیز غیرعادی
والتر هانهارت و کریستوفر کلک اینگولد
جی. شیمی. Soc. 1927، 997-1020
DOI: 10.1039/JR9270000997
یکی از اولین پیشنهادها برای مکانیسم واکنش E2. پروفسور اینگولد در این مقاله اشاره می کند:از فرضیه اصلی بر می آید که سهولت حذف ب– پروتون (واکنش A) به (الف) به آسیب پذیری آن بستگی دارد، (ب) به پروتون-آویدیتی آنیون مهاجم بستگی دارد.” - تأثیر قطب ها و پیوندهای قطبی در مسیری که توسط واکنش های حذفی دنبال می شود. قسمت پانزدهم دینامیک حذف الفین ها از ترکیبات آمونیوم چهارتایی
ED Hughes و CK Ingold
جی. شیمی. Soc. 1933، 523-526
DOI: 10.1039/JR9330000523
بسته به ساختار بستر، حذف E1 (تک مولکولی) یا E2 (دو مولکولی) امکان پذیر است. این مقاله شامل یک آزمایش جنبشی است که نشان می دهد حذف دو مولکولی مرتبه دوم است، مرتبه اول در هر دو پایه و RX (که در آن X = -NH است.3+ در این مورد). - جایگزینی الکتروفیل در کربن اشباع شده سیزدهم. کنترل حلال سرعت واکنش های اسید و باز که شامل پیوند کربن-هیدروژن است
دونالد جی کرام، بروس ریکبورن، چارلز ای کینگزبری و پل هابرفیلد
مجله انجمن شیمی آمریکا 1961، 83 (17)، 3678-3687
DOI: 1021/ja01478a029
واکنش های E2 نیاز به استفاده از یک پایه نسبتاً قوی دارند، بنابراین حلال هایی که می توانند پایه را به شکل تفکیک شده پشتیبانی کنند بهترین هستند. حلال های آپروتیک در واقع ایده آل نیستند، زیرا می توانند با پایه پیوند هیدروژنی برقرار کنند و آن را بافر کنند و فعالیت آن را کاهش دهند. شکل 4 و جدول VI وابستگی چشمگیر فعالیت پایه به درصد DMSO در سیستم حلال را نشان می دهد. - شرح روابط فضایی بین پیوندهای منفرد
Klyne & V. Prelog
تجربه 1960، 16، 521–523
DOI: 10.1007/BF02158433
اینجاست که برای اولین بار اصطلاح “ضد periplanar” تعریف می شود. - یک توضیح نظری برای واکنشهای انتخابی E2
کنیچی فوکوی، هیروشی فوجیموتو
چهار وجهی لت. 1965، 6 (48)، 4303-4307
DOI: 10.1016/S0040-4039(00)71091-4
کنیچی فوکوی در سال 1981 جایزه نوبل شیمی را برای توسعه نظریه مداری مولکولی مرزی دریافت کرد. این مقاله از تئوری FMO استفاده میکند تا گزینشپذیری واکنشهای E2 را از نظر همپوشانی مداری بین ضدپیوند CH و پیوند CX. فوکوی چگالی الکترون های مرزی اتم های هیدروژن و اتم های هیدروژن را محاسبه می کند ضد اتم های کلر دارای بالاترین ارزش هستند. - مطالعات استریوشیمی. VII. بازآرایی های مولکولی در حین احیای لیتیوم آلومینیوم هیدرید در سری 3-فنیل-2-بوتانول
دونالد جی کرام
مجله انجمن شیمی آمریکا 1952، 74 (9)، 2149-2151
DOI: 1021/ja01129a003
مقاله کلاسیک توسط پروفسور DJ Cram (UCLA) برنده جایزه نوبل که نشان می دهد ضد استریوشیمی واکنش E2، با اریترو– در مقابل threo 3-فنیل-2-بوتیل توزیلات با NaOEt در EtOH.
