(قسمت چهارم از سری مکانیسم های واکنش هسته دوست های خنثی در شیمی کربونیل)
همانطور که در پست قبلی این مجموعه اشاره کردم، اگر بخواهم شماره 1 مهم ترین واکنش ترکیبات کربونیل را نام ببرم، باید بگویم که این واکنش است. [1,2] علاوه بر این. به واکنش گریگنارد فکر کنید: فلز منیزیم را به یک آلکیل هالید اضافه میکنید، مدتی هم میزنید (متاسفانه گاهی اوقات برای مدت طولانی با گریگنارد) و سپس آلدهید یا کتون را اضافه میکنید. یک واکنش شدید وجود دارد در حالی که Grignard به کربن کربونیل اضافه می کند و در پایان همه آن شما یک الکل جدید به دست می آورید.
یک موضوع تکراری در شیمی آلی این است که بسیاری از واکنشهای رایج هستند برگشت پذیر. اگر [1,2] جمع مهم ترین است، پس مهم ترین واکنش شماره 2 باید باشد [1,2]-حذف. این واکنش فقط [1,2]-افزودن در معکوس، به جز اینکه شما هستید اخراج کردن گروهی که از یک کربن چهار وجهی جدا می شود تا یک کربن جدید را به شما برگرداند π پیوند (یعنی یک کربونیل).
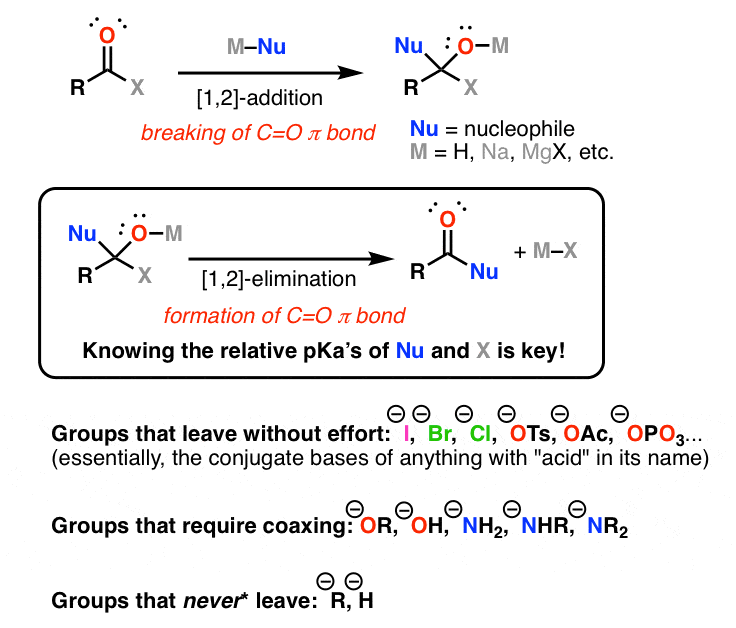
چه چیزی باعث می شود [1,2] حذف جالب این است که گروه های متعددی وجود دارد که میتوانست از کربن چهار وجهی حذف شود، و لازم نیست همان گروهی باشد که در وهله اول به کربونیل حمله کرد. بدین ترتیب، [1,2]-افزودن / [1,2]-حذف امکان تبادل گروه های عاملی متصل به کربونیل را فراهم می کند.
کلید درک [1,2]-حذف دانستن خواص ترک گروه ها است. 3 نوع گروه وجود دارد که باید نگران آنها باشید: گروه هایی که بدون تلاش می روند، گروه هایی که نیاز به تطمیع دارند و گروه هایی که هرگز ترک نمی کنند.
بیایید به هر یک از آنها نگاه کنیم.
گروه هایی که بدون تلاش می روند (هالیدها، AcO(-)، و باز مزدوج تقریباً هر چیز دیگری که در نام آن «اسید» وجود دارد: گروههای ترک در این موارد بازهای مزدوج اسیدهای قوی/متوسط هستند. اینها گروههای ترک خوب و آنیونهای پایدار هستند. در حضور هر نوع هسته دوست نیمه مناسب (حتی آب) آنها از یک ترکیب کربونیل جابجا می شوند (این همچنین شامل فسفات، پایه مزدوج اسید فسفریک است – روش طبیعی برای تبدیل الکل به یک گروه ترک خوب). هرچه اسید قوی تر باشد، باز مزدوج ضعیف تر است و گروه ترک بهتری خواهد بود. مثل همیشه، pKa خود را بشناسید – آنها کلید درک این موضوع هستند.
گروه هایی که نیاز به کوکسینگ دارند (OR، OH، NH2، NHR، NR2):. به شدت پایه ای هسته دوست مانند HO(-) عملکرد خواهد داشت [1,2]-افزودن/[1,2]حذف بر روی یک استر برای جابجایی RO(–). زیر خنثی با این حال، در شرایط، آب به اندازه کافی هسته دوست خوب برای خروج RO (–) نیست. مفید است که برای یک ثانیه با جدول pKa ما در اینجا مشورت کنید. فکر می کنم حداقل یک بار در هر پست این را می گویم.
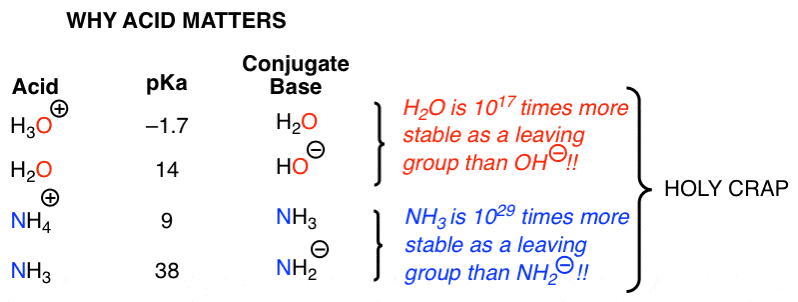
برای انجام این واکنش باید اسید اضافه کنیم. با افزودن اسید، ما از مجبور به جابجایی یک گروه ترک به شدت پایه به جابجایی یک گروه ترک خنثی می رویم. اکنون همانطور که قبلاً در مورد آن صحبت کردم، کاتالیز اسید قدرت فوق العاده ای دارد. 2 چیز را به دست می آورد: 1) کربونیل را به سمت 1،2-افزودن فعال می کند و ثانیاً گروه ترک را پروتونه می کند. تفاوت pKas بین H2O و H3O(+) حدود 17 است. این بدان معنی است که پروتوناسیون توانایی گروه خروجی خود را 16-17 مرتبه قدر افزایش می دهد. این واقعاً یک معامله بزرگ است!. همین امر در مورد NH3 و NH4(+) نیز صدق می کند: پروتوناسیون پایداری پایه مزدوج را 29 (!!!!) مرتبه قدر افزایش می دهد. این یک اثر فوق العاده بزرگ است. درک بزرگی آن عدد اثر دشوار است. یک میلیون بار بزرگتر از عدد آووگادرو.
بیایید در مورد مثالی از این موضوع صحبت کنیم که هر دو اصل کاتالیز اسید را نشان می دهد. تبدیل اسید کاتالیز شده از یک استر به یک اسید کربوکسیلیک یک مکانیسم 5 مرحله ای است. در اینجا نحوه عملکرد واکنش نشان داده شده است. توجه داشته باشید که استفاده از آب به عنوان حلال مهم است – غلظت بالای آب به تکمیل واکنش کمک می کند.
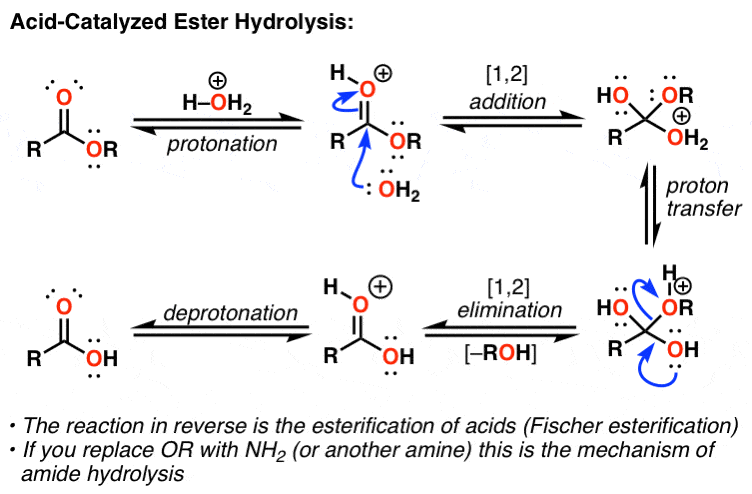
از آنجایی که این یک واکنش تعادلی است، به دلیل وجود غلظت زیاد آب و غلظت کم متانول به سمت راست هدایت می شود. [H2O] >> [MeOH]. نکته جالب در مورد این واکنش این است که تمام مراحل برگشت پذیر هستند جالب اینجاست که وقتی از متانول به عنوان حلال استفاده می کنید و بنابراین [MeOH] >> [H2O] می توانید آن را به صورت معکوس اجرا کنید. دقیقاً همان واکنش است.
در مورد هیدرولیز آمیدها چطور؟ موضوع اینجاست. این نیز همان مکانیسم واکنش است. در این مورد، شما نیتروژن را پروتونه می کنید تا به عنوان آمین (آمین خنثی) از آن خارج شود. اگر واکنش را به صورت رسم شده در نظر بگیرید و فقط گروه OR را با NH2 (یا NHR یا NR2) جایگزین کنید – تبریک میگوییم، شما اکنون مکانیسم هیدرولیز آمید را ترسیم کردهاید.
اگر این مکانیسم 5 مرحله ای را درک کنید، تشکیل استر، هیدرولیز استر و هیدرولیز آمید را درک می کنید. در همه موارد، گروهی را که میخواهید جایگزین کنید (OH، OR، NH2) پروتونه میکنید تا زمانی که به عنوان اسید مزدوج خود (H2O، HOR، NH3) بیفتد.
هیدرولیز نیتریل کمی پیچیده تر است [I’ll talk about it some other day] اما در امتداد خطوط مشابهی نیز پیش می رود: اساساً، شما به پروتونه کردن نیتروژن ادامه می دهید تا در نهایت به صورت NH3 از بین برود.
گروه هایی که هرگز ترک نمی کنند: R و H.
pKa گروههای H (35~) و گروههای R (>45) خیلی زیاد است که اجازه نمیدهد این گروهها بهعنوان آنیون جابجا شوند، بنابراین این گروهها هرگز داخل نمیشوند. [1,2]-حذف ها اما هرگز کلمه قوی نیست، پس بیایید بگوییم هرگز*. هرگز* یعنی آنها هرگز نمی روند مگر در شرایط بسیار خاص.
احتمالاً مهمترین استثنا واکنش رترو-آلدول است:
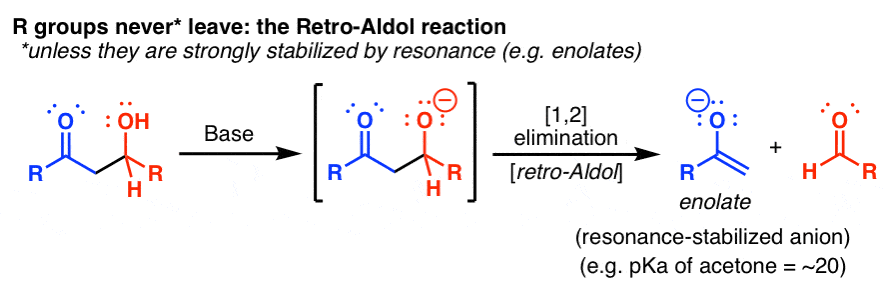
بنابراین اگر گروه R را بتوان با رزونانس تثبیت کرد (مثلاً با یک کربونیل مجاور) که به خود اجازه می دهد آنیون پایدار باشد (به یاد داشته باشید که pKa یک انولات حدود 20 است) می تواند به عنوان یک گروه ترک عمل کند. enolate تقریباً تنها نمونه ای است که در Org 2 با آن مواجه خواهید شد، اما موارد دیگری نیز وجود دارد. (اگر می توانید یک امتیاز دیگر را نام ببرید.)
کلاس دیگری از استثناهایی که به ذهن می رسد عبارتند از Canizarro، اکسیداسیون Meerwein-Pondorf-Verley و بازآرایی پیناکول. همه این واکنشها موارد خاصی هستند، زیرا گروه R یا H واقعاً بهعنوان یک یون آزاد خارج نمیشوند، بلکه در حال مهاجرت به یک مکان واکنشگر نزدیک در یک درون مولکولی واکنش. بنابراین آنها واقعاً قانون را زیر پا نمی گذارند.
بعدی: همه چیز در مورد مکانیسم های تشکیل ایمین ها و انامین ها. و من احتمالاً دوباره به شما خواهم گفت که جدول pKa خود را بیرون بیاورید (این یک امر مسلم است).
