مقدمه ای بر رزونانس
آخرین بار در مورد چگونگی استفاده از الکترونگاتیوی برای یافتن چگالی الکترون در یک مولکول – و زمان نادیده گرفتن بار رسمی صحبت کردیم.
با این حال، من به دومین عامل کلیدی که می تواند تحلیل چگالی الکترون ها را پیچیده کند اشاره نکردم: وجود پیوندهای دوگانه (پیوندهای π). در این پست خواهیم دید که چگونه ترکیب درک دوقطبی ها با درک “بهترین” توزیع پی الکترون ها در یک مولکول، تصویری کلی از مکان الکترون ها در یک مولکول به ما می دهد.
[Further down the line, an understanding of where the electrons are will help us understand where the molecule will participate in reactions. ]
1. استفاده از تفاوت های الکترونگاتیوی برای درک چگالی الکترون در مولکول های دارای پیوند پی – مثال های ساده
اما بیایید با چیزهای ساده شروع کنیم. در بسیاری از موارد، تجزیه و تحلیل الکترونگاتیوی ها می تواند ایده بسیار دقیقی از اینکه چگالی الکترون در مولکول های دارای پیوند π در کجا قرار دارد به شما بدهد. این می تواند به شما بگوید که “دوقطبی ها” کجا هستند.
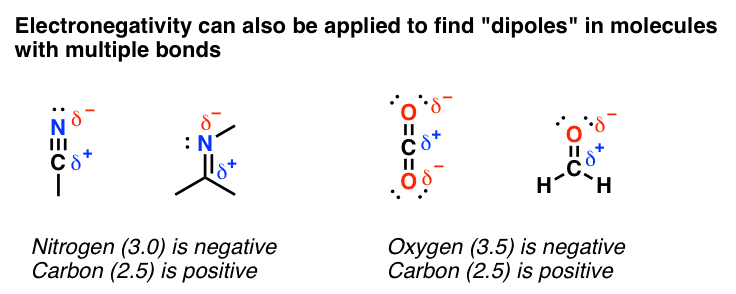
کدام اتم الکترونگاتیوتر است؟ این همان چیزی است که “دلتا منفی” خواهد بود. به اندازه کافی ساده
به هر حال، این مدل برای یافتن مکان های واکنش پذیر در این مولکول ها بسیار موثر است. در اینجا دو نمونه آورده شده است.
ببینید چگونه H+ به سمت اکسیژن تا حدی منفی جذب میشود و HO- به سمت کربن نیمه مثبت جذب میشود.
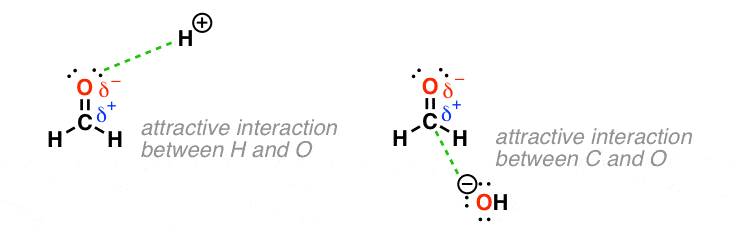
آزمایشها از پیشبینی ما حمایت میکنند که اسید با بار مثبت (یعنی “H +”) در اتم “منفی” حامل الکترونها (اکسیژن در این مورد) واکنش نشان میدهد در حالی که هیدروکسید با بار منفی (HO-) در اتم حامل بار تا حدی مثبت واکنش نشان میدهد. (در این مورد ج).
تا اینجای کار خیلی خوبه.
مشکل مدل ما تا اینجا این است که در برخی موارد به ما امکان پیش بینی دقیق را نمی دهد.
2. دو مورد که در آن “اعمال تفاوت های الکترونگاتیوی” نمی تواند چگالی الکترون را به درستی پیش بینی کند: یون استات و کاتیون آلیل
بخشی از تجربه دانشمند بودن تماشای فرضیه ها/مدل های بسیار ساده و جذاب شما است که توسط شواهد تجربی (یا فقدان آنها) تکه تکه می شوند.
به این دو مولکول زیر نگاه کنید. ساختار لوئیس اولین مولکول (“یون استات”) به نظر می رسد به ما می گوید که یک اکسیژن از دیگری منفی تر است.
ساختار لوئیس مولکول دوم (“کربوکاسیون آلیل”) نشان می دهد که یک کربن بار مثبت را تحمل می کند و بقیه خنثی هستند.
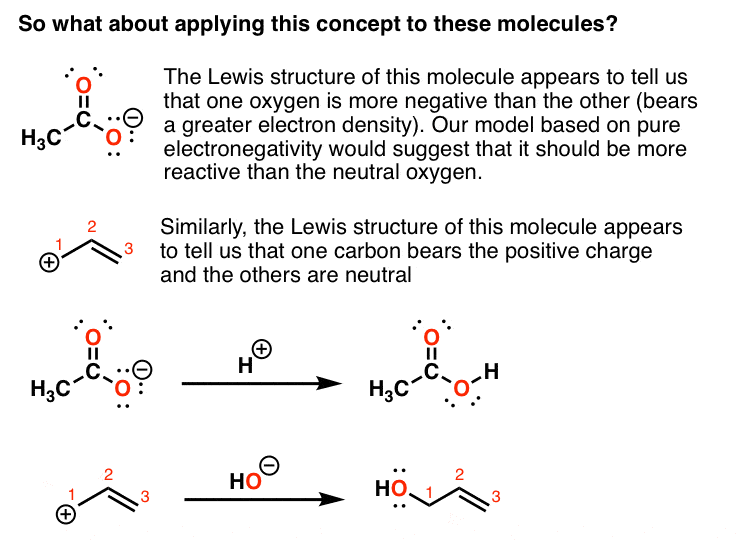
ما از این مدل پیشبینی میکنیم که اکسیژن «منفی»تر، واکنشپذیرتر از اکسیژن خنثی است، و همین طور برای کربنهای «مثبت» و خنثی. با این حال، اگر این مدل را با استفاده از ترکیبات برچسبدار آزمایش کنیم، متوجه میشویم که مدل ساده ما با آزمایش ناسازگار است.
آنچه با اولین مولکول (یون استات) اتفاق می افتد این است که هر یک از دو اکسیژن به یک اندازه با H+ واکنش نشان می دهند.
و در مثال دوم، هر یک از کربن های انتهایی به همان اندازه با هسته دوست ها واکنش نشان می دهند.
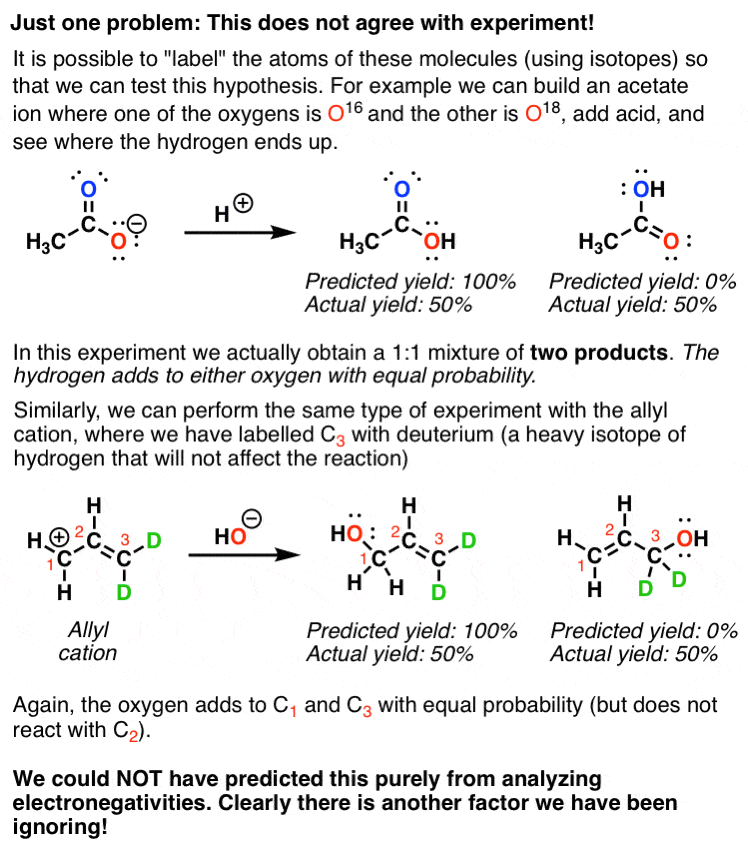
چیزی به وضوح در مدل ما کم است. بیایید دوباره به این مولکول ها نگاه کنیم.
3. ترسیم دو ساختار لوئیس متفاوت برای آنیون استات و کاتیون آلیل امکان پذیر است.
اگر دقت کنید، می توان دو ساختار لوئیس متفاوت را برای این مولکول ها ترسیم کرد.
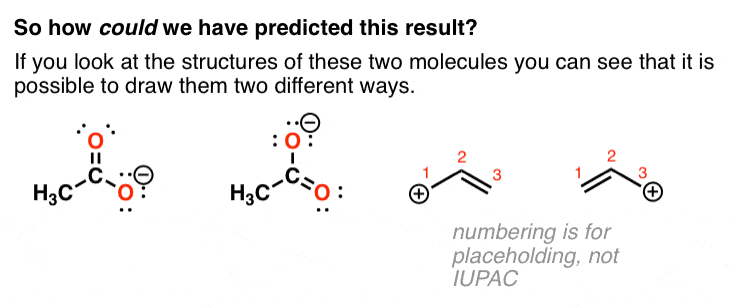
از آزمایش های بالا، مولکول ها رفتار كردن مانند مخلوطی 1:1 از این دو ترکیب. [They are not, but they behave that way!]
بیایید یک مفهوم جدید را معرفی کنیم: رزونانس
4. در این دو مورد، چگالی الکترونی “واقعی” توسط یک “هیبرید” از دو ساختار تشدید منعکس می شود.
هنگامی که بتوانیم دو (یا چند) شکل از یک مولکول را ترسیم کنیم که فقط در محل قرارگیری الکترونهایشان متفاوت است، به این شکلها «اشکال تشدید» (یا «ساختارهای تشدید») میگویند. همچنین می توان گفت که این اشکال “در طنین” هستند. گاهی اوقات آنها را “ایزومرهای رزونانسی” نیز مینامند، اگرچه این امر در بسیاری از دایرهها مورد ضربه قرار میگیرد، زیرا از نظر فنی ایزومر نیستند.
این وسوسه انگیز (و بسیار اشتباه!) است که فکر کنیم این دو شکل بین یکدیگر «تعادل» هستند. از این اشتباه رایج اجتناب کنید!
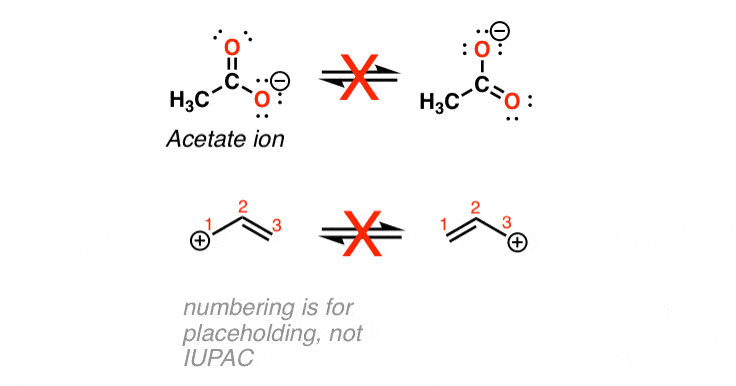
چرا این اشتباه است؟ زیرا اگر این درست باشد، طول پیوند پیوند دوگانه C=O و پیوند منفرد C-O در یون استات متفاوت خواهد بود. (1.21 در مقابل 1.36 Angstrom). با این حال شواهد تجربی (از ساختارهای کریستالی اشعه ایکس) به ما نشان می دهد که طول هر پیوند دقیقاً یکسان است (1.26 آنگستروم). این مشاهدات برای ایزومرهای تشدید بی شمار دیگری نیز انجام شده استمانند گروه های بنزن، کربنات، نیترو و بسیاری دیگر.
این به این معنی است که درست است، واقعی ساختار یون استات (و آلیل کربوکاتیون) یک “هیبرید” از دو شکل تشدید است. ما از یک فلش خاص برای به تصویر کشیدن دو شکل تشدید (فلش دو سر) استفاده می کنیم.
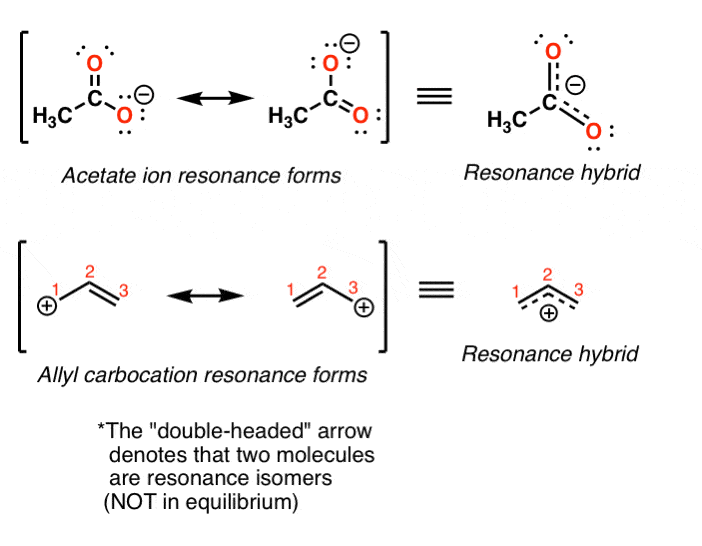
این بدان معنی است که بار رسمی -1 در یون استات به طور مساوی بین دو اکسیژن توزیع می شود. و بار رسمی 1+ در کربوکاتیون آلیل به طور مساوی بین دو کربن انتهایی توزیع می شود. [Note 1]. همانطور که آخرین بار یاد گرفتیم، بار رسمی می تواند راهنمای ضعیفی برای چگالی الکترون باشد، بنابراین در اینجا مثال دیگری را می بینیم که در آن نادرست است.
از نو: چگالی الکترون چیزی است که واقعا برای درک واکنش پذیری یک مولکول مهم است. ساختارهای لوئیس و بارهای رسمی راهنمای ناقصی برای توصیف کامل چگالی الکترون در مولکولها هستند، اما در بسیاری از زمینههای دیگر آنقدر مفید هستند که باید یاد بگیریم با نقصهای آنها زندگی کنیم.
با این حال، ترکیبی از درک دوقطبی (تفاوت های الکترونگاتیوی) و رزونانس تصویر را برای ما کامل خواهد کرد.
در پست بعدی در مورد سیستم حسابداری دیگری که برای توصیف آن استفاده خواهیم کرد صحبت خواهیم کرد جنبش از الکترون ها: فرمالیسم پیکان منحنی.
پست بعدی: مقدمه ای بر فلش های منحنی (2): فلش های منحنی!
یادداشت
یادداشت 1: اینها نمونه های ساده ای هستند. توزیع شارژ همیشه به طور مساوی تقسیم نمی شود و فرم های رزونانس همیشه انرژی یکسانی ندارند – در پست های بعدی بیشتر در مورد آن].
