نقش مهم ضد یون در تعیین E1 در مقابل SN1
- الکل ها تا زمانی که OH به گروه ترک بهتر تبدیل نشود، واکنش های حذفی را تجربه نمی کنند.
- افزودن اسید به الکل باعث ترک بهتر گروه می شود.
- هنگامی که حذف و جایگزینی رقابت می کنند: E1 در مقابل SN1
- برای بدست آوردن E1 To Predominate در مقابل Sن1 در واکنش الکل ها از H2بنابراین4، TsOH یا H3PO4 (و گرما)
- (پیشرفته) مراجع و مطالعه بیشتر
1. الکل ها تا زمانی که OH به یک گروه ترک بهتر تبدیل نشود، واکنش های حذفی را تجربه نمی کنند.
تصور کنید با الکل سمت چپ شروع می کنید و می خواهید به آلکن سمت راست برسید.
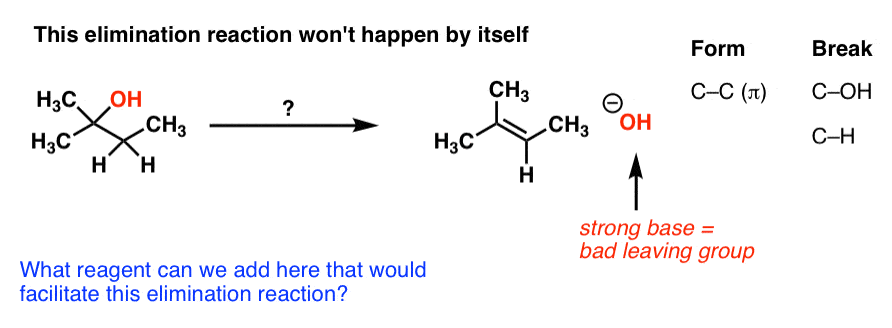
چه پیوندهایی در اینجا شکل می گیرد و شکسته می شود؟ ما در حال تشکیل CC (π) هستیم، CH را می شکنیم و C-OH را می شکنیم. این یک واکنش حذفی است.
متوجه مشکلی در اینجا شده اید؟ ما باید HO(-) را به عنوان یک گروه ترک داشته باشیم. اگر به خاطر داشته باشید، پایه های قوی [like HO(-) ] گروه های ترک وحشتناکی هستند – که مسیر E1 را بعید می کند. پس اگر سعی کنیم از یک پایه قوی استفاده کنیم، شاید در تلاش برای ترویج واکنش E2 باشیم، چه؟ خب، این حتی بدتر خواهد بود – ما احتمالاً OH را قبل از CH از پروتون خارج می کنیم، و می توانید تصور کنید که باید O(2-) به عنوان یک گروه ترک اینجا. خوب نیست!
این بدان معنی است که واکنش، همانطور که نوشته شده است، بسیار بعید است.
2. افزودن اسید به الکل ها باعث خروج بهتر گروه می شود
با این حال، کاری بسیار ساده وجود دارد که می توانیم انجام دهیم تا این واکنش عمل کند. ما باید یک گروه خروجی بهتر داشته باشیم (پایگاه ضعیف تر). ما چطوری می تونیم این کار را انجام بدهیم؟
اسید اضافه کنید!
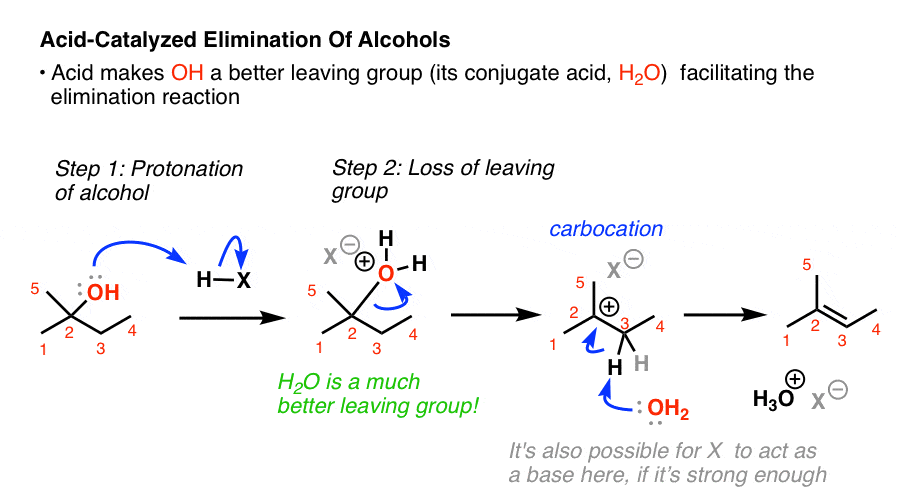
اگر اسید قوی اضافه کنیم OH را به H تبدیل می کنیم2O+، اسید مزدوج گروه ترک بهتری است. در حال حاضر، آب می تواند ترک کند، تشکیل کربوکاتیون. و سپس یک باز می تواند پیوند CH را بشکند و آلکن را تشکیل دهد.
توجه داشته باشید که اکنون این یک واکنش کلاسیک E1 است. نرخ به پایداری کربوکاتیون بستگی دارد. این یکی سوم است، بنابراین باید با نرخ نسبتاً بالایی ادامه یابد.
یک سوال در اینجا مطرح می شود. چه چیزی قرار است به عنوان پایه عمل کند؟ همانطور که مطرح می شود، یک پیوند CH در مجاورت یک کربوکاتیون دارای اسیدیته بسیار بالایی است (حداقل کمتر از -2، اگر از pKa پیروی کنید). این بدان معناست که تقریباً هر باز ضعیف (آب یا باز مزدوج اسید) برای پروتون زدایی کربن کافی است. این امکان وجود دارد که بیش از یک گونه بتواند در اینجا به عنوان پایه عمل کند. من نشان دادم که آب در حال حذف پروتون است، اما بی دلیل نیست که نشان دهیم باز مزدوج اسید در حال حذف پروتون در بیشتر شرایط است.
3. هنگامی که حذف و جایگزینی رقابت می کنند: E1 در مقابل SN1
اکنون یکی از چیزهایی در مورد شیمی آلی می آید که اغلب برای دانش آموزان دردسر ایجاد می کند. برای اولین بار در بحث هایمان در اینجا، با موقعیتی روبرو هستیم که می توانیم داشته باشیم رقابت واکنش ها
بیایید پشتیبان گیری کنیم. واکنش E1 از یک کربوکاتیون عبور می کند، درست است؟ خوب، اگر به خاطر بیاورید، Sن1 واکنش
قبلاً نمونههایی را دیدهایم که در آن یک کربوکاتیون از یک الکل با افزودن یک اسید قوی مانند HCl، HBr یا HI تشکیل شد و در نهایت به آلکیل هالید رسیدیم.
چرا؟ یون های هالید (Cl-، Br-، I-) در شرایط واکنش، نوکلئوفیل های مناسبی هستند.
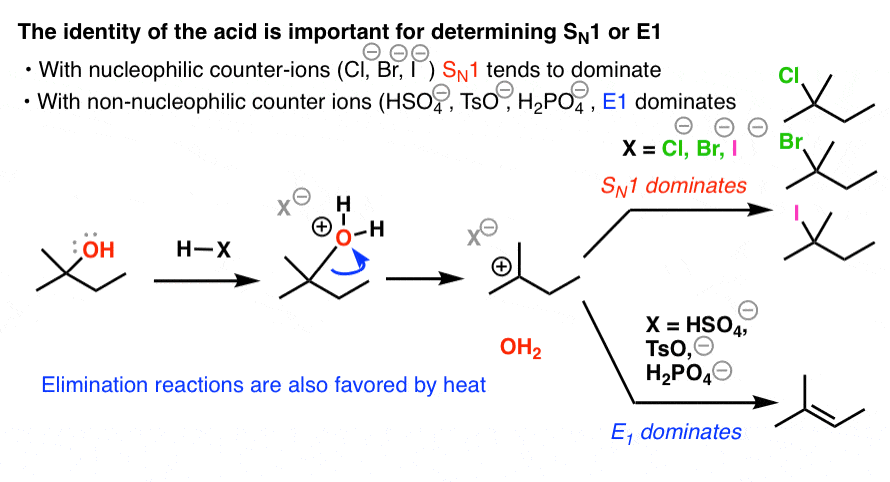
بنابراین چگونه میتوانیم عرشه را به نفع فرآیند E1 روی هم بگذاریم؟
از اسید قوی با باز مزدوج استفاده کنید که a نوکلئوفیل ضعیف
انتخاب معمولی H است2بنابراین4. HSO4(-) یون یک هسته دوست نسبتا ضعیف است به دلیل بار منفی اکسیژن که در سراسر مولکول توزیع می شود (رزونانس). دو اسید دیگر که ممکن است برای این منظور مشاهده کنید، اسید p-toluenesulfonic (p-TsOH) هستند که در اصل پسر عموی H است.2بنابراین4و اسید فسفریک (H3PO4).
همچنین، فراموش نکنید که واکنش های حذف توسط گرما مورد علاقه است.
4. برای بدست آوردن E1 To Predominate در مقابل Sن1 در واکنش الکل ها از H2بنابراین4، TsOH یا H3PO4 (و گرما)
به طور خلاصه، اگر می خواهید E1 بر SN1 غالب باشد: اسیدی را انتخاب کنید که دارای یک ضد یون نوکلئوفیل ضعیف است. [H2SO4, TsOH, or H3PO4]، و گرما.
اگر می خواهید SN1 بر E1 غالب باشد، اسیدی مانند HCl، HBr یا HI را انتخاب کنید.
ما تقریباً صحبت در مورد واکنش های حذف را تمام کرده ایم. پست بعدی – در مورد بازآرایی ها صحبت خواهیم کرد.
پست بعدی: E1 Reaction With Rearrangements
(پیشرفته) مراجع و مطالعه بیشتر
از آنجایی که E1 و Sنواکنشها هر دو از طریق یک واسطه کربوکاتیون مشترک انجام میشوند، این مسیرها میتوانند تحت شرایط واکنش زیادی با یکدیگر رقابت کنند و انجام میدهند.
- جفت یون در حذف
M. Cocivera و S. Winstein
مجله انجمن شیمی آمریکا 1963، 85 (11)، 1702-1703
DOI: 10.1021/ja00894a046
پروفسور Saul Winstein (UCLA) یک شیمیدان آلی فیزیکی بسیار تأثیرگذار در اوایل دهه 20 بود.هفتم قرن، و چندین مفهوم را معرفی کرد که اکنون برای مکانیسم های آلی اساسی هستند، مانند کمک آنکیمری، جفت شدن یون، بازگشت داخلی، و بسیاری دیگر. در این مقاله، پروفسور وینستین نشان می دهد که واکنش E1 یک وابستگی قوی به حلال دارد – با کاهش ثابت دی الکتریک (یا قطبیت) حلال، مقدار الفین به دست آمده نیز کاهش می یابد، زیرا کربوکاتیون ها نمی توانند به راحتی تشکیل شوند. در اتانول بی آب، تی بوتیل کلرید و برمید به ترتیب 44 و 36 درصد آلکن تولید می کنند، در حالی که در اسید استیک یخچالی، به ترتیب 73 و 69 درصد الفین به دست می آید. - مکانیسم واکنش های حذف قسمت یازدهم سینتیک حذف الفین از ترت بوتیل و ترت آمیل برومیدها در محیط های الکلی اسیدی و قلیایی
ML Dhar، ED Hughes، و CK Ingold
جی. شیمی. Soc. 1948، 2065-2072
DOI: 10.1039/JR9480002065
واکنش E1 از نظر مصنوعی برای سنتز الفین بسیار مفید نیست، زیرا نسبت حذف به محصولات جایگزین به طور قابل توجهی کمتر از واکنش E2 است. به عنوان مثال، حلولیز t-butyl bromide در اتانول خشک تنها 19٪ ایزوبوتیلن تولید می کند، در حالی که 93٪ عملکرد آلکن با 2M اتوکسید به دست می آید. - اثرات شیمیایی سویه های استریک. II. تأثیر ساختار بر تشکیل الفین در هیدرولیز کلریدهای آلیفاتیک سوم
هربرت سی براون و راسلین سیلبر فلچر
مجله انجمن شیمی آمریکا 1950، 72 (3)، 1223-1226
DOI: 1021/ja01159a043
این مقاله توسط پروفسور اچ سی براون برنده جایزه نوبل، مطالعه کاملی در مورد اینکه چگونه ساختار بستر می تواند بر E1-S تأثیر بگذارد ارائه می دهد.ن1 مسابقه با یک سری از تیآلکیل کلریدها، نسبت الفین به دست آمده در حلولیز در اتانول 80 درصد با افزایش شاخههای گروههای آلکیل افزایش مییابد. - مکانیسم واکنش های حذف قسمت هشتم اثرات دما بر نرخ ها و نسبت های محصول در واکنش های جانشینی و حذف تک مولکولی و دو مولکولی آلکیل هالیدها و نمک های سولفونیم در حلال های هیدروکسیل
KA Cooper، ED Hughes، CK Ingold، و BJ MacNulty
جی. شیمی. Soc. 1948، 2049-2054
DOI: 10.1039/JR9480002049
پروفسور اینگولد می گوید:[..] برای هر جفت فرآیندهای دو مولکولی همزمان، حذف در هر یک از موارد بررسی شده دارای انرژی فعال سازی آرنیوس است که بالاتر از جایگزینی همراه با 1-2 کیلو کالری بر گرم مول است. بنابراین حذف همیشه ضریب دمایی بیشتری دارد، به طوری که افزایش دما نسبت های تشکیل الفین را افزایش می دهد.“. افزایش دما باعث افزایش اندکی در نسبت الفین در E1-S می شودن1 واکنش - مکانیسم واکنش های حذف قسمت هفتم اثرات حلال بر نرخ ها و نسبت های محصول در واکنش های جانشینی و حذف تک و دو مولکولی آلکیل هالیدها و نمک های سولفونیم در حلال های هیدروکسیل
KA Cooper، ML Dhar، ED Hughes، CK Ingold، BJ MacNulty و LI Woolf
جی. شیمی. Soc. 1948، 2043-2049
DOI: 10.1039/JR9480002043
افزایش متوسط دیگری در بازده الفین در E1-Sن1 واکنش در رفتن از اتانول آبی به اتانول بی آب یافت می شود. - مکانیسم واکنش های حذف قسمت دوم. تشکیل الفین تک مولکولی از هالیدهای ثانویه اکتیل در الکل آبی. یک معیار جدید از مکانیسم
ادوارد دی. هیوز، کریستوفر کی. اینگولد، و اوریل جی. شاپیرو
جی. شیمی. Soc. 1937، 1277-1280
DOI: 10.1039/JR9370001277
این مقاله نشان می دهد که چگونه واکنش های E1 و SN1 هنگام استفاده از بسترهای ثانویه با هم رقابت می کنند. 2-برومو و 2-کلرواکتان هر کدام حدود 14 درصد الفین را هنگامی که تا 100 درجه سانتیگراد در اتانول آبی 60 درصد گرم می کنند، تولید می کنند.
