ثابت اسیدیته Kآ (و لگاریتم منفی آن pKآ ) یک معیار بسیار مفید برای اسیدیته است
بنابراین دفعه قبل همه روندهای مختلفی را که بر اسیدیته تأثیر می گذارند مرور کردیم. نکته اصلی این است که هر عاملی که پایه مزدوج را تثبیت کند باعث افزایش اسیدیته می شود.
اکنون، دانستن روندها عالی است. در واقع بسیار مهم است. (مقاله: نکات مطالعه شیمی آلی – روندها را بیاموزید)
اما وقتی می خواهید اسیدیته دو مولکول را که با یک روند به هم مرتبط نیستند مقایسه کنید، چه می کنید؟
به عنوان مثال، رزونانس اسیدیته الکل ها را افزایش می دهد، اما چقدر؟ بیشتر از اینکه با تغییر OH به SH اسیدیته را افزایش دهید؟ اگر یک گروه برداشت کننده الکترون اضافه کنید چه؟
مرتب کردن همه متغیرهای مخالف از این طریق غیرممکن است. گرایش ها فقط هستند کیفی راهنمای این موضوع
برای پاسخ به این سوال، به برخی داده های سخت نیاز داریم، و تنها یک راه برای به دست آوردن آن در شیمی آلی وجود دارد – از طریق اندازه گیری.
و این همان چیزی است که ثابت اسیدیته K استآ (و لگاریتم منفی آن، pKآ) برای هستند.
فهرست مطالب
- ثابت اسیدیته Kآ نشان دهنده ثابت تعادل برای تفکیک یک اسید به باز مزدوج و یک پروتون
- نمونه هایی از ثابت های تفکیک اسید Kآ برای یک اسید قوی (HI)، یک اسید ضعیف (CH3OH)، و یک اسید بسیار ضعیف (CH4)
- لگاریتم منفی Kآ، “pKآمعیار اسیدیته بسیار راحتتر از K استآ
- pKآ مقیاس بیش از شصت مرتبه بزرگی را در بر می گیرد
- یادداشت
1. ثابت اسیدیته Kآ نشان دهنده ثابت تعادل برای تفکیک یک اسید به باز مزدوج و یک پروتون
بیایید به اسید هیدرویدیک، H–I نگاه کنیم. در محلول (بیایید از آب استفاده کنیم) H–I آب را پروتونه میکنم تا H به دست آید3O(+) و I(-). واکنش معکوس نیز عمل می کند. [I (–) reacts with H3O(+) to give H-I back]. بنابراین این واکنش یک تعادل
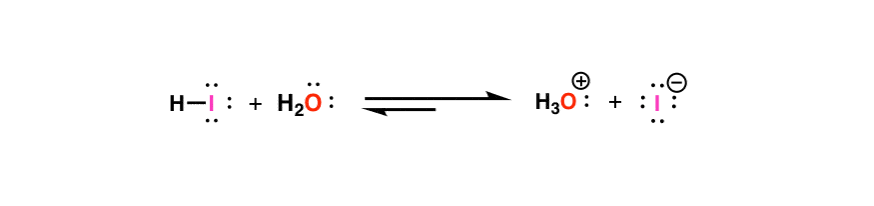
در اینجا بخش مفید است. ما میتوانیم اندازه گرفتن ثابت تعادل این واکنش، و این به ما در مورد اسیدیته نسبی HI می گوید. جزئیات این که چگونه می توانیم این را اندازه گیری کنیم داستان دیگری است، اما برای اهداف ما، اجازه دهید به شما اطمینان دهم که این نوع از ثابت های تعادل را می توان با دقت اندازه گیری کرد.
برای HI، معلوم می شود که ثابت تعادل برای این واکنش حدود 10,000,000,000 است. یعنی برای هر مولکول HI، 10 میلیارد مولکول I(-) وجود دارد. به عبارت دیگر، HI پروتون خود را به راحتی اهدا می کند تا باز مزدوج خود را که نمونه بارز یک اسید قوی است، بدهد.
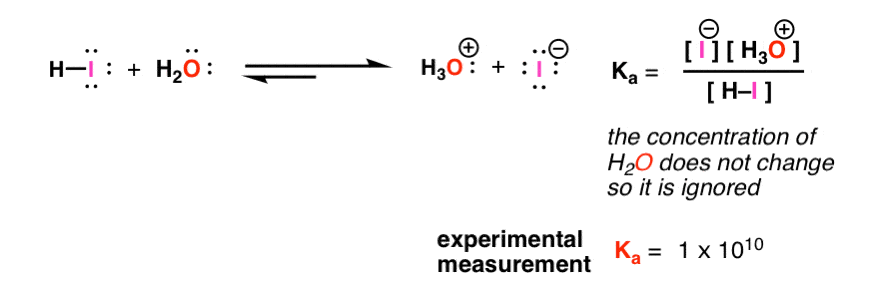
پس چی؟ خوب، ما می توانیم این کار را نه فقط برای HI، بلکه برای هر گونه ای با هیدروژن انجام دهیم. این تعادل «قاعدهای» است که با آن میتوانیم هر اسیدی را با ثابت تعادلش اندازهگیری کنیم. [Note 1]
این ثابت تعادل را K می نامیمآ – “ثابت اسیدیته”.
2. نمونه هایی از ثابت های تفکیک اسید Kآ برای یک اسید قوی (HI)، یک اسید ضعیف (CH3OH)، و یک اسید بسیار ضعیف (CH4)
بیایید به 3 مثال نگاه کنیم. توجه داشته باشید که اینها تا حدودی بیش از حد ساده شده اند زیرا حلال کنار گذاشته شده است.*
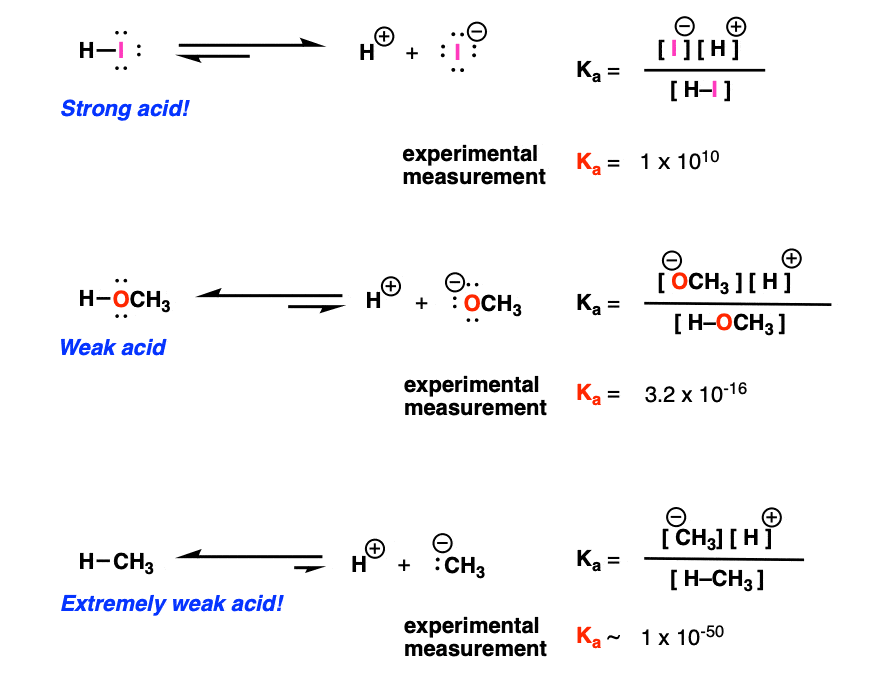
اکنون مقایسه اسیدیته بین اعداد با تعداد زیادی توان بعد از آنها راحت ترین راه برای انجام کارها نیست. بنابراین در عوض، ما به استفاده از مقیاس لگاریتمی پرداختیم. اینها رایج هستند – به عنوان مثال مقیاس ریشتر لگاریتمی است – یک زلزله 8.0 ریشتری 10 برابر قوی تر از یک زلزله 7.0 ریشتری است.
3. لگاریتم منفی Kآ، “pKآمعیار اسیدیته بسیار راحتتر از K استآ
برای اسیدیته، عددی که استفاده می کنیم “pK” نامیده می شودآ“. با مصرف به دست می آید لگاریتم ثابت اسیدیته Ka، و ما خودسرانه تصمیم می گیریم آن را در یک منفی ضرب کنیم [the vast majority of Ka values are less than 1, and we’re generally more comfortable dealing with positive numbers].

بنابراین برای HI، pKآ 10- است (نماینده اسید بسیار قوی)، که برای متانول 15 (اسید ضعیف) و برای متان 50 (اسید بسیار ضعیف) است.
4. pKآ مقیاس بیش از شصت مرتبه بزرگی را در بر می گیرد
این مقیاس شامل 60 مرتبه بزرگی است. این یک عدد بزرگ است!!!!!
برای اینکه ایده ای از مقیاس pK به شما بدهمآ، این محدوده کوچکترین مقدار طول است (طول پلانک، 10-35 متر)، به عرض جهان شناخته شده (حدود 1026 متر). (به مقاله مراجعه کنید: مقادیر pKa در محدوده 60 مرتبه بزرگی)
به هر حال، این اندازه گیری ها در حال حاضر برای هزاران مولکول مختلف انجام شده است. نتیجه یک جدول بزرگ است که به ما امکان می دهد اسیدیته انواع گروه های عملکردی مختلف را با هم مقایسه کنیم. در اینجا یک مثال از یک pK استآ جدول از پست قبلی
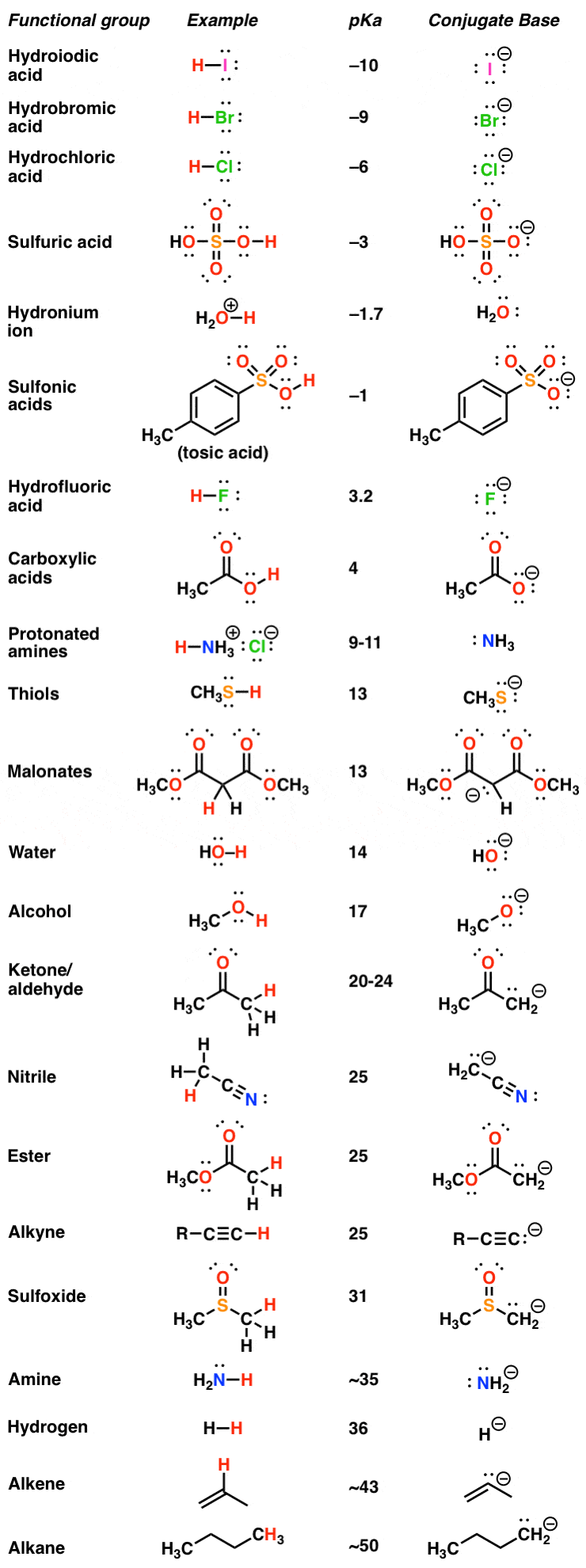
pKآ میز دوست شماست در یک سند، اطلاعاتی در مورد دامنه و اندازه طیف گسترده ای از رفتار شیمیایی به شما می دهد – قوی ترین اسیدهای قوی و ضعیف ترین اسیدهای ضعیف. و از آنجایی که اسید قوی تر، باز مزدوج ضعیف تر است، همچنین اطلاعاتی در مورد بازی ارائه می دهد.
پست بعدی: نحوه استفاده از جدول pKa
یادداشت
یادداشت 1 انتخاب حلال برای این اندازه گیری ها به دلیل “اثر تراز” مهم است. به عنوان مثال آب معمولاً به عنوان حلال برای مولکول های دارای pK استفاده می شودآ مقدار کمتر از صفر و بزرگتر از 14 نیست، زیرا اسید قوی تر از H در آب وجود ندارد3O(+) و پایه قوی تر از HO(-) وجود ندارد.
برای بدست آوردن برخی از مقادیر شدیدتر باید از حلال های دیگری مانند دی متیل سولفوکسید (DMSO) استفاده شود. اگر در یک دوره شیمی آلی پیشرفته تر به پایان رسیدید، به برخی از این مقادیر با چشمی سخت تر از آن لنز نگاه کنید. به شدت توصیه می شود – جدول pKa ایوانز مقادیر H را می دهد2O و DMSO. و تلاش های قهرمانانه هانس رایش در ویسکانسین در جمع آوری مقادیر pKa وجود دارد.
