ارزیابی ساختارهای تشدید با بارهای منفی: برخی از اصول کلیدی
تا اینجا در بحث فرمهای رزونانسی دو اصل مهم را ذکر کردیم که تعیین میکند کدام فرم تشدید مهمتر خواهد بود.
اول، به حداقل رساندن بار کل است: شکل تشدید با کمترین شارژ، مهمترین خواهد بود (که خوب است به عنوان “پایدارترین” فکر کنید، حتی اگر اشکال تشدید در واقع وجود نداشته باشند).
دوم نحوه شکستن پیوندهای پی است: اگر برای ایجاد ساختار تشدید باید پیوند پی را بشکنید، این کار را به گونهای انجام دهید که جفت الکترونها به اتم الکترونگاتیوتر پیوند پی ختم شوند.
در این پست به جزئیات بیشتری در مورد چگونگی ارزیابی “اهمیت” ساختارهای تشدید با بار منفی خواهیم پرداخت – که در واقع به “قرار دادن بار منفی روی حداقل اتم پایه” خلاصه می شود.
فهرست مطالب
- در غیر این صورت یک ساختار رزونانسی با بار منفی روی یک اتم پایه کمتر مهمتر از یک فرم تشدید با بار منفی در یک اتم اصلی خواهد بود.
- ساختارهای تشدید با بار منفی، عامل شماره 1: الکترونگاتیوی
- تثبیت بارهای منفی، عامل شماره 2: قطبی پذیری
- تثبیت بارهای منفی، عامل شماره 3: اثرات القایی
- وقتی چندین متغیر وارد بازی می شوند، با یک جدول pKa مشورت کنید
- نتیجه گیری: سازه های تشدید با بارهای منفی
- یادداشت
1. در صورت مساوی بودن، ساختار تشدید با بار منفی در یک اتم پایه کمتر مهمتر از یک فرم تشدید با بار منفی در یک اتم اساسی تر خواهد بود.

شما می توانید استدلال کنید که این تعریف دایره ای است، زیرا اساسی بودن اساساً یک است اندازه گرفتن پایداری یک آنیون باشه خوبه. هرچه یک آنیون پایدارتر باشد، پایه آن کمتر است. بنابراین چگونه میتوانیم اطلاعاتی در مورد پایه پیدا کنیم؟ پیشنهاد من این است که به بهترین دوست خود سر بزنید، pKآ جدول. یا می توانید با آن آشنا شوید روندهای کلیدی که بر اسیدیته تأثیر می گذارد، و این مفاهیم را در فرم های رزونانس اعمال کنید.
بیایید این روندها را یکی یکی برویم.
2. ساختارهای تشدید با بار منفی، فاکتور شماره 1: الکترونگاتیوی
به یاد بیاورید که با افزایش الکترونگاتیوی یک اتم، پایه کاهش می یابد.
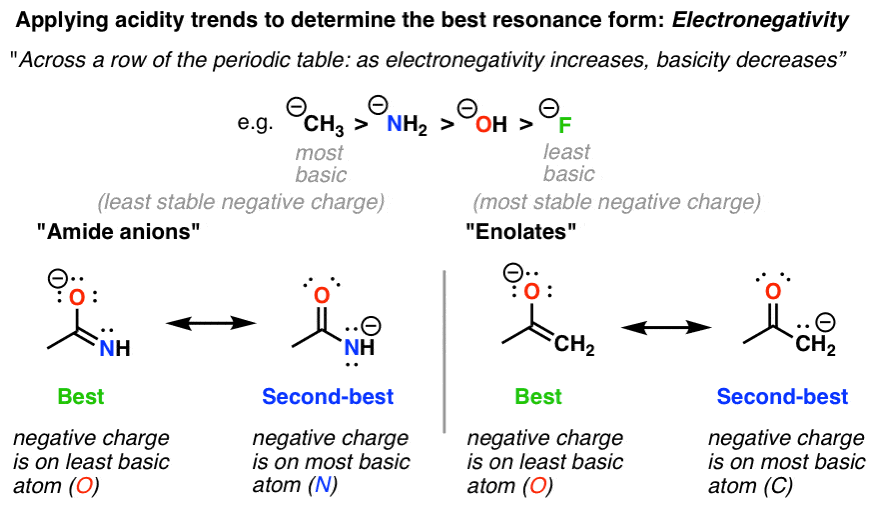
این بدان معناست که در مقایسه دو شکل رزونانس بار مساوی، با بررسی الکترونگاتیوی میتوانیم تعیین کنیم که کدامیک پایدارتر است. در مثالهای بالا، میتوان گفت که اشکال تشدید سمت چپ پایدارتر از اشکال تشدید در سمت راست هستند، زیرا الکترونگاتیوی O > N و همچنین O > C. ساختارهای شیمیایی زیادی وجود دارند که اشکال تشدید دارند. با بارهای متناوب در C و N (یا O)، بنابراین این یک قانون بسیار مفید است.
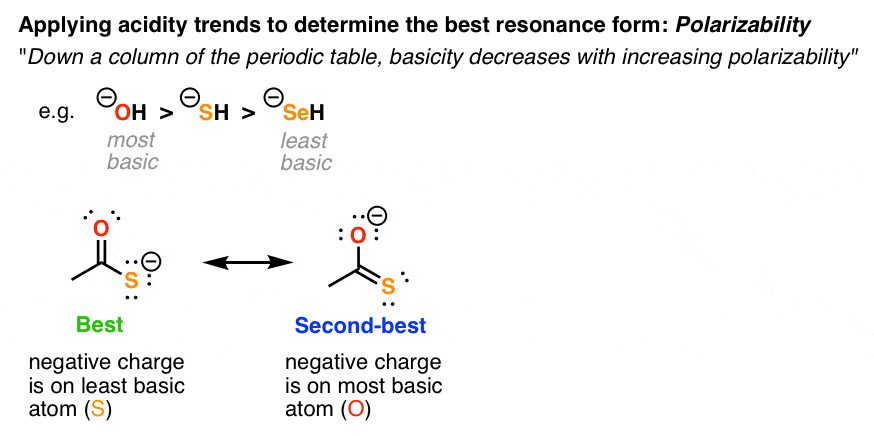
3. تثبیت بارهای منفی، عامل شماره 2: قطبی پذیری
با افزایش قطبش پذیری، پایه اتم کاهش می یابد. این روند به ویژه برای اتم های موجود در همان ستون جدول تناوبی مانند O و S صدق می کند.
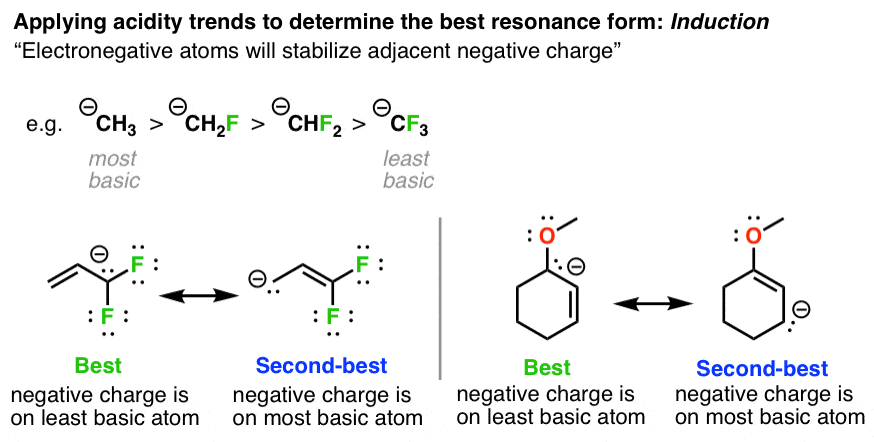
4. تثبیت بارهای منفی، عامل شماره 3: اثرات القایی
با تثبیت بار منفی توسط گروههای خارجکننده الکترون مجاور، پایه کاهش مییابد. بنابراین در موارد زیر، شکل تشدید پایدارتر شکلی است که در آن بار منفی روی اتم با گروههای الکترون اضافی خارجکننده باشد. [
5. When Multiple Variables Come Into Play, Use A pKa Table
But it ain’t always straightforward. Organic chemistry being what it is, it’s common to have situations where we have to weigh the effects of multiple variables. Like in these examples.
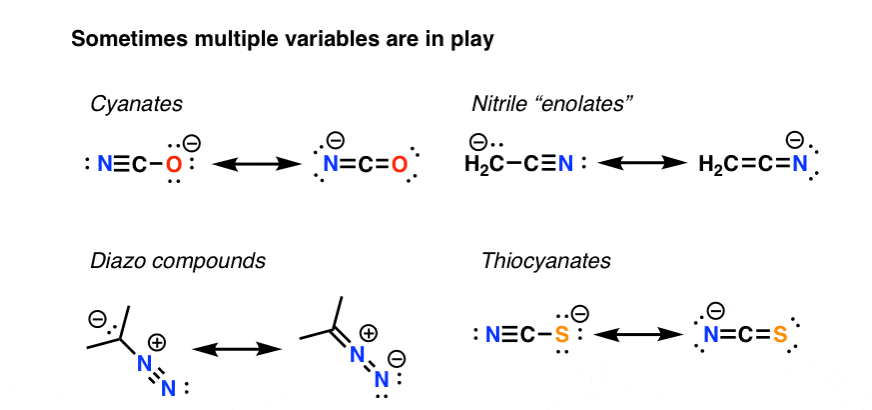
What do we do here? We rely on experimental results. One body of work in this area is the pKa table, an experimentally derived guide to the multi-variable dependent phenomenon of acidity. Another is to compute the relative energies computationally. Or, a third is simply to apply the 4 principles we’ve discussed earlier to the situation at hand and see which act in the same direction and which oppose. At least 3 of the examples here should be fairly straightforward to figure out .
6. Conclusion: Resonance Structures With Negative Charges
So to make a long story short, as I’ve said many times before, the pKa table is your friend. For three good reasons.
1. It tells you about the relative strengths of acids and bases (itself very important)
2. It gives you an idea of which atoms will bear negative charge the best (useful for determining the stability of resonance structures). (Weakly basic atoms bear negative charge the best.)
3. When you learn about substitution and elimination reactions, it also is the Rosetta Stone for determining leaving group ability. (Good leaving groups = weak bases)
Next Post: Evaluating Resonance Forms (4): Where to put the positive charges?
Notes
Note 1: What about hybridization? Doesn’t that affect stability of negative charges too? After all, the reason why alkynes are more acidic than alkenes which are more acidic than alkanes is because the ability of orbitals to stabilize negative charge increases as increase the amount of s character [sp3 to sp2 to sp ]. بنابراین آیا نباید برای مثال در مورد زیر اعمال شود؟
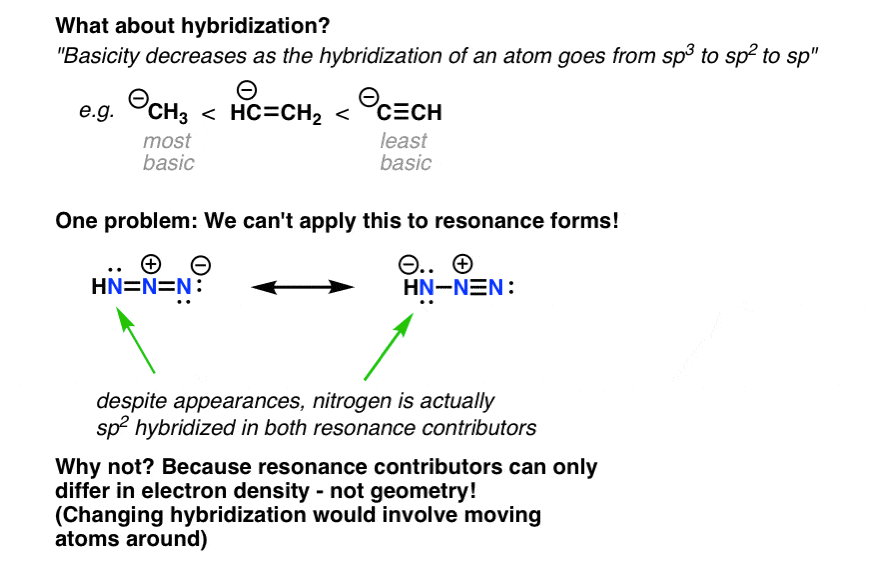
از بررسی این دو شکل تشدید ممکن است وسوسه شویم که نیتروژن سمت چپ (هیدروژن حاوی هیدروژن) sp.2 در یک نسخه و sp3 در دیگری.
با این حال، اگر به این فکر کنید که اشکال تشدید چه چیزی را نشان میدهند – روشهای مختلف نشان دادن چگالی الکترون – متوجه خواهید شد که این نمی تواند در واقع مورد زیرا این شامل حرکت اتم ها به اطراف است [re-hybridizing from sp2 (trigonal planar) to sp3 (tetrahedral). ].
هر دو اتم نیتروژن در واقع sp2 هیبرید شده، و پایداری آنها را نمی توان بر اساس این ویژگی تشخیص داد. [Thank you to reader Brian E. for correcting an earlier version of this post. In fact, Brian informs me that calculations indicate the right-hand resonance form makes a significantly higher contribution to the resonance hybrid than does the left-hand resonance form].
