کرنش حلقه در سیکلوآلکان ها (1) – محاسبه کرنش حلقه
این پست درباره نحوه محاسبه کرنش حلقه است. اگر جزئیات بیشتری در مورد کرنش حلقه در سیکلوپروپان و سیکلوبوتان می خواهید، پیشنهاد می کنم به پست بعدی بروید.
در آخرین پست ما در مورد یکی از پیامدهای این واقعیت که کربن می تواند حلقه تشکیل دهد، یاد گرفتیم – اینکه ما می توانیم استریو ایزومرها (cis / trans) را تشکیل دهیم. در این پست سعی شده است یکی دیگر از پیامدهای بسیار جالب تشکیل حلقه توضیح داده شود: کرنش حلقه.
همه چیز با این شروع می شود: معلوم می شود شما می توانید با سوزاندن مولکول ها چیزهای زیادی در مورد آنها بیاموزید. البته به صورت کنترل شده و کمی. 🙂
فهرست مطالب
- گرمای احتراق آلکان ها
- گرمای احتراق به عنوان تابعی از طول زنجیره
- گرمای احتراق برای یک زنجیره بسیار طولانی حدود 157 کیلو کالری در مول در هر CH است.2
- سیکلوآلکان ها فرمول عمومی دارند (CH2)n
- هر گونه انحراف از مقدار متوسط 157 کیلو کالری در مول در هر CH2 نشان دهنده کرنش حلقه است
- چه عواملی ممکن است منجر به کشیدگی حلقه شود؟
- یادداشت
- (پیشرفته) مراجع و مطالعه بیشتر
1. گرمای احتراق آلکان ها
گرمای مولی احتراق، همانطور که ممکن است از ژن شیمی به خاطر بیاورید، انرژی آزاد شده با سوزاندن یک مول از یک ماده است. این یک مقدار آنتالپی است [Δ H] – معمولاً بر حسب kJ/mol یا kcal/mol اندازه گیری می شود. ما در اینجا از kcal/mol استفاده می کنیم [why do organic chemists use kilocalories] اما برای تبدیل به kJ/mol، در 4.184 ضرب کنید و همان چیزی را دریافت خواهید کرد.
بیایید با یک چیز ساده شروع کنیم. تصور کنید ما یک سری آلکان با زنجیره مستقیم داشتیم. اتان، پروپان، بوتان، تا دودکان (12).
با افزایش تعداد کربن ها، افزایش انرژی آزاد شده پس از احتراق افزایش می یابد. من دوست دارم از تشبیه یک راه پله بی نهایت استفاده کنم: با هر پلهای که بالاتر میرویم، فاصله بین خود و کف را افزایش میدهیم و در نتیجه انرژی آزاد شده را در صورت سقوط از پله به زمین افزایش میدهیم: – ) .

2. گرمای احتراق به عنوان تابعی از طول زنجیره
بیایید یک سوال ساده بپرسیم: گرمای احتراق چگونه با اضافه کردن کربن اضافی تغییر می کند؟
آیا فکر میکنید ما انتظار داریم که با افزودن متوالی کربن (بر اساس قیاس به پلکانی با پلههای مساوی) شاهد «فاصله مساوی» از انرژیها باشیم؟ یا فاصله ها به تدریج تغییر می کند؟ و مهمتر از همه، آیا می توانیم از این اطلاعات برای پیش بینی استفاده کنیم؟
بیایید هیدروکربنهای مختلف زنجیره مستقیم را بسوزانیم و اندازهگیری کنیم که هر مولکول چقدر انرژی (بر حسب کیلو کالری/مول) آزاد میکند.
سپس می توانیم میانگین انرژی آزاد شده را محاسبه کنیم در هر کربن – این به ما “فاصله” بین هر مرحله می دهد. این به ما کمک می کند تا انرژی آزاد شده را برای مرحله بعدی پیش بینی کنیم.
[Here, use your imagination as we burn hydrocarbons of varying length and measure the heat of combustion for each case].
اکنون به داده ها نگاه می کنیم. وقتی این کار را انجام میدهیم، میبینیم که کیلوکالری در مول کربن شروع به بالا میکند: 213 برای متان (نشان داده نشده)، 186 (برای اتان) و سپس شروع به رسیدن به حدی کمتر از 160 کیلوکالری در مول میکند. این مانند پلکانی است که در آن پلهها بزرگ شروع میشوند، اما به تدریج از ارتفاع آن کاسته میشوند تا زمانی که همه به ارتفاع یکنواخت تبدیل شوند.
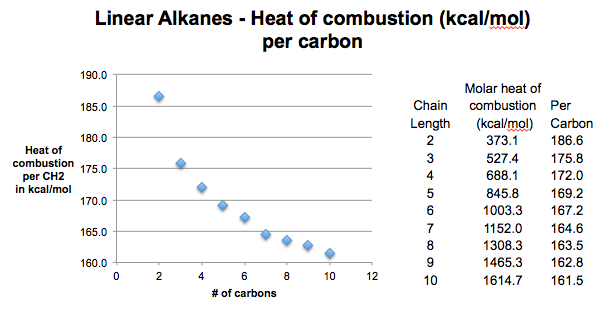
3. گرمای احتراق برای یک آلکان با زنجیره مستقیم بسیار طولانی حدود 157 کیلوکالری در مول در هر CH است.2
اتفاقاً منحنی چه خبر است؟ سوال بسیار ظریف پاسخ طولانی است، بنابراین در این یادداشت آمده است. نسخه کوتاه: در یک آلکان زنجیره مستقیم با فرمول CH3(CH2)nCH3، گرمای آزاد شده از سوزاندن انتهای آن [CH3] بالاتر از آن است که از سوزاندن CH داخلی بدست می آید2 گروه ها. همانطور که زنجیره طولانی تر می شود، و #CH2 >> #CH3 سهم نسبی 2 CH3 گروه ها به ΔH کلی کاهش خواهد یافت. بنابراین در حد بینهایت n مقدار ΔHاحتراق به CH نزدیک خواهد شد2 (حدود 157 کیلوکالری در مول).
4. سیکلوآلکان ها فرمول عمومی دارند (CH2)n
پس این چه ربطی به سیکلوآلکان ها دارد؟ سیکلوآلکان ها تشکیل شده اند فقط از CH2 گروه ها. هیچ “پایانی” برای نگرانی وجود ندارد. بنابراین اگر همان آزمایش احتراق را تکرار کنیم – با سیکلوپروپان شروع کنیم و CH را افزایش دهیم2 هر بار یکی، ممکن است انتظار داشته باشیم فقط گرمای احتراق را ببینیم که فقط با ΔH CH افزایش مییابد.2 (157 کیلو کالری در مول).
به عبارت دیگر، ما ساده لوحانه انتظار داریم یک راه پله را ببینیم ارتفاع پله یکنواخت، تمام راه به بالا.
علم اغلب با داشتن این تصورات ساده لوحانه در مورد چگونگی کارکرد طبیعت، و سپس انجام آزمایش و یافتن اینکه واقعیت برخلاف انتظارات ما (و در نتیجه بسیار جالبتر از) است، شروع میشود. این یک نمونه بارز است!
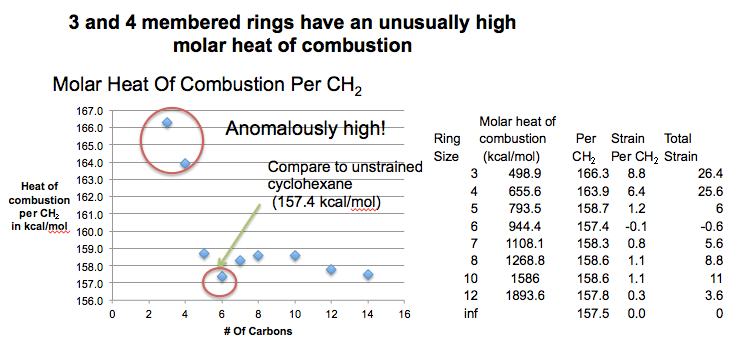
5. هر گونه انحراف از مقدار 157 کیلو کالری در مول در هر CH2 درباره فشار حلقه به ما می گوید
وقتی آنها را می سوزانیم چه اتفاقی می افتد. به آن «ارتفاع متوسط پله» نگاه کنید (معروف به ΔHاحتراق/CH2). برای C=3 (سیکلوپروپان، 166.3 کیلوکالری در مول) و C=4 (سیکلوبوتان، 163.9 کیلوکالری در مول) بسیار بزرگتر از انتظار ما است، در C=6 (سیکلوهگزان 157.4 کیلوکالری در مول) به حداقل می رسد و سپس دوباره به سمت بالا حرکت می کند. تا رسیدن به یک حداقل دیگر در C=12 (سیکلودودکان). در نمودار گنجانده نشده است، اما ارتفاع پله از آنجا به بعد ثابت است، در حدود 157.4 کیلو کالری در مول.
بنابراین اگر 157.4 کیلوکالری در مول را به عنوان پایه در نظر بگیریم، سیکلوپروپان 8.8 کیلوکالری در مول “اضافی” در هر کربن آزاد می کند که در مجموع 26.4 کیلوکالری در مول است. سیکلوبوتان 6.4 کیلو کالری در مول “اضافی” در هر کربن آزاد می کند که در مجموع 25.6 کیلو کالری در مول است. این انرژی “اضافی” به این معنی است که این مولکول ها در واقع هستند بیشتر ناپایدار از آنچه ما انتظار داشتیم (“بالاتر از پله ها” از آنچه فکر می کردیم – بنابراین فاصله بیشتری برای افتادن روی زمین وجود دارد). ما به این بی ثباتی «اضافی» می گوییم،نژاد”.
توجه داشته باشید – اگر گرمای تشکیل را به جای گرمای احتراق مقایسه کنیم، نتایج مشابهی دریافت خواهیم کرد، اما احتراق بسیار واضح تر است: -)
6. چه عواملی ممکن است منجر به کشیدگی حلقه شود؟
مانند هر آزمایش خوب، این نیز سؤالات جدیدی را ایجاد می کند.
- اول، چه چیزی می تواند منبع این “فشار” باشد؟ چرا سیکلوپروپان و سیکلوبوتان ممکن است بسیار ناپایدارتر از آنچه ما ساده لوحانه انتظار داشتیم باشند؟
- دوم، چرا سیکلوهگزان صافتر از سیکلوپنتان است؟ برای مثال، زوایای داخلی یک پنج ضلعی (108 درجه) به زوایای پیوند ایده آل برای یک چهار وجهی (109 درجه) بسیار نزدیکتر از یک شش ضلعی (120 درجه) است. پس چه چیزی می دهد؟
- سوم، افزایش کرنش بین C=6 (سیکلوهگزان) و C=14 چیست؟ چرا کرنش از سیکلوهگزان بالا می رود و دوباره پایین می رود؟
در پست بعدی به سیکلوپروپان و سیکلوبوتان می پردازیم و سپس در پست های بعدی دو سوال بعدی را بررسی خواهیم کرد.
یادداشت
توجه داشته باشید: بیش از حد O2، تمام C به CO تبدیل می شود2 و تمام H به H تبدیل می شود2O. سوختن متان (CH4) 1 معادل CO به ما می دهد2 و 2 معادل H2O. Ethane به ما 2 equivs CO می دهد2 و 3 معادل H2O. پروپان به ما 3 equivs CO می دهد2 و 4 معادل H2O. بر اساس هر کربن، با افزایش # کربن، CO2/ح2نسبت O به 1 نزدیک می شود. ΔHاحتراق بر اساس هر کربن بالاترین مقدار برای متان است زیرا به نسبت H بیشتر است2O تشکیل می شود، بنابراین به نسبت انرژی بیشتری آزاد می شود. بازگشت به بالا
(پیشرفته) مراجع و مطالعه بیشتر
- Ueber Polyacetylenverbindungen
آدولف بایر
بر. 1885، 18 (2)، 2269-2281
DOI: 10.1002/cber.18850180296
مقاله اصلی در مورد کرنش حلقه توسط شیمیدان افسانه ای آدولف فون بایر. با وجود اینکه این مقاله با موضوعی کاملاً متفاوت عنوان شده است، کرنش حلقه در انتهای مقاله مورد بحث قرار گرفته است. - ارزیابی کرنش در هیدروکربن ها. سویه موجود در آدامانتان و منشا آن
پل فون آر. شلایر، جیمز ارل ویلیامز، و بلانچارد کی آر
مجله انجمن شیمی آمریکا 1970، 92 (8)، 2377-2386
DOI: 1021/ja00711a030
مقاله اولیه پروفسور P. v. R. Schleyer قبل از اینکه در دهه 1970 به آلمان نقل مکان کند. Adamantane موضوع حیوان خانگی او بود، زیرا یکی از مقالات پراستناد او یک ارتباط 1 صفحه ای در JACS در سنتز ساده آدامانتان جدول VII در این مقاله مجموعه بزرگی از انرژی های کرنش هیدروکربن های مختلف از جمله سیکلوپروپان و سیکلوبوتان (به ترتیب 13/28 و 90/26 کیلوکالری در مول) را در خود دارد. - ارزیابی انتقادی مکانیک مولکولی
ادوارد ام. انگلر، جوزف دی. آندوز و پل در برابر آر. شلایر
مجله انجمن شیمی آمریکا 1973، 95 (24)، 8005-8025
DOI: 1021/ja00805a012
جدول 2 در این مقاله حاوی جدول بزرگی از آنتالپی های تشکیل و انرژی های کرنش است که هم به صورت تجربی تعیین شده و هم از نظر تئوری محاسبه شده است. - آنتالپی و سینتیک ایزومریزاسیون کوادری سیکلان به نوربورنادین انرژی کرنش کوادری سیکلان
دیوید اس. کاباکوف، ژان سی جی بوئنزلی، ژان اف ام اوث، ویلیس بی هاموند و جروم ای. برسون
مجله انجمن شیمی آمریکا 1975، 97 (6)، 1510-1512
DOI: 1021/ja00839a039
این مقاله از طریق یک مطالعه ترموشیمیایی دقیق از ایزومریزاسیون کوادری سیکلان می گذرد و انرژی کرنش را در kcal/mol 1 ± 96 تعیین می کند. - بررسی مولکولهای آلی تنششده
جوئل اف. لیبمن و آرتور گرینبرگ
بررسی های شیمیایی 1976، 76 (3)، 311-365
DOI: 1021/cr60301a002 - مفهوم کرنش در شیمی آلی
کنت بی ویبرگ
آنژو. شیمی. بین المللی اد. 1986، 25 (4)، 312-322
DOI: 10.1002/anie.198603121
کرنش حلقه را می توان “کرنش زاویه” نیز نامید که در نتیجه اعوجاج زوایای پیوند ایجاد می شود و محتوای انرژی مولکول را افزایش می دهد. این مقاله همچنین پروپلان ها را مورد بحث قرار می دهد، یک دسته جالب از مولکول های کوچک فشرده. در حالی که [1.1.1]پروپلان را می توان جدا کرد، [2.2.1] هنوز به عنوان یک ماده خالص به دست نیامده است. این به دلیل قدرت پیوند مرکزی به سمت شکاف همولیتیک است که مسیری را برای تجزیه فراهم می کند. این انرژی به شدت تحت تأثیر تفاوت در انرژی کرنش بین واکنش دهنده و دیرادیکال حاصل. که در [1.1.1]پروپلان، تفاوت 65 کیلو کالری در مول است، در حالی که در [2.2.1]پروپلان، 5 کیلو کالری در مول است. - تجزیه و تحلیل نظری خواص هیدروکربن. 1. پیوندها، ساختارها، غلظت بار و شل شدن بار
کنت بی. ویبرگ، ریچارد اف دبلیو بادر، و کلمنت دی اچ لاو
مجله انجمن شیمی آمریکا 1987، 109 (4)، 985-1001
DOI: 1021/ja00238a004
تغییرات در هیبریداسیون با تغییرات الکترونگاتیوی مرتبط است. هر چه بزرگتر باشد س ویژگی یک اوربیتال کربنی خاص، الکترونگاتیوی آن بیشتر است. در نتیجه، اتمهای کربنی که بخشی از حلقههای تحت فشار هستند نسبت به هیدروژن الکترونگاتیوتر از حالت عادی هستند. - واکنشپذیری ترکیبات کرنش: آیا بیثباتی حالت زمین دلیل اصلی افزایش نرخ است؟
آریل سلا، هارولد باش و شماریاهو هوز
مجله انجمن شیمی آمریکا 1996، 118 (2)، 416-420
DOI: 1021/ja951408c
کرنش حلقه می تواند باعث تغییرات کیفی در ماهیت پیوندها شود (هیبریداسیون) و این تغییرات می تواند واکنش پذیری را افزایش دهد. - ترموشیمی کوبان 50 سال پس از سنتز آن: مطالعه نظری سطح بالا در مورد کوبان و مشتقات آن
فیلیپه آگاپیتو، روی سی. سانتوس، روی ام. بورخس دوس سانتوس، و خوزه آ. مارتینیو سیمیس
مجله شیمی فیزیک الف 2015، 119 (12)، 2998-3007
DOI: 10.1021/jp511756v
ارزیابی مجدد خواص ترموشیمیایی کوبان با استفاده از روش های محاسباتی نویسندگان در اینجا انرژی کرنشی کوبان را 667 کیلوژول بر مول (159 کیلوکالری در مول) ارزیابی می کنند، که بسیار نزدیک به آنچه قبلاً تعیین شده است (154 کیلو کالری در مول) است.
