فلز سدیم (Na) به عنوان یک معرف در شیمی آلی
در یک پلاگین آشکار برای راهنمای Reagent و برنامه Reagents برای iPhone، هر جمعه یک معرف متفاوت را که معمولاً در Org 1/ Org 2 با آن مواجه میشویم، نمایه میکنم.

موضوع امروز، فلز سدیم یک معرف بسیار بدنام است. شما ممکن است آن را از یوتیوب به عنوان «جامدی که در آب میریزید و چیزها را منفجر میکنید، خاصیتی که با پتاسیم و سایر فلزات قلیایی مشترک است، بدانید.
سدیم کاربردهای زیادی در شیمی آلی دارد. فلز سدیم فقط یک الکترون تنها در لایه ظرفیت خود دارد و آن را به راحتی به هر مولکولی که بپذیرد می دهد. این شامل آب نیز میشود: وقتی فلز سدیم را در آب میریزید، اتفاقی که میافتد این است که H2O به گاز هیدروژن تبدیل می شود و در این فرآیند هیدروکسید سدیم تشکیل می شود. سدیم همچنین می تواند برای کاهش بسیاری از انواع ترکیبات آلی مانند آلکین ها و ترکیبات معطر در میان بسیاری دیگر که در اینجا مورد بحث قرار نگرفته اند استفاده شود.
برای چه مواردی استفاده می شود: یک عامل احیا کننده قوی، آلکین ها را به ترانس آلکن کاهش می دهد. همچنین هنگامی که به الکل ها اضافه می شود، گاز هیدروژن تشکیل می دهد که در نتیجه آلکوکسید ایجاد می شود. همچنین گروه های معطر را به آلکن کاهش می دهد (کاهش توس). فلز سدیم به طور کلی آلکن ها را کاهش نمی دهد.
فلز سدیم در NH3 – کاهش آلکین ها برای دادن ترانس-آلکن ها
بیایید به مثال اول نگاه کنیم: احیا آلکین ها به ترانس آلکن. سدیم در آمونیاک مایع (نقطه جوش -33 درجه سانتیگراد) حل می شود و رنگ آبی تیره زیبایی ایجاد می کند. هنگامی که آلکین ها وجود داشته باشند، آنها به ترانس کاهش می یابند (یعنی E) آلکن. این باعث Na/NH می شود3 یک همراه مفید برای احیای لیندلار آلکین ها، که سیس-آلکن می دهد.
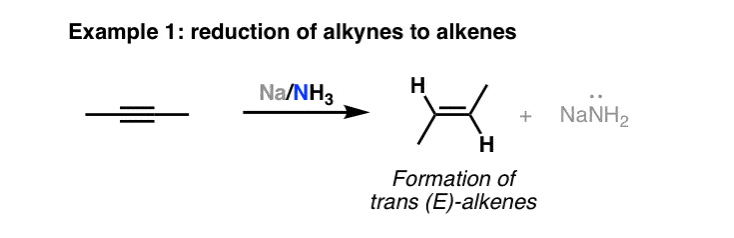
تشکیل آلکوکسیدها از الکل ها
همانطور که قبلا ذکر شد، فلز سدیم نیز الکل ها را به آلکوکسید تبدیل می کند (به یاد داشته باشید: آلکوکسیدها بازهای مزدوج الکل ها هستند). در این فرآیند، گاز هیدروژن آزاد میشود، بنابراین باید با احتیاط زیاد و به طور توصیهای در فضایی بدون اکسیژن انجام شود. این یک راه مفید برای ساختن پایه مزدوج یک الکل بدون نگرانی در مورد اسید مزدوج در محلول است، زیرا تنها محصول جانبی گاز هیدروژن است.
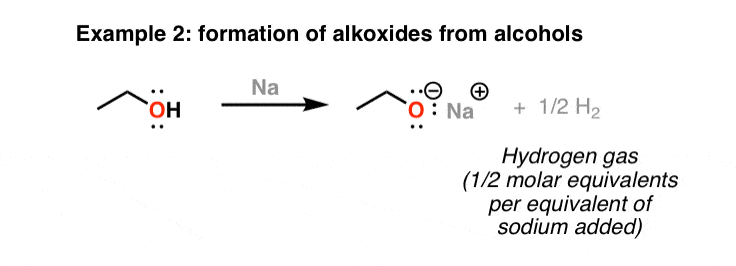
فلز سدیم در آمونیاک: کاهش توس
در نهایت، فلز سدیم در آمونیاک (NH3) حاوی چندین معادل تی بوتانول باعث کاهش ترکیبات معطر به دی ئن ها (غیر کونژوگه) می شود. این واکنش مفید کاهش توس نامیده می شود. توجه داشته باشید که این الگو به این بستگی دارد که آیا جایگزین در گروه آروماتیک اهداکننده الکترون است (مانند OCH3) یا برداشت الکترون (CO2من).
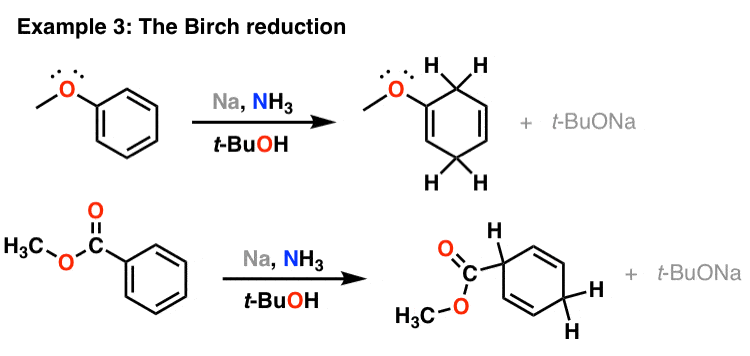
سدیم در NH3 برای کاهش آلکین ها: مکانیسم
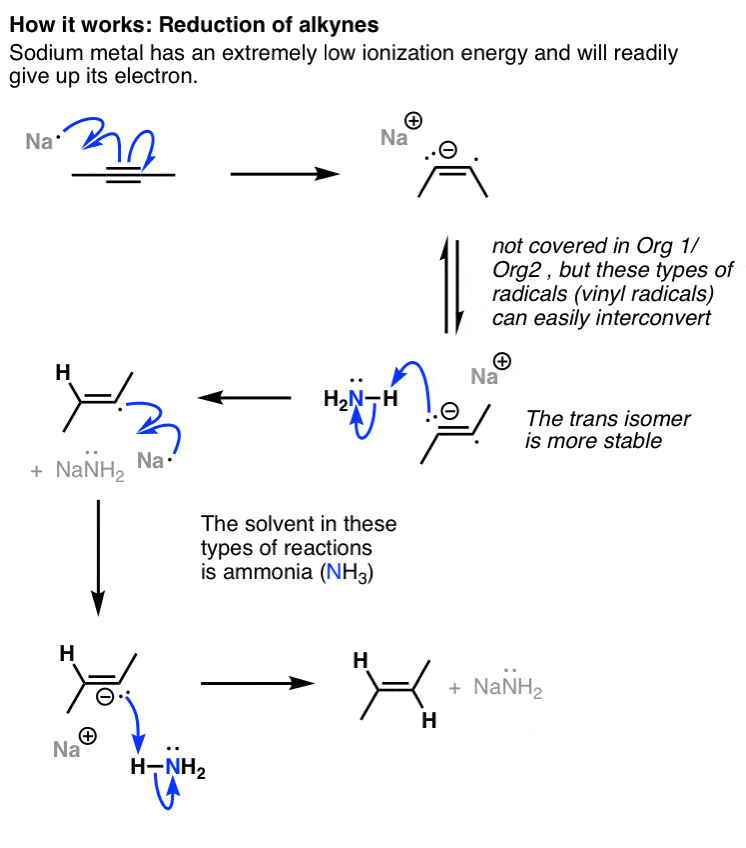
چگونه کار می کند – فعلاً فقط احیای آلکین را در اینجا مورد بحث قرار می دهیم، اما کاهش آلکین توسط سدیم منجر به شکستن پیوند دوگانه CC و تشکیل آنیون در مجاورت یک رادیکال می شود. رادیکالی که تشکیل می شود می تواند بین فرم سیس و ترانس خود تبدیل شود، اما ترانس به طور کلی به دلیل عوامل فضایی پایدارتر است. سپس آنیون توسط NH پروتونه می شود3 (تنها اسید موجود در محلول) برای ایجاد رادیکال وینیل، که سپس با یک معادل دوم Na کاهش می یابد تا آنیون دوم ایجاد شود. سپس (شما حدس زدید) سپس با پروتوناسیون با معادل دوم NH به آلکن تبدیل می شود.3. بنابراین فرآیند خالص یک ترانس آلکن و دو معادل NaNH می دهد2.
نکات زندگی واقعی. از آنجایی که فلز سدیم یک جامد است، بسیاری از واکنشهای آن وابسته به سطح هستند. این بدان معناست که زمانی که به جای تکه ها به صورت نوارها یا سیم های ریز بریده شود، به عنوان یک معرف مؤثرتر است. همانطور که می توانید تصور کنید، یک معرف که به شدت با آب واکنش می دهد به طور بالقوه بسیار خطرناک است. سدیم زمانی که برای حذف ردی از آب از حلالها در دستگاههای تقطیر استفاده میشود، بسیار خطرناک است: تکهها را میتوان با یک لایه سطحی از NaOH غیرفعال کرد و خراش دادن سطح ماده در حین خاموش کردن، فلز سدیم واکنشپذیر را در معرض دید قرار میدهد که میتواند به سرعت واکنش نشان دهد. عامل خاموش کننده، منجر به انفجار و آتش سوزی می شود. پتاسیم برای این کار حتی بدتر است. در گوگل عبارت “solvent still fire” را جستجو کنید، به این ایده خواهید رسید.
PS شما می توانید در مورد شیمی Na و بیش از 80 معرف دیگر در شیمی آلی در مقطع کارشناسی در «راهنمای معرف شیمی آلی» که در اینجا به صورت PDF قابل دانلود موجود است، بخوانید.. اپلیکیشن Reagents برای آیفون نیز موجود است، روی نماد زیر کلیک کنید!
![]()
(پیشرفته) مراجع و مطالعه بیشتر
- کاهش ترکیبات آلی توسط لیتیوم در آمین های با وزن مولکولی پایین. 11. استریوشیمی. کاهش شیمیایی یک پیوند دوگانه غیر پایانی جدا شده
رابرت ا. بنکسر، گزه اسکرولی و دیل و آی. سالو
مربا. شیمی. Soc. 1955، 77، 12، 3378-3379
DOI: 10.1002/ja01617a066
لیتیوم و آمین های با وزن مولکولی کم (متیل آمین، اتیلامین، ایزوپروپیلامین) نیز می توانند برای حل کردن احیای فلزی آلکین ها استفاده شوند. مزیت این است که این معرفها نسبت به سدیم/آمونیاک راحتتر کار میکنند. - واکنش های مربوط به انتقال الکترون V. کاهش استیلن های غیر کونژوگه
هربرت او. هاوس و ادیت اف. کینلوخ
مجله شیمی آلی 1974 39 (6)، 747-755
DOI: 10.1021/jo00920a002
بررسی توزیع محصول احیای فلزات آلکین های داخلی و انتهایی با استفاده از Na در HMPA-THF. - انحلال احیای فلزات استیلن: یک مطالعه محاسباتی
رابرت دامراور
مجله شیمی آلی 2006 71 (24)، 9165-9171
DOI: 10.1021/jo061583j
این یک بررسی محاسباتی با استفاده از DFT (تئوری تابعی چگالی) است که پایداری واسطههای پیشنهادی را در کاهش فلز در حال حل استیلن، هم در فاز گاز و هم با حلالپذیری صریح آمونیاک مطالعه میکند.
