طیفسنجی UV-Vis کربونیلها (پیوندهای C=O)
فهرست مطالب
- بررسی سریع UV-Vis
- پیوندهای C=O حداکثر جذب حدود 300 نانومتر را نشان می دهند
- این در واقع یک انتقال n-> pi* است، نه pi به pi* (!)
- صبر کن. چرا پی به پی* نمی آید؟
- کربونیل ها نیز در کونژوگاسیون شرکت می کنند
- خلاصه: طیف سنجی UV-Vis از کربونیل ها
- یادداشت
1. مروری سریع از آنچه تاکنون در مورد UV-Vis آموخته ایم
در ما آخرین پست ما نشان دادیم که مولکولهایی با پیوندهای CC pi (π) نور را در ناحیه مرئی UV جذب میکنند، که الکترونها را از اوربیتالهای π (پیوند) به اوربیتالهای π* (ضد پیوند) ارتقا میدهد.
ما آن را دیدیم
- انرژی مورد نیاز برای انتقال بیشتر به میزان آن بستگی دارد صرف (یعنی تعداد پیوندهای پی متوالی، تقریباً).
- یک آلکن با کم یا بدون صرف (به عنوان مثال اتن، CH2=CH2) دارای یک بزرگ است شکاف انرژی (ΔE) بین اوربیتال های باندینگ و ضد پیوند، که نیاز دارد پر انرژی تر فوتون های (طول موج کوتاه تر) برای تحریک. برای اتن، حداکثر جذب در حدود 170 نانومتر، در ناحیه UV رخ می دهد.
- با افزایش صیغه، شکاف انرژی ΔE کاهش می یابد، فشار دادن طول موج حداکثر جذب (λحداکثر) به سمت قابل رویت (فوتن های پرانرژی کمتر، طول موج بیشتر). به عنوان مثال، β-کاروتن (رنگدانه نارنجی موجود در هویج) با 11 پیوند پی مزدوج، جذب می شود (λ)حداکثر = 470 نانومتر).
از آنجایی که پست لعنتی طولانی بود، ما هرگز نتوانستیم به یک سوال کلیدی بپردازیم: آیا این در مورد سایر انواع پیوندهای pi نیز صدق می کند؟
به عنوان مثال، آیا پیوندهای C=O pi نور را در ناحیه UV/مرئی نیز جذب می کنند؟
- پاسخ کوتاه این است: آره.
- پاسخ متوسط این است: بله، اما انتقال اصلی مورد علاقه یک انتقال pi-pi* نیست – کمی متفاوت است.
پاسخ طولانی این است.. خب، در اینجا پاسخ طولانی است.
2. جذب پیوندهای C=O حداکثر 300 نانومتر را نشان می دهد
بیایید با یکی از ساده ترین ترکیبات با پیوند C=O شروع کنیم: 2-پروپانون، که در غیر این صورت به عنوان استون شناخته می شود.
سوال: آیا استون UV یا نور مرئی را جذب می کند؟
پاسخ: شما بچا. در اینجا طیف جذب UV-Vis برای 2-پروپانون (استون) آمده است.
[The key piece of information to glean from that spectrum is that there is an absorbance maximum at about 275 nm, in the ultraviolet.]
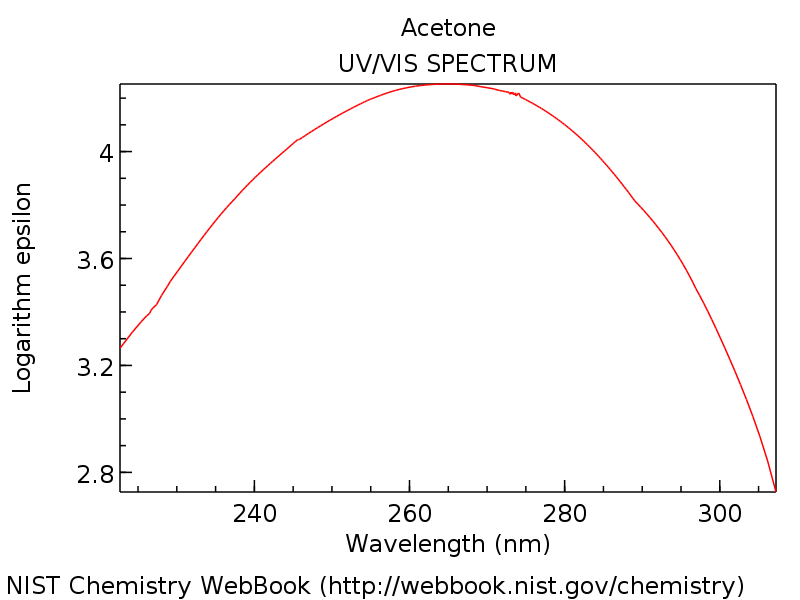
اگر حافظه حیرت آور خوبی دارید، ممکن است از آخرین پست (یا از مقدمه من در بالا) به یاد بیاورید که حداکثر جذب اتن (CH)2=CH2) حدود 170 نانومتر است.
جذب در حدود 275 نانومتر به این معنی است طول موج بیشتر و بنابراین کم انرژی فوتون برای این انتقال مورد نیاز است.
عجیب به نظر نمی رسد؟
در صورت وجود، پیوندهای C=O π هستند قوی تر از پیوندهای C=C π. [You can look it up]. آیا منطقاً انتظار ندارید که برای ارتقاء یک الکترون از پی (π) به پی* (π*) به انرژی *بیشتری* نیاز باشد؟
چه چیزی می دهد؟
اکنون: همانطور که یک دقیقه دیگر خواهیم دید، آنجا است انتقال پی به پی* (π→π*) برای استون در اشعه ماوراء بنفش، اما آن پیک در 275 نانومتر، انتقال پی به پی* نیست. این انتقال از یک اوربیتال غیر پیوندی (n) به اوربیتال پی* (n→π*) است.
3. گروه های کربونیل (C=O) تمایل به نشان دادن جذب ضعیف در (تقریبا) 300 نانومتر دارند که مربوط به انتقال بین اوربیتال های غیر پیوندی و اوربیتال های Pi* است.
متعجب? بیایید به یک رسم اوربیتال مولکولی ساده از استون نگاه کنیم.
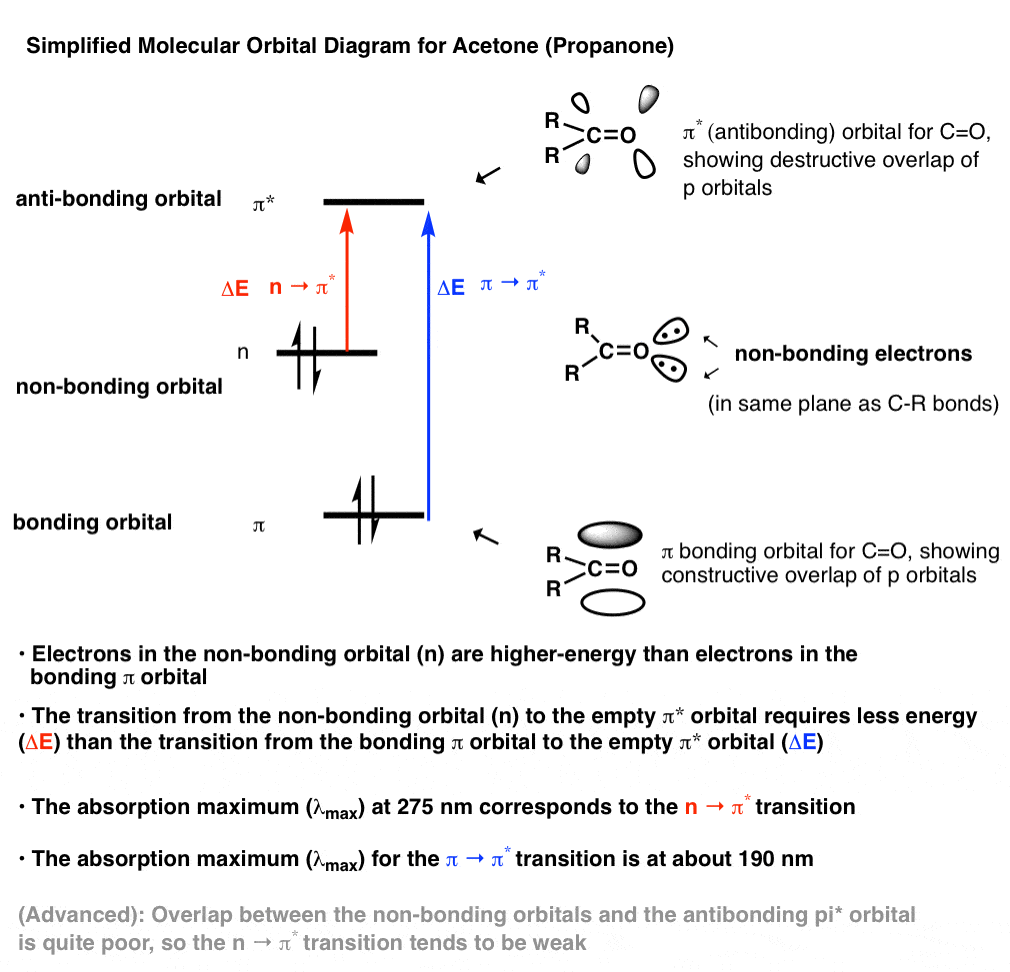
[This is a somewhat simplified picture. For a more detailed MO diagram for that also includes a more thorough discussion about the nature of the non-bonding orbitals, I highly recommend Reusch’s online textbook entry here. ]
چند نکته مهم قابل ذکر است:
- گروههای کربونیل حاوی الکترونهای غیرپیوندی هستند که در انرژی میانی مداری بین اوربیتال پیوندی پی و اوربیتال ضد پیوند پی* قرار دارند. این اوربیتال ها هستند غایب در آلکن های معمولی مانند اتیلن [CH2=CH2] [note 1]
- انتقال بین الکترونها در اوربیتال غیرپیوندی به اوربیتال pi* از نظر انرژی بالاتر، ΔE کوچکتری دارد و بنابراین در طول موجهای بلندتری جذب میشود.
- این انتقال (n→π*) است که مسئول پیک در حدود 275 نانومتر است.
4. در مورد انتقال Pi به Pi* برای C=O چطور؟
پس در مورد انتقال پی به پی* چطور؟ این هم نمی شود؟
خوشحالم که پرسیدی اگر نگاهی گذرا به طیف جذبی استون UV-Vis در بالا بیندازید، متوجه خواهید شد که محور X حدود 240 نانومتر یا بیشتر قطع میشود. دلیلی برای آن وجود دارد (mwah-ah-ah).
اگر بزرگنمایی کنید، خواهید دید که انتقال بسیار قوی تری در حدود 190 نانومتر وجود دارد. [I went looking for a decent full-size UV spectrum of acetone, and the diagram below is the best I could find. I didn’t make this image and it is not my intellectual property. I found it here. ]
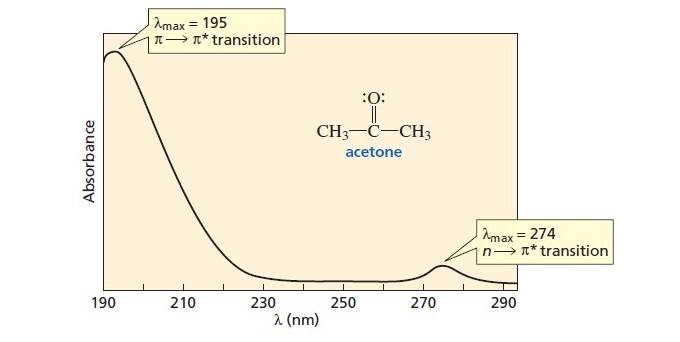
بنابراین همانطور که مشخص شد، آن “قله” در 275 نانومتر (n→π*) که ما به آن نگاه می کردیم، معلوم شد که یک مولوهیل، در کنار (π→π*) کوه در حدود 195 نانومتر در UV عمیق تر.
به عبارت دیگر، انتقال (n→π*) در 275 نانومتر که ما زمان زیادی را صرف صحبت در مورد آن کرده ایم، خیلی ضعیف نسبت به انتقال (π→π*). [sometimes a term called “epsilon, ε” is used to denote this difference in magnitude of absorption].
چرا ممکن است؟ این مربوط به تفاوت در همپوشانی مداری. برای انتقال یک الکترون از یک اوربیتال به اوربیتال دیگر، دو شرط باید رعایت شود.
- اول، همانطور که قبلاً بحث شد، اوربیتال باید با یک فوتون با انرژی مناسب ΔE تعامل داشته باشد.
- دوم، باید قابل توجه باشد همپوشانی بین اوربیتال ها در فضا ما معمولاً در مورد انتقال (π→π*) و (σ→σ*) بحث نمی کنیم زیرا هر جفت اوربیتال پیوندی و ضد پیوندی همان ناحیه از فضا را اشغال می کند. اگر به نمودار مکان اوربیتال های n در استون در مقایسه با محل اوربیتال های pi* نگاه کنید، ممکن است متوجه شوید که آنها اساساً در زوایای قائمه نسبت به یکدیگر. همپوشانی اوربیتال ضعیف به این معنی است که حتی اگر الکترون انرژی ΔE کافی برای انجام گذار داشته باشد، انتقال به طور قابل توجهی کمتر اتفاق می افتد زیرا الکترون برانگیخته شده کمتر منطقه ای از فضای مربوط به اوربیتال با انرژی بالاتر را اشغال می کند. [Extra detail: you might recall that orbitals are 3-dimensional volumes where the probability of encountering an electron is 95%. Therefore, there is some electron density outside of the volumes we typically consider “orbitals”]
5. کربونیل ها نیز در کونژوگاسیون شرکت می کنند
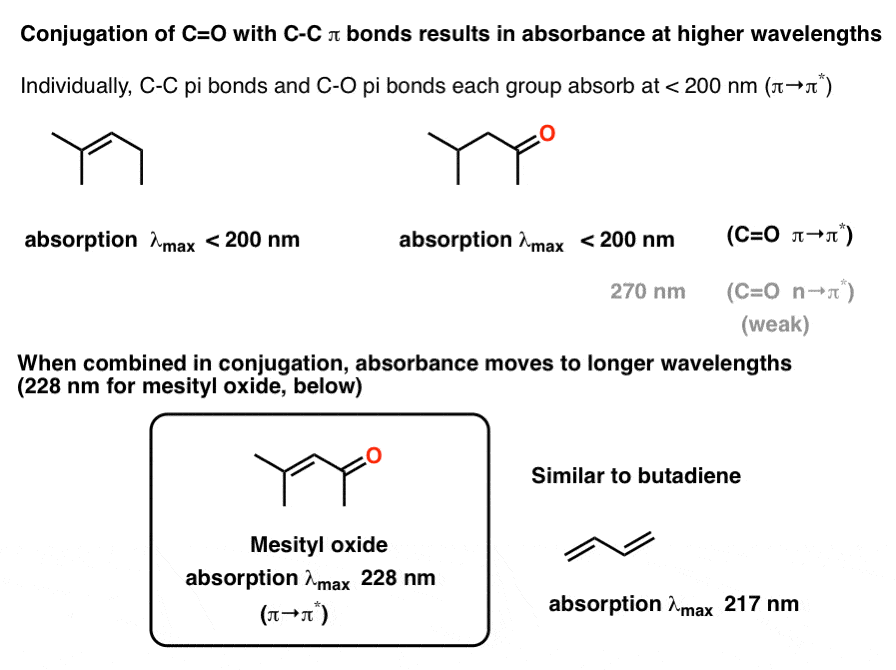
کربونیل ها همچنین می توانند در کونژوگه با پیوندهای CC pi شرکت کنند. این منجر به افزایش λ کلی می شودحداکثر از مولکول به عنوان مثال، جذب آلکن 2-متیل پنت-2-ان زیر 200 نانومتر است، همانطور که جذب π→π* 4-متیل پنتان-2-ان (زیر) است.
در اکسید مزیتیل، جایی که گروه آلکن و C=O در کنار یکدیگر قرار دارند، حداکثر جذب به طول موج طولانیتر در 228 نانومتر میرود. این مشابه تفاوت بین جذب اتن (174 نانومتر) و بوتادین (217 نانومتر) است.
[Additional note] حداکثر جذب می تواند به هویت حلال و همچنین هویت جانشین های روی آلکن حساس باشد. برای کربونیل ها، معمولا حلال های قطبی بیشتر منجر به λ بالاتر می شودحداکثر مقادیر، مانند حضور جانشین ها (مانند گروه های متیل) روی آلکن.
6. خلاصه: UV-Vis Spectroscopy Of Carbonyls
جذب در همسایگی ناهموار 270-300 نانومتر برای مولکول های حاوی گروه C=O (مانند کتون ها و آلدئیدها) رایج است و این مطابق با (n→π*) است. انتقال
این جذب ها نسبت به انتقال (π→π*) ضعیف هستند. با این حال، مشاهده این جذب می تواند یک سرنخ مهم در تعیین ساختار ترکیبات ناشناخته باشد.
در پست بعدی ما به جزئیات عملی استفاده از UV-Vis در تعیین ساختار خواهیم پرداخت.
[Again, for a more in depth look on the subject of C=O absorbance, go to Reusch. We’re really skimming the surface here, but it is enough for our purposes.]
یادداشت
موضوع جایزه: رنگ های آزو
از آنجایی که ما در مورد این موضوع هستیم، اجازه دهید به طور خلاصه سیستم دیگری را بررسی کنیم که در آن هر دو انتقال n→π* و π→π* مشاهده می شود: رنگهای آزو.
رنگهای آزو از آن دسته چیزهایی هستند که احتمالاً میلیونها بار بدون اطلاع دقیق آن را دیدهاید چی آن ها هستند.
مثلا رنگ زرد خط کشی بزرگراه ها؟ این رنگدانه زرد 10 است.

رنگهای آزو معمولاً در رنگآمیزی منسوجات، پلاستیکها و بسیاری از موادی که برای مصرف انسان در نظر گرفته نشدهاند استفاده میشوند (به طور کلی به عنوان افزودنیهای غذایی ممنوع هستند).
ویژگی ساختاری کلیدی یک ترکیب آزو یک پیوند N=N است. یکی از ساده ترین ترکیبات آزو آزوبنزن است که در آن هر نیتروژن به یک حلقه معطر متصل است. تغییرات جزئی در حلقه بنزن می تواند به طور چشمگیری رنگ مولکول را تغییر دهد. زرد آنیلین که در سال 1861 کشف شد، اولین ترکیب آزو بود که به عنوان رنگ مورد استفاده تجاری قرار گرفت و مشتقات بیشماری از آزوبنزن از آن زمان تاکنون سنتز شدهاند. [The synthesis is via diazo coupling – we won’t get into that here].
در اینجا طیف UV-Vis زرد آنیلین است که توسط ChemTube 3D محاسبه شده است.
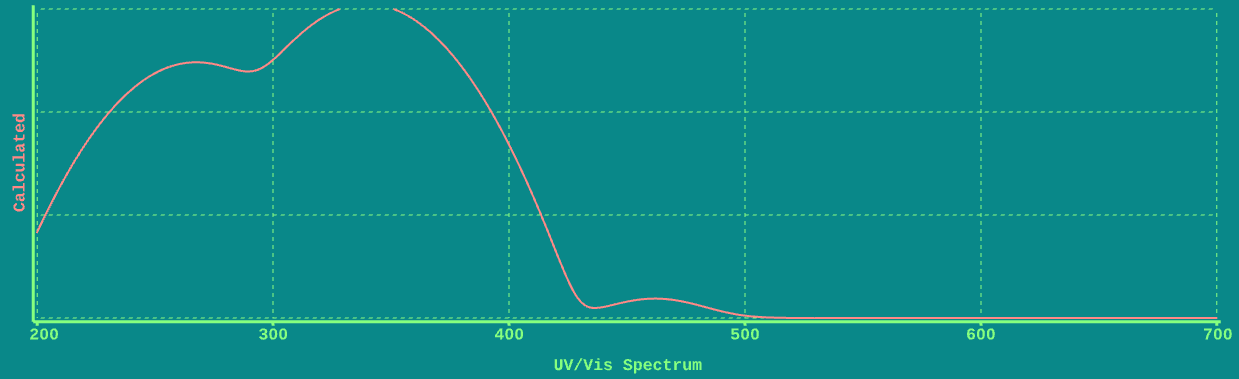
توجه داشته باشید که چگونه است از نظر کیفی مشابه استون: جذب قوی در سمت چپ (به سمت UV) و جذب ضعیف در سمت راست (به سمت قابل مشاهده).
با این حال، برخلاف استون، که در آن جذب ضعیف در 260 نانومتر است، جذب ضعیف در زرد آنیلین در ناحیه مرئی طیف در حدود 460 نانومتر است. این جذب در 460 نانومتر است که مسئول رنگ زرد آنیلین است.
بر اساس قیاس با استون، انتقال ضعیف یک انتقال (n→π*) و انتقال قوی در حدود 360 نانومتر یک انتقال π→π* است.
فوتوایزومریزاسیون
نکته جالبتر در مورد آزوبنزنها و مشتقات آنها (به عنوان مثال زرد آنیلین) پدیده فوتوایزومریزاسیون، که در آن جذب فرکانس های خاص نور می تواند منجر به ایزومریزاسیون شود ترانس ایزومرها به سیس ایزومرها و بالعکس
جذب نور UV توسط ترانس-آزوبنزن (یک انتقال π→π*) منجر به ایزومریزاسیون به سیس-آزوبنزن برعکس، جذب نور مرئی (نور آبی) توسط سیس-آزوبنزن (انتقال n→π*) منجر به تبدیل مجدد به ترانس-ایزومر [so does leaving cis-azobenzene in the dark, a process known as thermal relaxation]. مکانیسم این فرآیند هنوز به طور کامل حل نشده است.
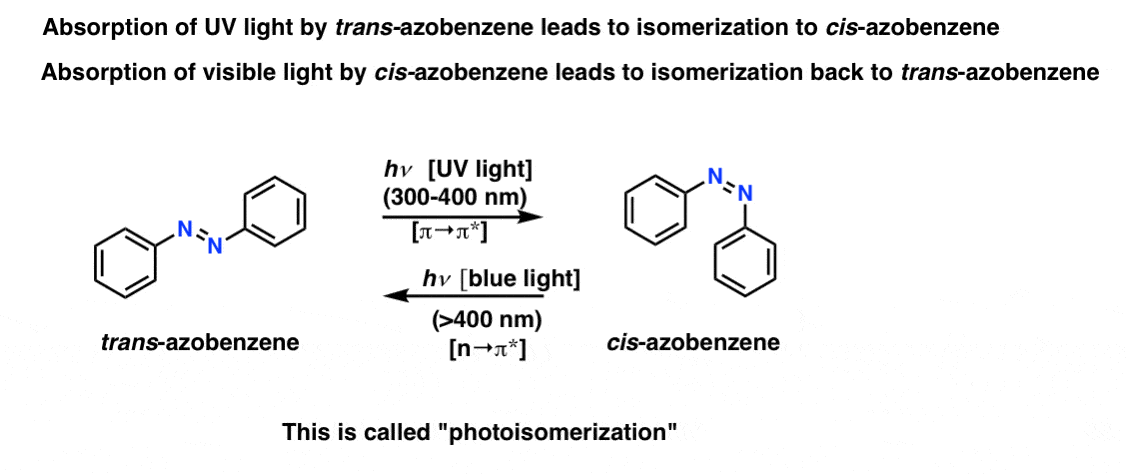
کاملاً منظم است که می توانید فقط با تغییر فرکانس نور یک ایزومر خاص را هدف قرار دهید. [note 2]
[note 1] لازم به ذکر است که اوربیتال های غیر پیوندی هستند در گونههایی مانند کاتیون آلیل، آنیون آلیل و سایر یونهای سیستمهای pi با عدد فرد وجود دارد.
[note 2] کشف این فرآیند به کاربردهای جالبی منجر شده است. من یک گروه تحقیقاتی را می شناسم که مجموعه ای از پلیمرهای آزو را می ساخت که می توانستند روی اسلایدهای شیشه ای روکش شوند. استفاده از لیزر UV بر روی سطح منجر به تشکیل یک توری پراش شد که تا زمانی که با لیزر آبی پاک شود یا از طریق حرارت دادن پلیمر به دمای انتقال شیشهای آن، دائمی بود. دپارتمان تحقیقات نیروی دریایی به آنها کمک مالی کرد تا کامپیوترهای نوری بسازند که در صورت خرابی سیستم خود را پاک کنند (مثلاً هواپیمای جنگی بر فراز قلمرو دشمن سرنگون شود و غیره).
