اگر در دوره معمول دانشگاه هستید، به احتمال زیاد در حال حاضر از Org II استفاده می کنید. همانطور که در حال حاضر به خوبی می دانید [more aware than you wish you were, I can hear some of you say] یکی از کانون های اصلی Org II در بسیاری از جنبه های مختلف شیمی کربونیل است. در ادامه پست قبلی، در اینجا پنج نکته مهم دیگر وجود دارد که باید هنگام مطالعه شیمی این گونه ها در نظر داشته باشید. [Note – these will be included in the second carbonyl summary sheet, currently in preparation]. بدون ADO بیشتر…
6. کربونیل ها گروه های آلکیل مجاور را اسیدی تر می کنند.
چقدر اسیدی تر؟ اتان را در نظر بگیرید. برای تمام اهداف عملی، اتان نسبت به باز بیاثر است: pKa هیدروژنهای آن 50 است. اما وقتی یکی از پروتونهای اتان را با یک گروه کربونیل (مثلاً -COOCH3) مبادله میکنید، اتفاق خارقالعادهای رخ میدهد. اسیدیته با ضریب 10^25 تغییر می کند. این یک عدد باورنکردنی است که می توانید سر خود را به اطراف بپیچید. تفاوت در واکنش شیمیایی بین گونه های مختلف می تواند باشد فوق العاده، به طرز شگفت انگیزی وسیع ما در اینجا در مورد تفاوت توانایی کوارتربک بین پیتون منینگ و دن مارینو، یا حتی مجموعه مهارت های بسکتبال مقایسه ای لبرون جیمز و ورن ترویر صحبت نمی کنیم. تفاوت در واکنش* واقعاً کیهانی است: مانند مقایسه عرض بازو شما با طول کهکشان راه شیری.
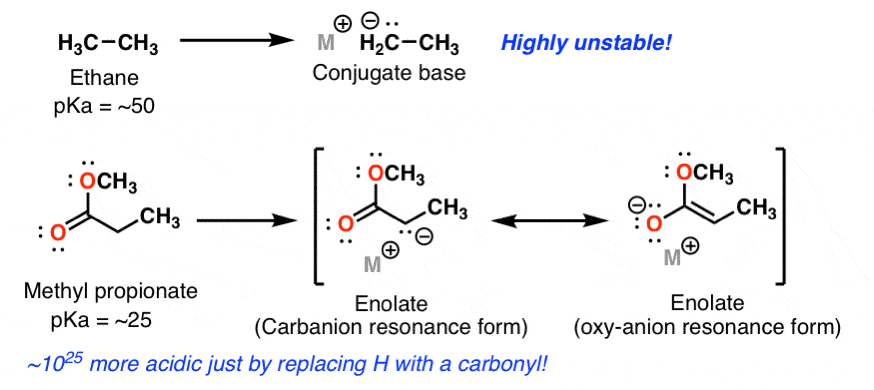
اینجا چه خبره؟ به بیان ساده، سیستم π کربونیل یک «سینک» برای کربانیون برای اهدای چگالی الکترون فراهم میکند و بار منفی بین آلفا کربن و اکسیژن کربونیل ایجاد میکند. ویژگی اصلی ساختاری آنقدر رزونانس نیست، اگرچه این یک عامل است – [the lower pKa of propene (42) is a good example of resonance stabilization] دلیل اینکه کربونیل تا این حد کاربانیون را تثبیت می کند این است بار منفی روی یک اتم الکترونگاتیو تر (اکسیژن) موضعی می شود.، که بهتر می تواند بار منفی را تثبیت کند.
*فقط برای روشن شدن: واکنش پذیری = موقعیت تعادل، بین اسید و باز مزدوج – نه انرژی های نسبی. برای بدست آوردن انرژی های نسبی، باید ΔG = –RT(lnK) را برای هر کدام حل کنید و مقایسه کنید.
7. هرچه کربونیل الکتروفیل تر باشد، آلفا پروتون اسیدی تر است.
تثبیت ایجاد شده توسط گروه کربونیل به میزان فقیر بودن آن از الکترون بستگی دارد. قرار دادن یک گروه بسیار الکترونگاتیو مانند CF3 در مجاورت کربونیل، کربونیل را بسیار الکتروفیلتر می کند، که باعث می شود بهتر بتواند بار منفی را تثبیت کند. از سوی دیگر، کربونیل ها با گروه های الکترون دهنده متصل (مانند آمیدها) بار منفی را تقریباً ثابت نکنید. این به معنی کاهش اسیدیته پروتون آلفا است.
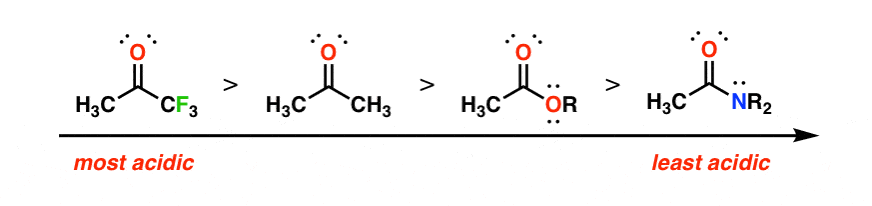
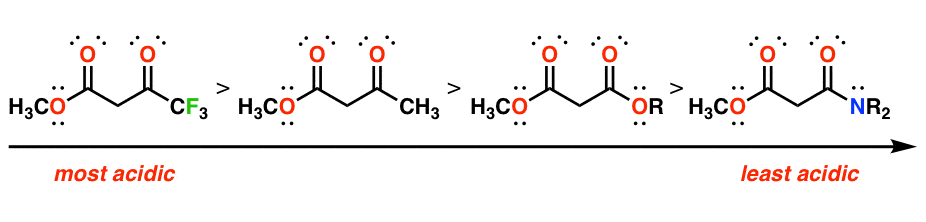
به هر حال، این اثرات افزایشی هستند. با در نظر گرفتن این اصل، باید بتوانید ترکیبات دی کربونیل زیر را بر اساس اسیدیته رتبه بندی کنید.
8. کربونیل ها همچنین آلکن ها را برای حمله هسته دوست فعال می کنند.
اتن (اتیلن) به خوبی با الکتروفیل هایی مانند Br2 و mCPBA واکنش می دهد، اما وقتی با یک هسته دوست مانند دی اتیلامین ترکیب می شود، هیچ واکنشی رخ نمی دهد. این در حالی است که واکنش واقعاً از نظر ترمودینامیکی مطلوب خواهد بود: شما یک باند CC π و یک باند تک NH را برای یک باند جدید CH و یک باند تک CN معامله میکنید. دلیل این عدم واکنش پذیری، درست همانطور که برای شماره 6 بود، این است کربنیون حاصل از حمله هسته دوست بسیار ناپایدار است.
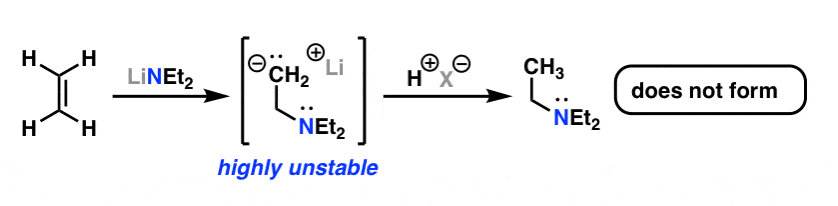
با این حال، یک هیدروژن را با یک مشتق کربونیل جایگزین کنید، و ناگهان آلکن بسیار شاداب تر می شود. باز هم دلیل آن توانایی گروه کربونیل الکتروفیل در تثبیت بار منفی تازه تولید شده است. محصول فوری افزودن مزدوج یک انولات است، بسته به شرایط واکنش می تواند به سرعت پروتونه شود. نکته کلیدی این است که کربونیل واسطه واکنش را تثبیت می کند، که به آن اجازه ادامه می دهد.
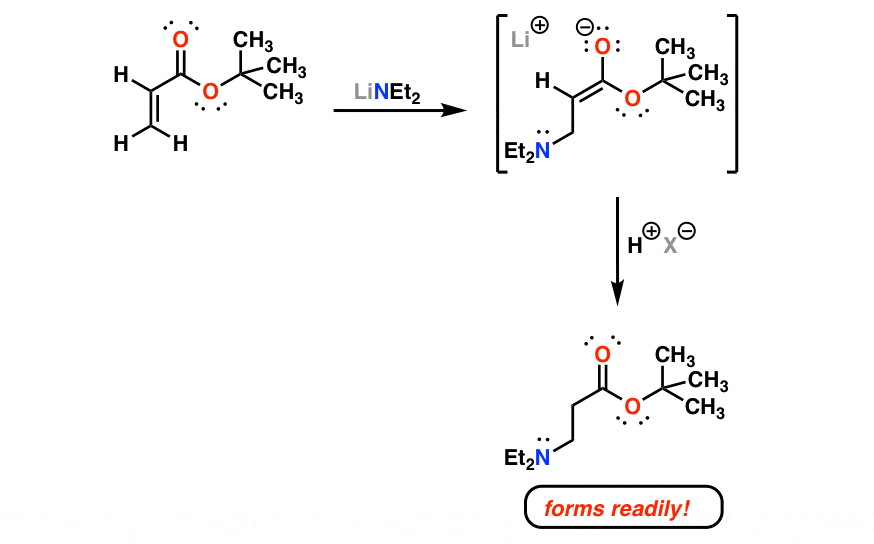
9. واکنش پذیری یک کربونیل غیراشباع α، β با پایداری انولات آن متناسب است.
فرض کنید از شما خواسته میشود که واکنشپذیری مشتقات کربونیل غیراشباع α،β را نسبت به هستهدوستها رتبهبندی کنید:
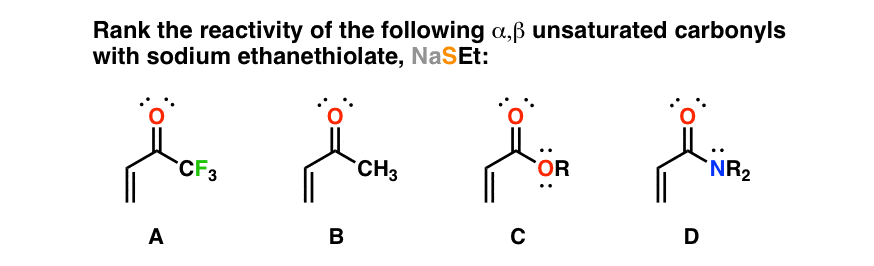
با دانستن توانایی اهدای نسبی هر جایگزین در کربونیل (به عنوان مثال NEt2 > OEt > CH3 > CF3) تو می توانی رتبه بندی پایداری انولات هایی که تولید خواهند شد از طریق جمع مزدوج از آنجایی که افزودن هسته دوست مرحله محدود کننده سرعت این واکنش است، بنابراین نرخ نسبی اضافه را خواهید دانست.
تقاطع بین کربونیل های غیراشباع α، β و انولات ها منجر به انواع اکتشافات نوآورانه در شیمی شده است. [Not on the exam: The Baylis-Hillman reaction].
فقط به یاد داشته باشید: علاوه بر کربونیل غیراشباع α، β، یک ماده واسطه انولات به شما می دهد.
[FYI, there is another, subtle effect with α,β-unsaturated carbonyls that I don’t have time to get into right now: the gamma protons are acidic. ]
10. انولات ها نوکلئوفیل هستند.
آنها بارها و بارها در واکنش ها ظاهر می شوند. با درک ثبات نسبی آنها، واکنش نسبی آنها را نیز درک می کنید.
معلم سال سوم شیمی آلی من، پروفسور سارک، از ما خواسته بود که در کلاس، به عنوان گروه، چندین بار در یک درس، مطالب زیر را با صدای بلند بگوییم، تا اینکه در نهایت این واقعیت را در ذهنمان آشکار کردیم:
“انولات یک نوکلئوفیل است”
اگر در حال مطالعه Org II هستید، امیدواریم که 3 یا 4 نمونه را در بالای سر خود در نظر بگیرید که در آن انولات را می بینید… که به الکتروفیل های مختلف اضافه می کند.
– واکنش آلدول
– تراکم کلایزن
– واکنش مایکل
– الکیلاسیون انولات
در مورد واکنش نسبی چطور؟ ترتیب اسیدیته کربونیل α-پروتون را به یاد بیاورید:
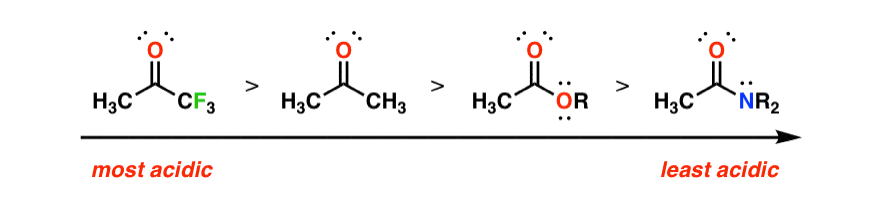
واکنش پذیری یک هسته دوست با پایداری آن نسبت معکوس دارد. منطقی است، درست است؟ هرچه تثبیت آن کمتر باشد، باید واکنش پذیرتر باشد. راه دیگری برای قرار دادن آن: هر چه pKa ترکیب کربونیل بالاتر باشد، انولات حاصل واکنش پذیرتر خواهد بود.
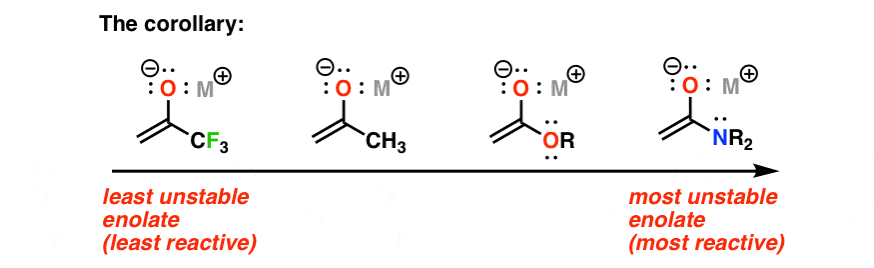
بلند بگو، با افتخار بگو: انولات یک هسته دوست است.
