پس از گردآوری برگه خلاصه هفته گذشته در مورد واکنشهای افزودن به کربونیلها، فکر کردم که برجسته کردن برخی از نکات کلیدی مفید باشد.
1. بین pKa و توانایی ترک گروه همبستگی مستقیم وجود دارد. هرچه پایه ضعیف تر باشد، گروه ترک بهتر است.
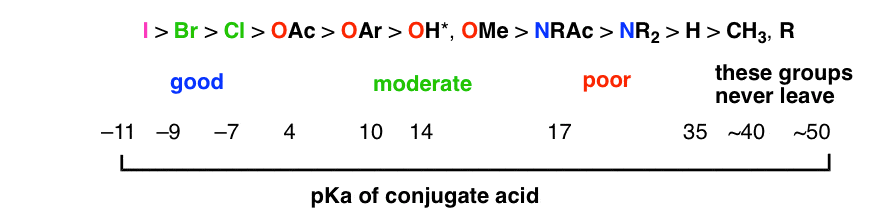
یک پایه قوی تر هرگز با یک پایه ضعیف تر از کربونیل جابجا نمی شود. برای اهداف عملی، اگر گروه های هیدرید یا آلکیل را به عنوان گروه های ترک رسم می کنید، کار اشتباهی انجام می دهید.
هیدروکسید در شرایط اولیه یک گروه ترک وحشتناک است زیرا کربوکسیلیک اسید به راحتی پروتونه می شود و O- را می دهد. بنابراین، گروه ترک باید O2- باشد، که همانطور که احتمالاً می توانید تصور کنید (دو پایه بودن) یک گروه ترک بسیار بد است.
توجه داشته باشید که هیدرولیز اسیدی وضعیت متفاوتی دارد، زیرا پروتوناسیون منجر به ایجاد یک گروه ترک بسیار پایدارتر (اسید مزدوج) می شود که می تواند توسط هسته دوست های نسبتا ضعیف (مثلا آب) جابجا شود. به عنوان مثال، آب یک گروه خروجی بهتر از HO- با ضریب ~10^16 است! [pKa of H3O+ is -1.7 ; pKa of H2O is ~15]
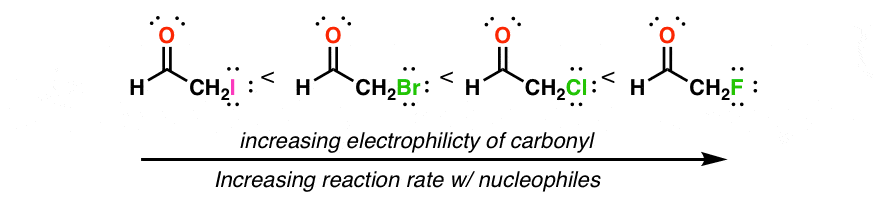
2. گروه های عاملی خارج کننده الکترون، واکنش پذیری کربونیل های مجاور را با هسته دوست ها افزایش می دهند (یعنی آن را الکتروفیل تر می کنند).
در اینجا یک مثال رایج است:
3. اهداکنندگان پی نزول کردن واکنش کربونیل های مجاور با هسته دوست ها (یعنی آن را کمتر الکتروفیل می کند).
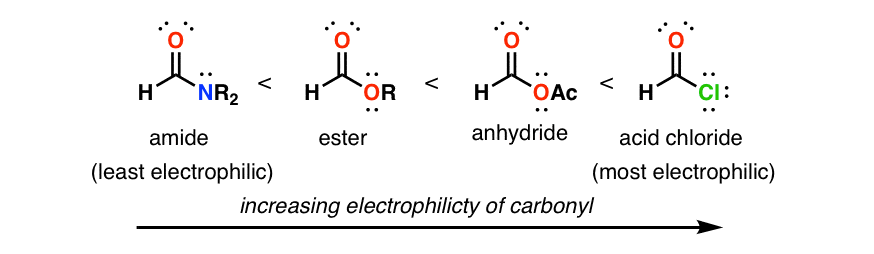
درست مانند آروماتیک ها و آلکن ها، کربونیل ها می توانند الکترون ها را از اتم های دارای جفت های تک موجود به سیستم پی خود بپذیرند. الکتروفیل غنیتر از الکترون، الکتروفیل فقیرتری است. همانند جایگزینی الکتوفیلیک آروماتیک، توانایی اهدای پی دارای یک است خیلی بزرگتر تاثیر نسبت به اثر گیرنده سیگما غیرفعال کننده گروه های عاملی الکترونگاتیو N و O. این نمودار کوچک باید آشنا به نظر برسد:

جایگزینهای گروه A (دانندههای pi) حمله هستهدوست به کربن کربونیل متناسب با توانایی اهدایی آنها را کند میکنند. جانشینهای گروه B اثر میانی دارند، در حالی که جانشینهای گروه C به شدت کربن کربونیل را برای حمله فعال میکنند.
4. برای مکانیسم: مشتقات کربوکسیلیک اسید همیشه ابتدا روی کربونیل پروتونه می شوند.
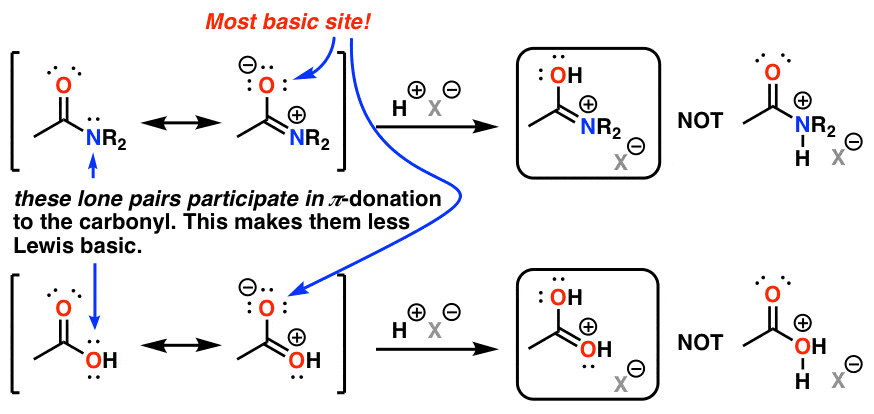
برای مثال، با آمیدها، وسوسه انگیز است که ابتدا نیتروژن را پروتونه کنید، زیرا می دانید که این گروهی است که در نهایت می رود. با این حال، این واقعیت که جفت تنها نیتروژن به کربونیل اهدا می شود به این معنی است که شکل رزونانس سمت راست (با کربونیل آنیونی) بیشتر پایه لوئیس است. ابتدا اکسیژن کربونیل را پروتون کنید، سپس هسته دوست را به کربن کربونیل اضافه کنید.
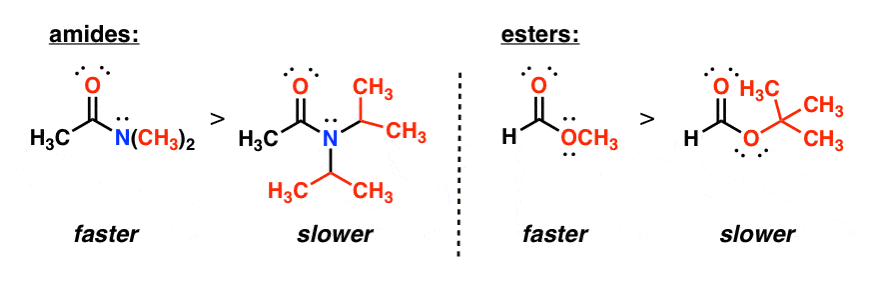
5. افزایش حجم فضایی در اطراف یک کربونیل، واکنش با هسته دوست ها را کند می کند. این سری از آلدئیدها/کتون ها را در نظر بگیرید:
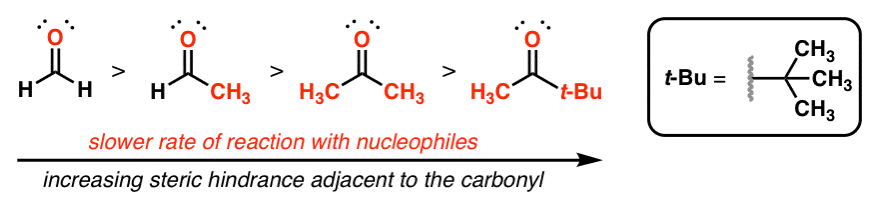
هر چه گروه حجیم تر باشد، واکنش کندتر خواهد بود. دلیل آن این است که هسته دوست با پی* کربونیل واکنش می دهد و ابر الکترونی گروه های حجیم مانع از حمله هسته دوست می شود. کاهش مشابهی در واکنشپذیری زمانی اتفاق میافتد که حجم فضایی آلکیل هالید اولیه را در واکنش SN2 افزایش دهید.
به هر حال زاویه حمله حدود 105 درجه است که به مسیر Burgi Dunitz معروف است. این را برای پروفسور یا TA خود ذکر کنید و چشمان آنها باید با هیبت روشن شود، زیرا شما برای یادگیری چیزی که قطعاً در امتحان نخواهد بود وقت گذاشتید. به هر حال، حجم فضایی اضافه شدن نوکلئوفیل ها به آمیدها و استرها را نیز کند می کند: