چند هفته پیش جرمی در وبلاگ شیمی پستی به نام «مشکلات رایج دانشآموزان در شیمی آلی» نوشت. از آنجایی که در آن زمان برای تعطیلات به خانه پرواز می کردم، بحث را از دست دادم، اما در بخش نظرات اشاره ای به مقاله اخیر جوزف جی. مولینز از کالج Le Moyne در سیراکوز نیویورک به نام “شش ستون شیمی آلی” وجود داشت. ” [J Chem Ed, 2008, p. 83 – behind a paywall, but most academic institutions will have it].
با تعبیر کلمات نویسندگان، “شش ستون” برای نشان دادن تمام مفاهیم مورد نیاز برای شیمی آلی یا تعریف دقیق مفاهیمی که قرار است گنجانده شوند، نیستند، بلکه در عوض چارچوبی را ارائه می دهند. “شش ستون” پروفسور مولینز به شرح زیر است:
- الکترونگاتیوی – در مثال ارائه شده، عبور از یک دوره منجر به کاهش هسته دوستی با افزایش الکترونگاتیوی می شود. برای مثال، هسته دوستی به ترتیب زیر است:
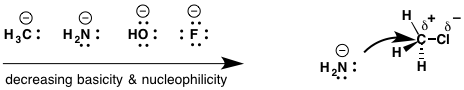
- پیوند کووالانسی قطبی – هنگامی که پیوندهایی بین اتم های الکترونگاتیوی نابرابر تشکیل می شود، دوقطبی حاصل دارای یک پایانه بار مثبت و یک پایانه بار منفی است که بینشی در مورد حالت ترجیحی واکنش شیمیایی آن ارائه می دهد. بنابراین در مثال بالا، پیوند C-Cl قطبی شده است در حالی که پیوندهای CH (C و H دارای الکترونگاتیوهای نسبتاً مشابهی هستند) اینطور نیستند، که منجر به شکستگی انتخابی پیوند کربن – هالوژن در طول SN2 به جای پیوندهای کربن – هیدروژن می شود.
- اثرات استریک – میزان SN2 تا حد زیادی تحت تأثیر حضور گروه های حجیم همسایه است. بنابراین روند واکنش فوق به این صورت خواهد بود:

- اثرات القایی نویسنده قانون مارکوفنیکوف را به عنوان نمونه ای از اثرات القایی مثال می زند که در آن افزایش جایگزینی روی کربن منجر به افزایش تثبیت القایی کربوکاتیون می شود. [he also notes that hyperconjugation, a more fundamentally sound explanation, can be covered in the resonance section, below].
- رزونانس – اثرات تشدید در شیمی آلی گسترده است. یک مثال این است که آنها برماسیون انتخابی سیکلوهگزن را در موقعیت آللیک تحت شرایط رادیکال آزاد، در مقابل برماسیون رقابتی در موقعیت ثانویه (یا وینیل) توضیح می دهند. مثال دیگر مسطح بودن پیوندهای پپتیدی به دلیل اهدای π الکترون به اوربیتال کربونیل π* است.
- معطر بودن – معطر بودن یک نیروی محرکه مهم در واکنش های شیمیایی و تأثیر تثبیت کننده قوی بر روی مولکول ها است. کاهش واکنشپذیری بنزن در واکنشهای برماسیون در مقابل، مثلاً، سیکلوهگزن، گسترش تثبیت رزونانس است، که به توضیح اینکه چرا تریپتوفان یک اسید آمینه پایه در نظر گرفته نمیشود، حتی اگر (مانند لیزین) حاوی نیتروژن است – در تریپتوفان، تنها نیتروژن است، کمک میکند. جفت در سیستم π گره خورده است.
من واقعا از فکر کردن به این چیزها لذت می برم. به طور کلی فکر میکنم ایجاد چارچوبی که شیمی آلی را در مجموعه کوتاهی از اصول مفید خلاصه میکند، بسیار مفید است. این اساساً هدف این سایت است. من فکر می کنم مجموعه ایده آل تا حدی به مخاطبان استاد از دانشجویان بستگی دارد. در برخی از دوره های کارشناسی شیمی آلی (به ویژه کالج های محلی) نیمه اول شامل درس هایی در مورد ساختار شیمیایی و واکنش پذیری است که با دوز قوی بیوشیمی همراه است. من مطمئن نیستم، اما فکر می کنم این همان دوره ای است که پروفسور مولینز تدریس می کند. در مدارسی که بیشتر پژوهش محور هستند، جایی که نیمه دوم دوره اساساً مجموعهای سریع از معرفها و دگرگونیهای جدید است، دانشآموزان برای نوشیدن از یک شلنگ آتشنشانی دچار مشکل میشوند. احتمالاً در این شرایط استفاده از اصولی که به طور واضح تری به درک نیروهای محرکه اکثر واکنش ها در شیمی آلی کمک می کند مفیدتر باشد. برای مثال، «هستهدوستها به الکتروفیل حمله میکنند»، روشی بسیار سادهکننده برای مشاهده واکنشهای شیمیایی است و شناخت الگوهای جریان الکترون به جلوگیری از اتکای بیش از حد به حفظ کردن کمک میکند.
به نظر من بهترین نقل قول مقاله زیر است:
“بنابراین عاقلانه است که هنگام آموزش به آزمودنی به یاد داشته باشید که به طور صریح به اصول اساسی اشاره کنید و فرض نکنید که یادگیرندگان نیروهای فیزیکی را تشخیص می دهند.”
بینگو. من این اشتباه را می کنم همیشه. توصیه حکیم.
برای مربیانی که این را می خوانند: «شش ستون» شما چه خواهد بود؟
