شروع، انتشار و خاتمه در واکنش های رادیکال آزاد
در پست قبلی در مورد واکنش های جایگزینی رادیکال آزاد، در مورد اینکه چرا گرما یا نور در واکنش های رادیکال آزاد مورد نیاز است صحبت کردیم. در این پست قصد داریم مکانیسم واکنش جایگزینی رادیکال آزاد را بررسی کنیم که دارای سه مرحله کلیدی است: شروع، انتشار و خاتمه.
فهرست مطالب
- مکانیسم جایگزینی رادیکال آزاد یک آلکان با کلر2
- مرحله ای که در آن افزایش خالص در تعداد رادیکال های آزاد وجود دارد، “شروع” نامیده می شود.
- مرحله ای که در آن هیچ سود خالص یا از دست دادن رادیکال های آزاد وجود ندارد، “تکثیر” نامیده می شود.
- مراقب این اشتباه رایج در بیرون کشیدن مکانیسم های رادیکال آزاد باشید
- دو مرحله انتشار در هالوژناسیون رادیکال آزاد آلکان ها وجود دارد
- مرحله ای که در آن کاهش خالص رادیکال های آزاد وجود دارد، “خاتمه” نامیده می شود.
- مکانیسم کامل جایگزینی رادیکال آزاد یک آلکان
- خلاصه: واکنش های جایگزینی رادیکال آزاد
- یادداشت
- (پیشرفته) مراجع و مطالعه بیشتر
1. مکانیسم جایگزینی رادیکال آزاد یک آلکان با کلر2
ممکن است به یاد داشته باشید که این واکنش را در پست قبلی مشاهده کرده اید – این کلرزنی رادیکال آزاد متان با کلر است.2.
این جایگزینی برای کربن است زیرا یک پیوند CH می شکند و یک پیوند C-Cl جدید تشکیل می شود. محصول جانبی HCl است.
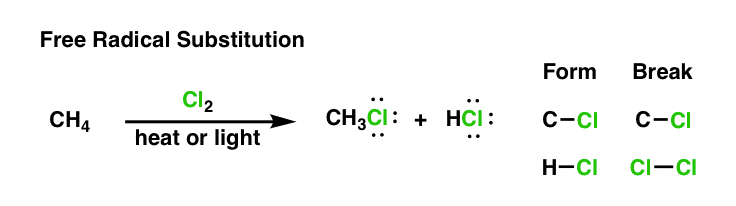
اکنون که کمی بیشتر در مورد چیستی رادیکالهای آزاد و خواص کلیدی آنها میدانیم، امروز پاسخ خواهیم داد:این واکنش چگونه کار می کند؟“.
ما مراحل کلیدی این واکنش را طی می کنیم و یاد می گیریم که آنها از سه مرحله کلیدی تشکیل شده اند: شروع، خاتمه دادن، و تکثیر.
2. مرحله ای که در آن افزایش خالص در تعداد رادیکال های آزاد وجود دارد، “شروع” نامیده می شود.
واکنشهای رادیکال آزاد معمولاً برای اعمال گرما یا نور نیاز دارند. به این دلیل که هر یک از این منابع انرژی می تواند منجر به شکاف همولیتیک پیوندهای نسبتا ضعیف مانند Cl-Cl برای ایجاد رادیکال های آزاد شود. [i.e. Cl• ]
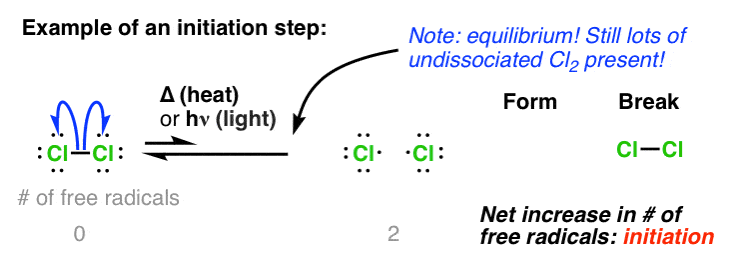
هر واکنش رادیکال آزاد با مرحله ای شروع می شود که در آن رادیکال های آزاد ایجاد می شوند و به همین دلیل این مرحله اولیه نامیده می شود شروع.
در اینجا معادله این مرحله شروع است. دو نکته قابل توجه:
- واکنش یک تعادل است – در هر زمان معین فقط غلظت کمی از رادیکال آزاد موجود است (اما همانطور که خواهیم دید این کافی خواهد بود)
- توجه داشته باشید که وجود دارد افزایش خالص رادیکال های آزاد در این واکنش ما از صفر (در واکنش دهنده ها) به دو (در محصولات).
3. مرحله ای که در آن هیچ سود خالص یا از دست دادن رادیکال های آزاد وجود ندارد، “تکثیر” نامیده می شود.
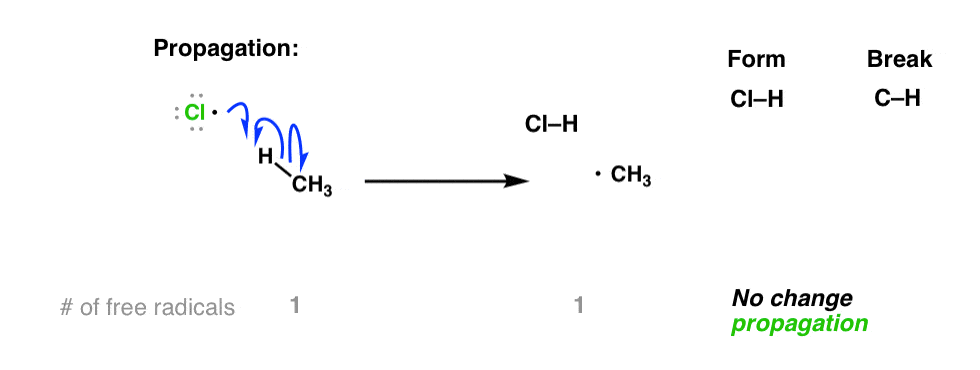
تنها زمانی که رادیکال های آزاد وجود دارند، بستر ما (CH4 در مثال ما) درگیر می شود. رادیکال های کلر بسیار واکنش پذیر هستند و می توانند با هیدروژن متان ترکیب شوند و رادیکال متیل را ایجاد کنند.3
اگر تعداد رادیکال های آزاد را در این معادله بشمارید، متوجه خواهید شد که یکی در واکنش دهنده ها و یکی در محصولات وجود دارد. بنابراین وجود دارد بدون افزایش خالص در تعداد رادیکال های آزاد.
به این نوع مرحله “تکثیر” گفته می شود.
اگر امتیاز را حفظ می کنید، تا این مرحله باید بتوانید ببینید که قبل از تکمیل واکنش ما فقط یک پیوند باقی مانده است. تنها کاری که باید انجام دهیم این است که یک پیوند C-Cl تشکیل دهیم.
4. مراقب این اشتباه رایج در بیرون کشیدن مکانیسم های رادیکال آزاد باشید
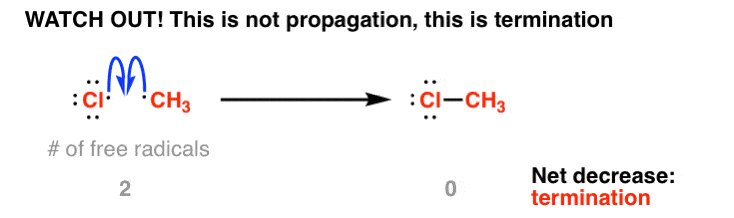
اینجاست که مرتکب شدن یک اشتباه کوچک آسان است. با دیدن اینکه دو رادیکال کلر در مرحله شروع تشکیل شده است، این کار را انجام می دهد به نظر می رسد طبیعی است که رادیکال متیل و رادیکال کلر را برای تشکیل CH گرد هم بیاورد3-کل. درست؟؟؟؟؟
نه !
به تعداد رادیکال های آزاد توجه کنید کاهش یافته اینجا، نه همینطور ماند نمی تواند تکثیر شود! (در واقع فسخ است که در یک دقیقه در مورد آن بحث خواهیم کرد).
5. دو مرحله انتشار در جایگزینی رادیکال آزاد وجود دارد
در واقع، ما میتوانیم مرحله «تکثیر» مناسب را به این ترتیب انجام دهیم: رادیکال متیل را بگیرید و با کلر واکنش نشان دهد.2 هنوز وجود دارد این به ما CH3Cl و رادیکال کلر می دهد. توجه داشته باشید که هیچ تغییر خالصی در تعداد رادیکالهای آزاد رخ نداده است، بنابراین این هنوز یک “تکثیر” است.
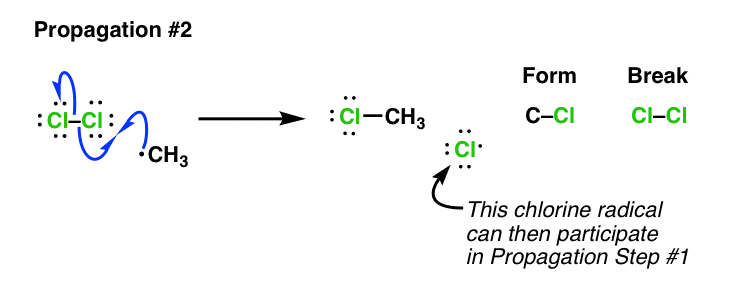
دوباره توجه کنید که ما در حال تشکیل یک رادیکال کلر هستیم! چه چیزی در این مورد بسیار مهم است؟ بسیار مهم است زیرا این رادیکال کلر می تواند مرحله 1 را روی یک مولکول جدید از بستر ما (CH) انجام دهد.4) ادامه روند این یک واکنش زنجیره ای – پس از تولید، رادیکال کلر است کاتالیزوری به همین دلیل است که برای ادامه این واکنش فقط به مقدار کمی رادیکال کلر نیاز داریم. برای 10 غیر معمول نیست4 یا بیشتر از این چرخه ها را قبل از پایان دادن ادامه دهید. [Ref]
6. مرحله ای که در آن کاهش خالص رادیکال های آزاد وجود دارد، “پایان” نامیده می شود.
آیا این واکنش زنجیره ای می تواند برای همیشه ادامه داشته باشد؟ خیر
بیایید به دو مورد محدود کننده فکر کنیم. اگر غلظت کلر2 نسبت به CH پایین است4 (به عبارت دیگر، Cl2 معرف محدود کننده ما است) سپس سرعت انتشار مرحله شماره 2 با کاهش غلظت آن کاهش می یابد. بدون هیچ Cl2 برای واکنش با، •CH ما3 رادیکال ها فقط می توانند با یک رادیکال آزاد دیگر (مانند •Cl) ترکیب شوند و CH ایجاد کنند3برای مثال Cl. اساساً هیچ مانعی برای این واکنش وجود ندارد. توجه داشته باشید که در اینجا تعداد رادیکال های آزاد از 2 به صفر کاهش می یابد. به این می گویند خاتمه دادن.
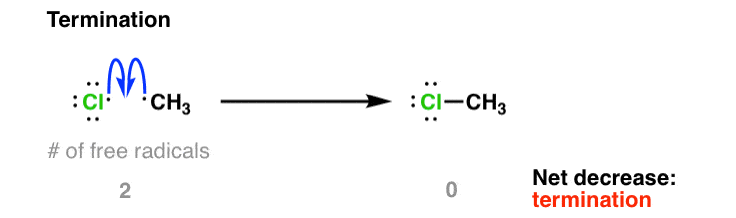
همچنین ممکن است دو گروه متیل با هم ترکیب شوند و CH ایجاد کنند3-CH3 ; این هم فسخ است!
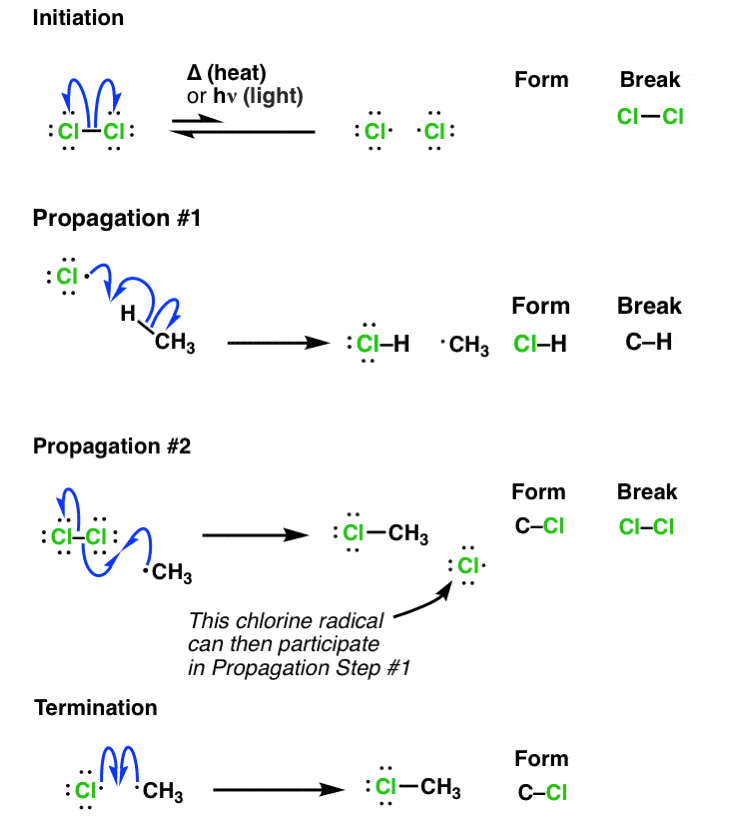
7. مکانیسم کامل جایگزینی رادیکال آزاد یک آلکان
بیایید همه این مراحل را کنار هم بگذاریم تا بتوانیم مراحل شروع، انتشار و خاتمه را به وضوح ببینیم.
8. خلاصه: واکنش های جایگزینی رادیکال آزاد
این سه نوع مرحله در هر واکنش رادیکال آزاد با آن مواجه می شوند.
نکته اصلی اینجاست که با شمارش تعداد رادیکال های ایجاد شده یا از بین رفته در هر مرحله، می توانید تعیین کنید که مرحله شروع، انتشار یا خاتمه است.
- شروع -> تشکیل خالص رادیکال ها
- انتشار -> عدم تغییر در تعداد رادیکال های آزاد
- خاتمه -> تخریب خالص رادیکال های آزاد
ما با دو تیزر برای پست های بعدی ترک می کنیم.
ابتدا… توجه داشته باشید که در اینجا ما از CH استفاده می کنیم4، که در آن هر پیوند C-H یکسان است. چه اتفاقی می افتد اگر از یک آلکان استفاده کنیم که در آن همه پیوندهای C-H برابر نیستند … مثلاً پروپان یا پنتان؟
دوم این واکنش به طرز چشمگیری شکست می خورد زمانی که برادر2 به جای Cl استفاده می شود2 برای واکنش CH4. با این حال، خواهیم دید که Br2 می تواند در موارد خاص خاصی کار کند.
بیشتر به زودی!
پست بعدی: ایزومرهای ناشی از واکنش های رادیکال آزاد
یادداشت
مواد جایزه.
ما فقط در مورد وضعیتی صحبت کردیم که یک معادل کلر (Cl2) استفاده می شود. چه اتفاقی میافتد وقتی از چندین معادل یا حتی بیش از حد زیاد استفاده میکنیم؟
یه لحظه بهش فکر کن تصور کنید ما چندین معادل Cl داشتیم2 در حضور CH3Cl. به نظر شما چه اتفاقی ممکن است بیفتد؟
یک اتم Cl• می تواند با CH واکنش دهد3Cl برای دادن •CH2Cl [and HCl]، که سپس می تواند با Cl واکنش نشان دهد2 برای دادن CH2Cl2 !
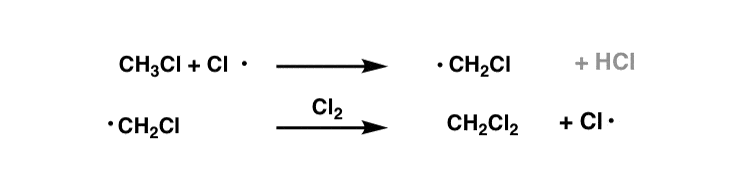
به همین ترتیب، اگر همچنان کلر اضافی داشته باشیم2، سپس تبدیل CH را مشاهده خواهیم کرد2Cl2 به CHCl3.
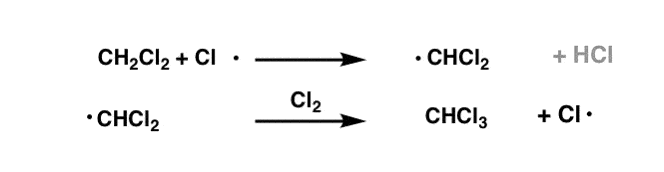
در نهایت، با توجه به مقدار کافی کلر2 سپس میتوانیم تبدیل CHCl را تصور کنیم3 برای دادن CCl4.
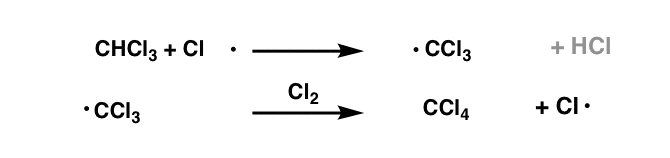
در این مرحله هیچ پیوند CH دیگری برای واکنش با رادیکال کلر وجود ندارد و بنابراین واکنش ما در نهایت خاتمه می یابد.
نکته اصلی در اینجا این است که آلکان ها، با توجه به مقدار زیادی کلر2، در نهایت تمام هیدروژن های آنها با کلر جایگزین می شود.
این مسیر در واقع نحوه دی کلرومتان (CH2Cl2 – یک حلال معمولی آزمایشگاهی) کلروفرم (CHCl3و تتراکلرید کربن (CCl4) به صورت صنعتی تولید می شوند. برای چندین دهه، CCl4 در مقیاس مگا تن برای استفاده به عنوان مبرد و حلال تمیز کننده خشک تولید شد تا زمانی که مطالعات آن و سایر CFCها را در تخریب لایه ازن دخیل دانستند.
(پیشرفته) مراجع و مطالعه بیشتر
- والینگ، سی. در رادیکال های آزاد در راه حل، ویلی و پسران، نیویورک 1957 ص. 352
- کلرزنی متان
T. McBee، HB Hass، CM Neher، و H. Strickland
شیمی صنعتی و مهندسی 1942، 34 (3)، 296-300
DOI: 10.1021/ie50387a009
این مقاله نشان می دهد که کلرزنی متان را می توان کنترل کرد تا هر یک از کلرومتان های مورد نظر را با بازده بالا به دست آورد. این مهم است زیرا CH3Cl، CH2Cl2، CHCl3و CCl4 همه مواد اولیه یا حلال های مهم هستند و به این ترتیب به صورت صنعتی تولید می شوند. - سینتیک کلریناسیون حرارتی متان
رابرت ان. پیز و جرج اف والز
مجله انجمن شیمی آمریکا 1931، 53 (10)، 3728-3737
DOI: 10.1021/ja01361a016
این مقاله شواهد جنبشی ارائه می دهد که کلرزنی متان 2 استnd مرتبه ( مرتبه اول در هر دو متان و کلر2). - برم سازی سیکلوهگزان، متیل سیکلوهگزان و ایزوبوتان
MS KHARASCH، WILLIAM Hered، و FRANK R. MAYO
مجله شیمی آلی 1941 06 (6)، 818-829
DOI: 10.1021/jo01206a005
ماهیت مکانیسم واکنش زنجیره ای رادیکال آزاد در جایگزینی آلکان ها تا دهه 1940 به طور کامل مشخص نشده بود. خاراش در این گزارش پیشگام در سال 1941 مکانیسم زنجیره ای را که اکنون در کتاب های درسی می خوانیم پیشنهاد می کند:
الف) Br2 + hv –> 2 Br • (شروع)
ب) R–H + Br• –> R• + HBr (مرحله انتشار 1)
ج) R• + Br2 –> R-Br + Br• (مرحله انتشار 2)
Kharasch گزارش می دهد که جایگزینی رادیکال آزاد سیکلوهگزان با Br2 در تاریکی یا در غیاب اکسیژن بسیار آهسته واکنش می دهد. در غلظت های پایین، اکسیژن می تواند به عنوان آغازگر رادیکال آزاد عمل کند (از Br2 رادیکال های Br تشکیل می دهد) اما در اینجا خاراش همچنین مشاهده می کند که در غلظت های بالا اکسیژن می تواند واکنش های رادیکال آزاد را مهار کند. گزینش پذیری Br• برای واکنش با پیوندهای CH به ترتیب سوم > ثانویه > اولیه نیز ذکر شده است.
