میدانم که قبلاً این را گفتهام، اما بسیاری از شیمی آلی را میتوان به «حمله هستهای به الکتروفیل» خلاصه کرد.
نوکلئوفیل ترکیبی است که می تواند یک جفت الکترون را به یک الکتروفیل (حدس زدید) اهدا کند که منجر به تشکیل یک پیوند شیمیایی می شود.
اگر به هسته دوست ها دقت کنید، خواهید دید که آنها به سه دسته کلی تقسیم می شوند. این چیزی است که پست امروز در مورد آن است: دیدن این الگوها.
1) جفت تنها
این احتمالاً سادهترین دسته از هستهدوستها برای درک است، به دلیل تشابهات با پایه. بالاخره یک واکنش اسید-باز جز ترکیب یک جفت تنها روی یک اتم با یک پروتون چیست؟
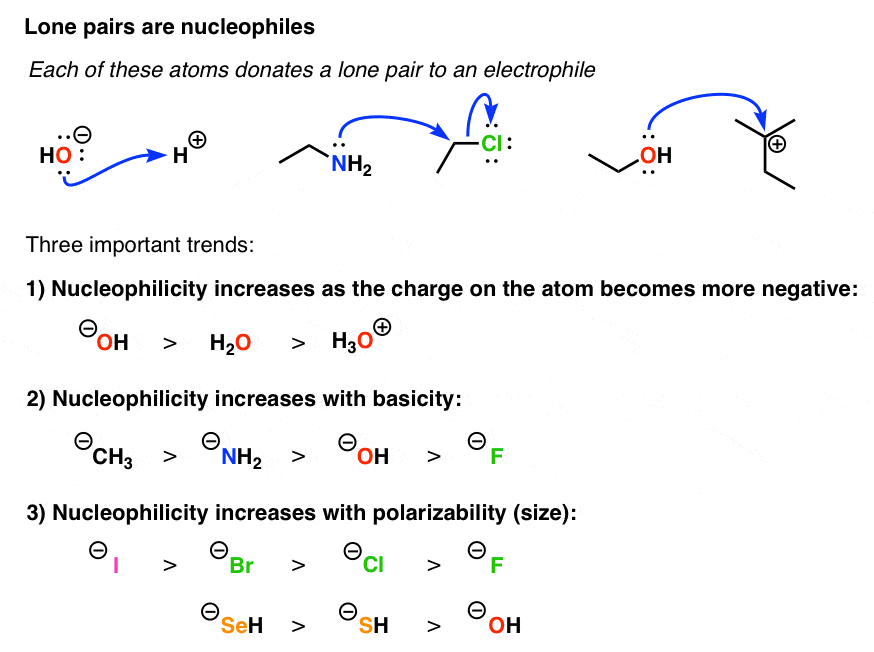
هنگام ارزیابی قدرت جفت های تنها به عنوان هسته دوست، چندین روند کلیدی وجود دارد که باید آنها را پیگیری کرد.
- با کاهش بار اتمی که به آن متصل است، هسته دوستی افزایش می یابد. یک راه ساده تر برای بیان این موضوع این است که “پایه مزدوج همیشه یک هسته دوست قوی تر است”.
- با افزایش پایه، هسته دوستی افزایش می یابد. بنابراین هرچه از راست به چپ جدول تناوبی را طی کنید، هسته دوستی نیز افزایش می یابد. [H3C(-) > H2N(-) > HO(-) > F(-) ).
- Nucleophilicity increases as you go down the periodic table. So comparing halides, I(-) > Br (-) > Cl (-) > F(-)
Of course you might be able to spot a contradiction here: iodine is more polarizable than fluorine, but it is also less basic. So when these two trends collide, what wins? The wishy washy answer is that “it depends”. Solvent is a key variable here. In polar protic solvents, nucleophilicity increases with polarizability, because hydrogen bonds form a shell around the less polarizable atoms and decrease their nucleophilicity. In polar aprotic solvents, this is not an issue, so basicity is the most important variable. [Ultimately, when trends collide, however, the final arbiter is experiment].
ویرایش: خواننده هشدار Prasanna به من یادآوری می کند که این روندها برای واکنش های SN2 وجود دارد، اما روند شماره 3 برای واکنش هایی که در آن هسته دوست به کربن غیر اشباع (کربونیل ها و آروماتیک ها) اضافه می کند، اهمیت کمتری دارد. یکی از چالش های درک هسته دوستی این است که به شدت به الکتروفیل وابسته است.
2) پیوندهای π.
π پیوندها را می توان به عنوان هسته دوست نیز در نظر گرفت: آنها یک جفت الکترون نیز اهدا می کنند، اما در این مورد این جفت بین دو اتم مشترک است. این نه تنها پیوندهای دوگانه را پوشش می دهد، بلکه پیوندهای سه گانه (آلکین ها) و همچنین آروماتیک ها و حتی انول ها و انولات ها (در سازمان 2) را نیز پوشش می دهد.
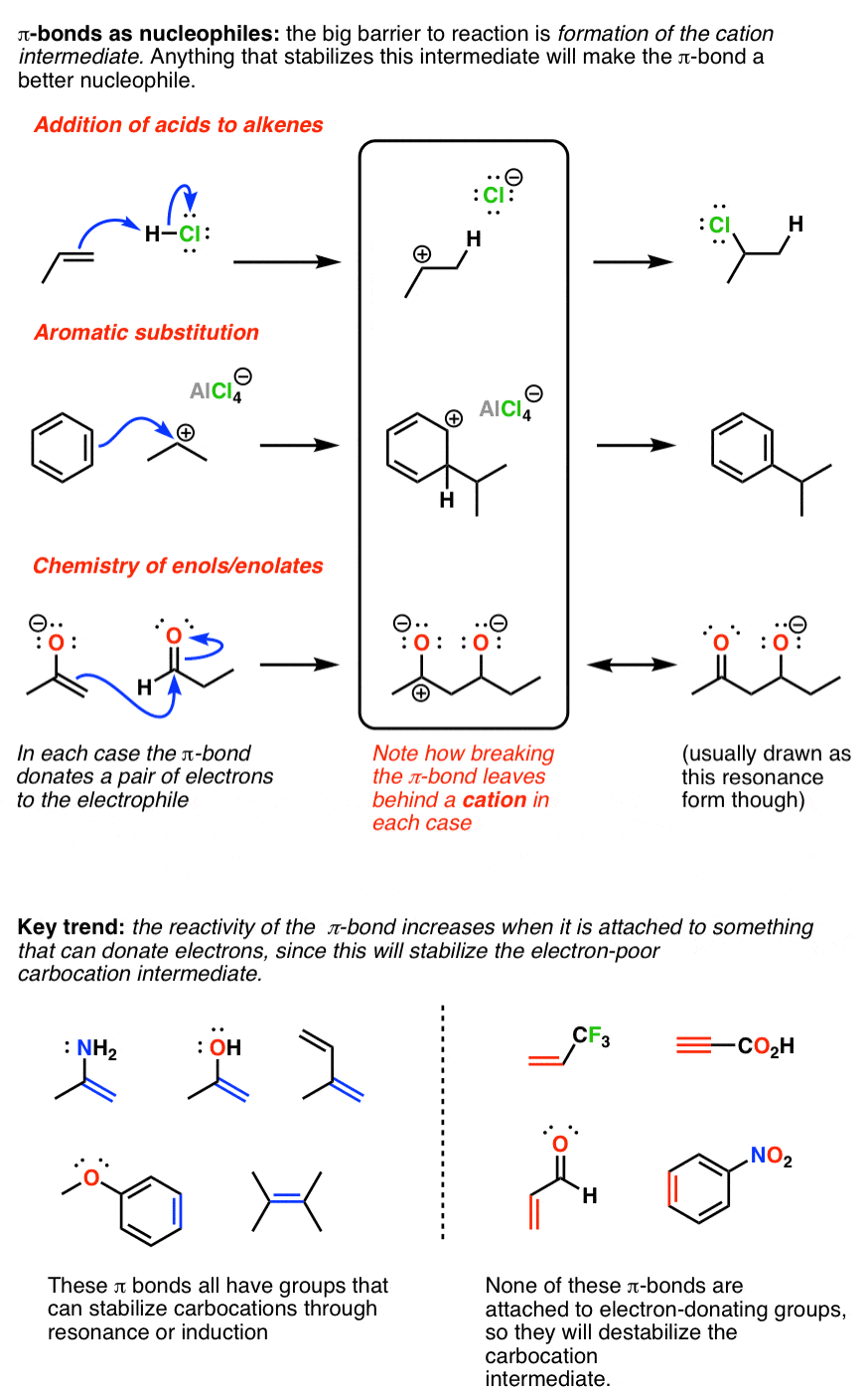
روند کلیدی که هسته دوستی را تعیین می کند π اوراق قرضه حضور گروه های اهداکننده است. منظور من از گروه های دهنده، اتمی است که می تواند الکترون ها را با پیوند دوگانه به اشتراک بگذارد تا پس از اهدای جفت الکترون های خود به الکتروفیل، به تثبیت آن کمک کند. امیدواریم این امر منطقی باشد: به هر حال، وقتی یک پیوند دوگانه با یک الکتروفیل واکنش می دهد، نتیجه یک کربوکاتیون (یک گونه پر انرژی) است. گروههای اهداکننده الکترون به تثبیت کربوکاتیون از طریق اهدای الکترون کمک میکنند. هر چیزی که کربوکاتیون را پایدارتر کند، انرژی فعالسازی واکنش را کاهش داده و آن را سریعتر میکند.
3) اوراق قرضه سیگما.
در نهایت، جفت الکترون در یک پیوند سیگما، گاهی اوقات میتوانند به عنوان هسته دوست نیز عمل کنند. این سومین دسته مهم از هسته دوستها احتمالاً ظریفتر و کمتر از دو مورد قبلی دیده میشوند، اما ممکن است با دیدن آن، آن را تشخیص دهید. در اینجا چند نمونه آورده شده است:
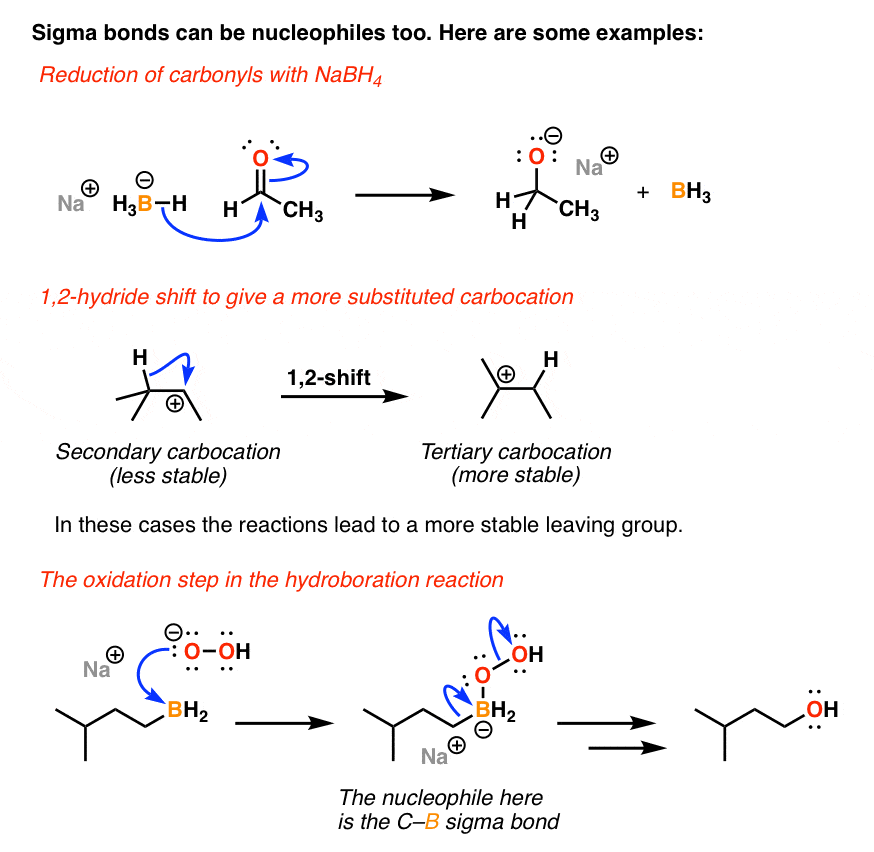
توجه داشته باشید که برای اینکه پیوند سیگما به عنوان یک هسته دوست عمل کند، باید این کار را انجام دهیم زنگ تفريح آن پیوند سیگما بنابراین، شماره 1 مهم ترین عامل حاکم بر هسته دوستی پیوندهای سیگما است ترک گروه در دو مورد از این موارد، پیوند سیگما به یک اتم با بار منفی متصل است که پس از شکسته شدن پیوند، خنثی می شود. در مورد سوم (تغییر هیدرید) ما از یک کربوکاتیون ثانویه بسیار ناپایدار به یک کربوکاتیون سوم پایدارتر تغییر می کنیم.
***
آیا این پست چیزی را از دست داده است؟ چیزی که باید پوشش می دادم؟ پیام بگذارید!
