تأثیرات بی ثبات کننده بر پایداری کربوکاتیون
در پست اخیر در مورد 3 چیز که کربوکاسیون ها را تثبیت می کنند، اشاره کردم که کربوکاتیون ها زمانی تثبیت می شوند که اتم های همسایه آنها الکترون اهدا کنند. این منطقی است، درست است؟ بارهای مخالف جذب می شوند، مانند دفع اتهامات.
خوب، این پست در مورد بخش “دفع اتهامات لایک” است. همانطور که ممکن است بتوانید تصور کنید، اگر همسایگان اهداکننده الکترون در حال تثبیت برای کربوکاتیونها هستند، همسایههای الکترونکشنده باید بیثباتکننده باشند.
حداقل سه موضوع در اینجا قابل ذکر است – 1) جایگزینی گروه های آلکیل با H 2) همسایه های الکترون خارج کننده، و 3) اثر هیبریداسیون.
فهرست مطالب
- کاهش تعداد جایگزینهای کربن، پایداری کربوکاتیون را کاهش میدهد
- اثرات استقرایی کربوکاتیونها توسط گروههای همسایه الکترون خارجکننده بیثبات میشوند*
- هر چه “شخصیت” کربوکاتیون بزرگتر باشد، پایداری آن کمتر است
1. کاهش تعداد جایگزین های کربن باعث کاهش پایداری کربوکاتیون می شود
اگر با افزایش تعداد کربنهای متصل، کربوکاتیونها تثبیت شوند، با جایگزین کردن این کربنها با هیدروژن، آنها نیز بیثبات میشوند. دو روش سنتی برای توضیح این موضوع وجود دارد. توضیح ساده، اثرات القایی را به عنوان عامل اصلی در تثبیت کربوکاتیون ها فرا می خواند. هیدروژنها فقط دو الکترون در لایه ظرفیت خود دارند – برخلاف کربن، نمیتوانند چگالی الکترون را از اتمهای همسایه برداشته و به کربوکاتیون اهدا کنند.
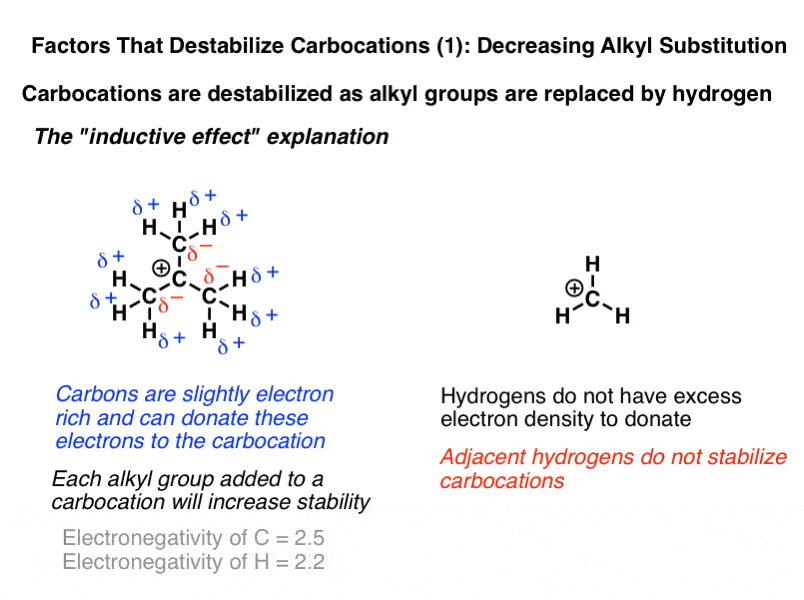
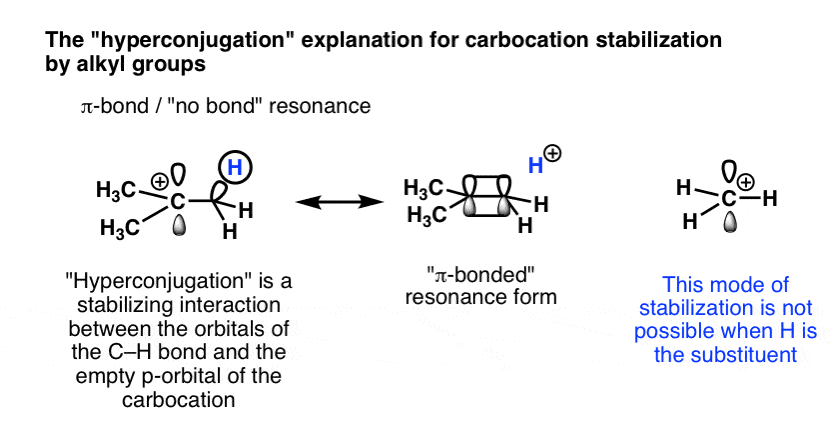
توضیح دوم که از لحاظ نظری قوی تر است، فراهمراهی است – اهدای الکترون از یک پیوند سیگما (پیوند CH در این مورد) به اوربیتال خالی p. این مفهوم قدرتمندتری است، اما بسیاری از دوره های مقدماتی آن را پوشش نمی دهند.
2. اثرات استقرایی. کربوکاتیونها توسط گروههای همسایه الکترون خارجکننده بیثبات میشوند*
(* که فاقد جفت تنها هستند).
بهترین راه برای توضیح این موضوع به سادگی از طریق تصاویر است. این گروه های کاربردی را بررسی کنید.
اگر در هر مورد دقت کنید، باید متوجه بار مثبت کربوکاتیون در مجاورت یک بار مثبت کامل یا جزئی در یک جانشین مجاور شوید. این درست است چه همسایه گروهی مانند CF باشد3 یا برای آلدئیدها، گروههای نیترو، سولفونها یا بسیاری از گروههای دیگر حاوی اتمهای الکترونگاتیوتر از کربن.
اولین موردی که در مورد همه این گروه های الکترون خارج کننده به آن اشاره می شود این است که هیچ یک از گروه ها حاوی اتمی با یک جفت تکی نیستند که مستقیماً به کربوکاتیون پیوند دارند. این مهم است! اکثر مردم هالوژن هایی مانند F، Cl، Br، و I را به دلیل الکترونگاتیوی خود به عنوان گروه های حذف کننده الکترون در نظر می گیرند، اما در واقع همه این گروه ها به تثبیت کردن بارهای مثبت چرا؟ زیرا هر یک از این اتم ها دارای جفت های تکی هستند که می توانند به کربوکاتیون اهدا شوند که یک برهمکنش تثبیت کننده است.
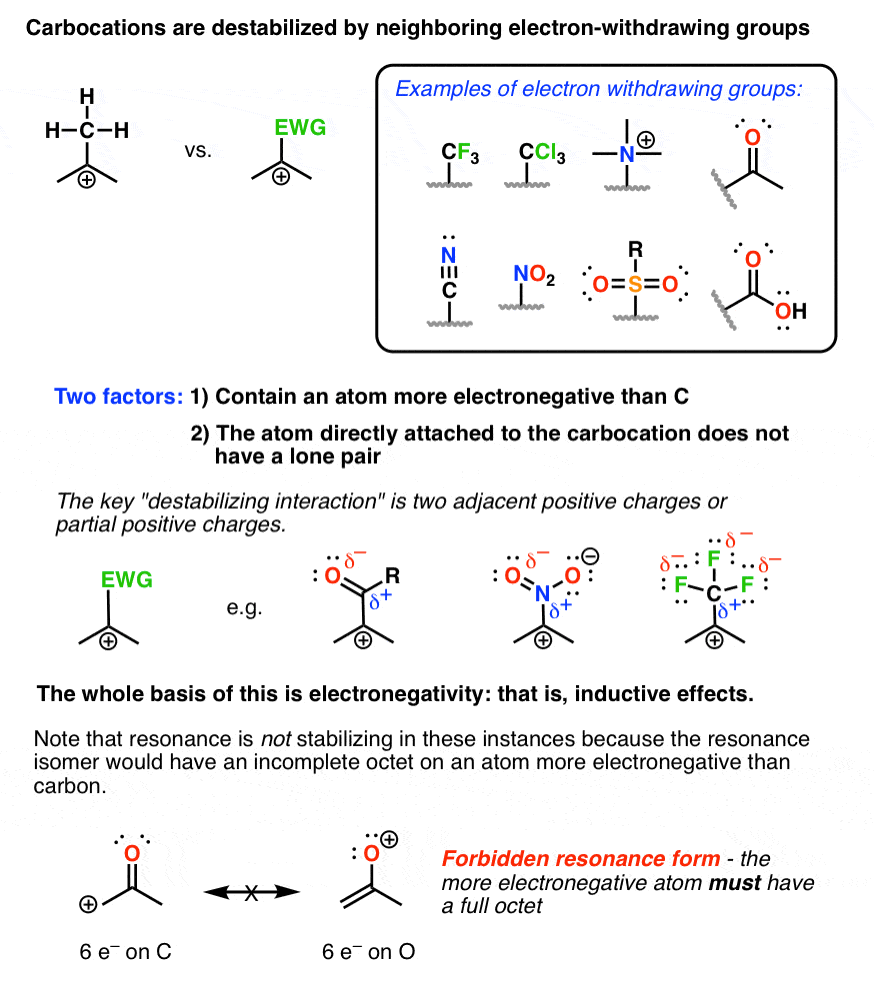
دومین نکته ای که باید به آن توجه کرد این است که رزونانس، در عین حال که ممکن است، وجود دارد نه تثبیت در مورد گروه هایی مانند آلدئیدها، کتون ها و گروه های دیگر با پیوندهای متعدد به اتم های الکترونگاتیو. دلیل آن این است که این اشکال تشدید واقعاً ناپایدار هستند – اگر برای بیرون کشیدن آنها وقت بگذارید، خواهید دید که در نهایت با یک فرم تشدید مواجه خواهید شد که اتم الکترونگاتیوتر فاقد یک اکتت کامل است. تنها اتم های ردیف اولی که تا به حال مشاهده خواهید کرد که فاقد یک هشت عدد کامل هستند، بور و کربن هستند.
3. هر چه “شخصیت” کربوکاتیون بزرگتر باشد، پایداری آن کمتر است.
روند در اینجا بسیار ساده است: با افزایش کاراکتر s، پایداری کربوکاتیون کاهش می یابد. یعنی همانطور که از کربوکاتیون های مشتق شده از sp3 به sp2 به sp- کربن.
شما کربوکاتیونها را روی پیوندهای دوگانه چندان نمیبینید، و در اینجا یک دلیل خوب وجود دارد: در مقایسه با sp.3در اوربیتال ها شخصیت s بیشتری وجود دارد، بنابراین اوربیتال خالی بیشتر به هسته نزدیک می شود. اگر در مورد بار مثبت صحبت کنیم، این بی ثبات کننده است.
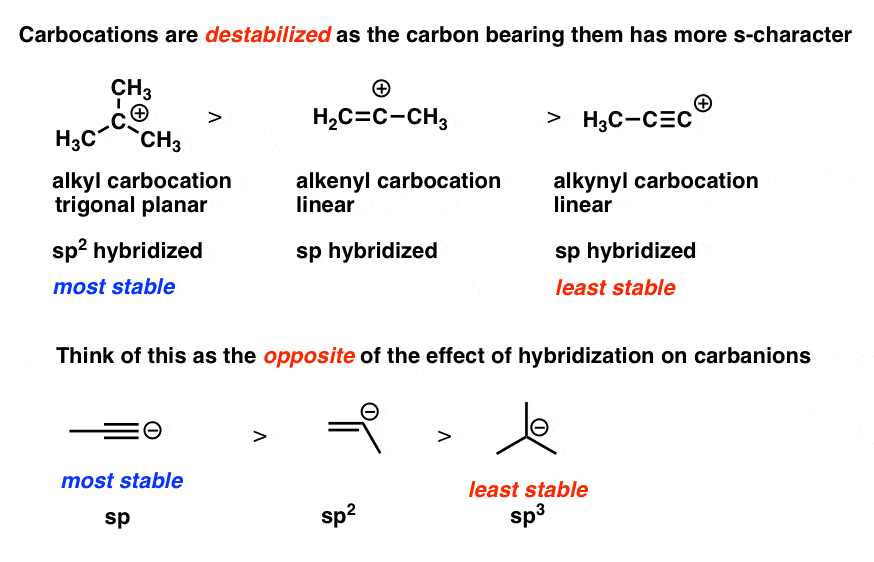
اگر این تا حدودی آشنا به نظر می رسد، باید – دقیقاً همین طور است مقابل استدلال برای اینکه چرا بارهای منفی در کربن هیبرید شده sp نسبت به sp پایدارتر هستند2 و sp3.
عوامل حاکم بر اسیدیته را به خاطر دارید؟ خوب، همه عواملی که وجود دارد تقریباً یک نقشه راه برای چیزهایی هستند که بار منفی را تثبیت می کنند. تمام این پست در مورد آن صحبت می کند بی ثبات کننده بار مثبت همه گرایش هایی که افزایش دادن اسیدیته خواهد شد نزول کردن پایداری کاتیون ها جالبه که چطور میتونه به هم وصل بشه، نه؟
