“A-Values” برای سیکلوهگزان های جایگزین
“A-Values” یک روش عددی برای رتبه بندی حجیم بودن جانشین ها در یک حلقه سیکلوهگزان است. “A-Value” نشان دهنده تفاوت انرژی (بر حسب کیلوکالری/مول) بین ترکیب سیکلوهگزان حامل گروه در موقعیت استوایی (مطلوب تر) و ترکیب سیکلوهگزان حامل گروه در موقعیت محوری است. هرچه “مقدار A” بیشتر باشد ترجیح انرژی برای موقعیت استوایی بیشتر است و گروه “حجم”تر در نظر گرفته می شود.
1. رتبه بندی عددی “حجمی” برای جایگزین های سیکلوهگزان
در پست آخر دیدیم که افزودن یک گروه متیل به سیکلوهگزان نتیجه می دهد دو صندلی کانفورماتور که از نظر انرژی نابرابر هستند. ما دیدیم که کانفورمری که گروه متیل در آن استوایی بود، پایدارترین است، زیرا از بی ثبات کردن جلوگیری می کند. دو محوری فعل و انفعالات (از نظر فنی، فعل و انفعالات گاوش) که در هنگام محوری بودن گروه متیل در کنفورمر وجود دارد.
همچنین گفتیم که آزمایشها به ما میگویند که 1-متیل سیکلوهگزان بهعنوان یک نسبت 95:5 از کنفورمرها در دمای اتاق وجود دارد (به نفع شکلدهنده استوایی پایدارتر) و با استفاده از معادله ΔG = -RT ln K میتوانیم تفاوت انرژی را محاسبه کنیم. به نظر می رسد 1.70 کیلو کالری در مول است.
سوال منطقی بعدی این است. تفاوت انرژی برای گروه های دیگر چیست؟ به عنوان مثال، وقتی اتیل را جایگزین می کنیم (CH2CH3) برای متیل؟ یا اوه؟ یا برادر؟ یا ترت-بوتیل؟ تعادل چگونه تحت تأثیر قرار می گیرد؟
برای پی بردن به این موضوع، لازم است چند آزمایش انجام دهیم که به ما امکان می دهد این اعداد را اندازه گیری کنیم. با این حال، همه اینها برای ما انجام شده است، بنابراین اکنون می توانیم نتایج را ارائه دهیم.
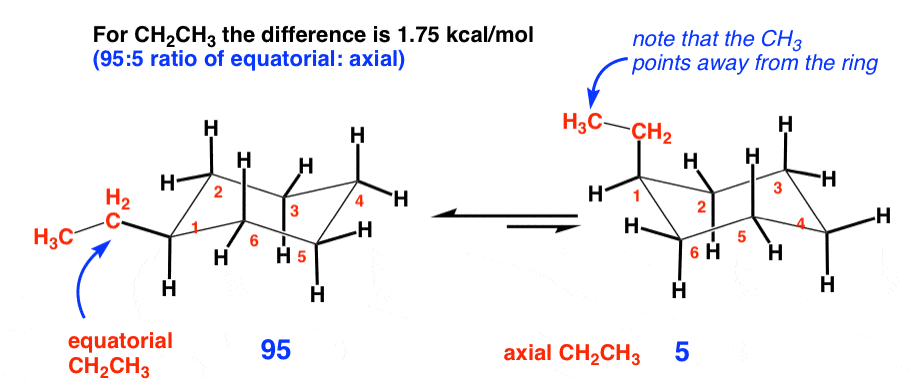
2. اتیل (1.75 کیلو کالری در مول)
گروه اتیل یک کربن بزرگتر از گروه متیل است. ساده لوحانه، ممکن است فکر کنیم که از آنجایی که طول آن دو برابر است، دو برابر بیشتر مانع فضایی است و اختلاف انرژی دو برابر بیشتر خواهد بود. با این حال، تفاوت در انرژی تنها است 1.75 کیلو کالری در مول (در مقایسه با متیل در 1.70 کیلو کالری در مول). این به این دلیل است که تنها تعاملات دو محوری قابل توجه با CH است2 گروه گروه اتیل می تواند به گونه ای بچرخد که CH3 نقطه دور از حلقه، جایی که منجر به افزایش قابل توجهی در فشار نمی شود.
3. هیدروکسیل (OH) (0.87 کیلو کالری در مول)
با توجه به اینکه اکسیژن عدد اتمی بزرگتری نسبت به کربن دارد، غیر منطقی نیست که فکر کنیم گروه OH ممکن است «حجمتر» از کربن باشد. وقتی به منبع کرنش در CH فکر می کنید3با این حال، متوجه می شوید که این لزوما به اندازه خود اتم کربن نیست، بلکه به اندازه اتم کربن است هیدروژن ها از CH3 برهمکنش با هیدروژن های محوری روی حلقه که منجر به کرنش می شود. اکسیژن با داشتن تنها یک هیدروژن، همیشه میتواند بهگونهای بچرخد که H از سیکلوهگزان دور باشد، در نتیجه برهمکنشهای دو محوری با حلقه بسیار کم است.
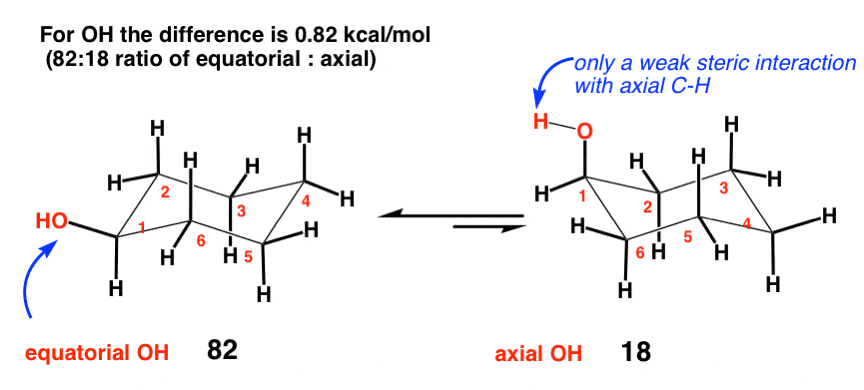
مقدار OCH3 حتی کمتر است (0.6 کیلو کالری در مول).
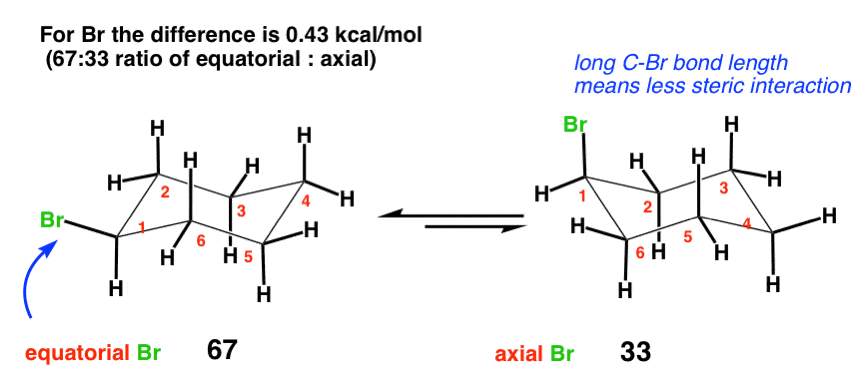
4. Br (0.43 کیلوکالری در مول)
در امتداد خطوط مشابه، می توان فکر کرد که Br، به عنوان یک اتم سنگین و بزرگ، ممکن است در موقعیت محوری تأثیر بی ثبات کننده زیادی داشته باشد. با این حال، این تفاوت تنها 0.43 کیلو کالری در مول است، که کمتر از آن برای OH است. چرا ممکن است این باشد؟ پاسخ اینجاست طول پیوند. میانگین پیوند C-Br حدود 193 پیکومتر طول دارد (1.93 آنگستروم) – این را با 1.50 برای پیوند بین C و CH مقایسه کنید.3 در سیکلوهگزان Br که دورتر است، بنابراین برهمکنش کمتری با هیدروژن های محوری خواهد داشت. [Note – this A value of 0.43 is the average of two experimentally determined values [0.38 and 0.48]. برای اطلاعات بیشتر به وب سایت عالی هانس رایش مراجعه کنید. ]
جالب اینجاست که علیرغم تفاوت زیاد آنها در اندازه، مقادیر A برای Cl، Br و I تقریباً مشابه هستند (حدود 0.43 یا بیشتر). این به این دلیل است که اندازه افزایش یافته با افزایش طول پیوند متعادل می شود – هالوژن ها ممکن است در امتداد Cl
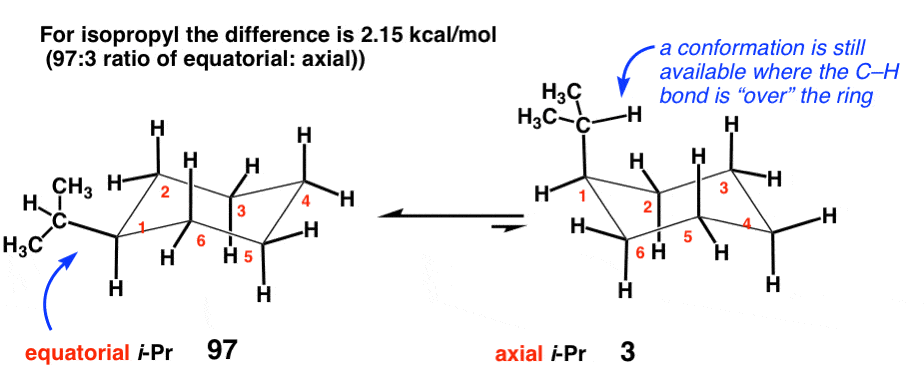
5. ایزوپروپیل [-CH(CH3)2] (2.15 کیلو کالری در مول)
بر خلاف اتیل که دارای کربن ثانویه متصل به حلقه است، گروه ایزوپروپیل نشان دهنده کربن سوم متصل به سیکلوهگزان است. افزایش نسبتاً کوچک اما قابل توجهی در کرنش به 2.15 کیلو کالری در مول وجود دارد. این به این دلیل است که گروه ایزوپروپیل همچنان میتواند ترکیبی را اتخاذ کند که در آن پیوند CH بر روی حلقه سیکلوهگزان قرار دارد، که آن را در تماس قابل توجهی با پیوندهای CH محوری قرار نمیدهد.
6. ترت-بوتیل [-C(CH3)3] (4.9 کیلو کالری در مول)
این بزرگ است. به تفاوت عظیم انرژی بین t-butyl (4.9 کیلو کالری در مول) و ایزوپروپیل (2.15 کیلو کالری در مول) نگاه کنید. چه چیزی ممکن است برای آن 2.7 کیلوکالری در مول اضافی در انرژی کرنش باشد.
این کمک می کند که به یک شکل نگاه کنید.
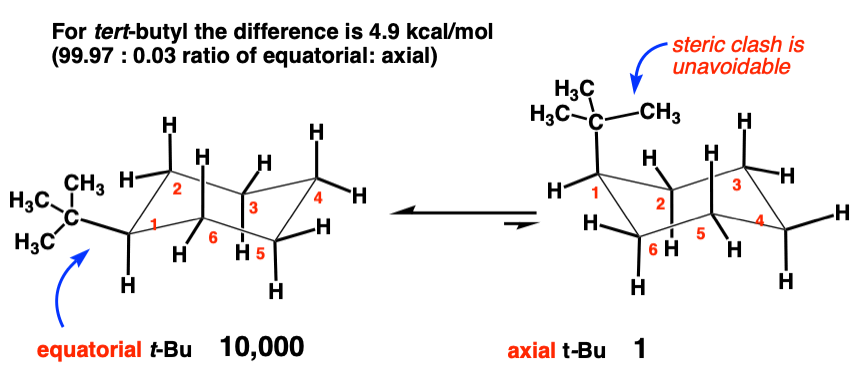
توجه کنید که چگونه هیچ راهی برای چرخش گروه t-butyl وجود ندارد به طوری که گروه متیل روی حلقه قرار نگیرد. برهمکنش دو محوری بین یکی از گروه های متیل و یک CH محوری اجتناب ناپذیر است. گروه های تی بوتیل محوری به شدت مورد استقبال قرار نمی گیرند.
پیامد آن مقدار 4.9 کیلوکالری در مول چیست؟ اگر ثابت تعادل K را محاسبه کنیم، نسبتی معادل 10000: 1 به ما می دهد. [accounting for only 2 significant figures here]. به عبارت دیگر، غلظت تی بوتیل محوری 1/10000 تی بوتیل استوایی است.
این مقدار آنقدر کوچک است که ما اغلب گروه t-butyl را به عنوان “قفل کردن” حلقه سیکلوهگزان در موقعیتی که t-butyl استوایی است تصور می کنیم.
همانطور که خواهیم دید، این عواقب بسیار مهمی برای واکنشهای آینده خواهد داشت، مانند جایگزینی و حذف، که میتواند به استریوشیمی حساس باشد.
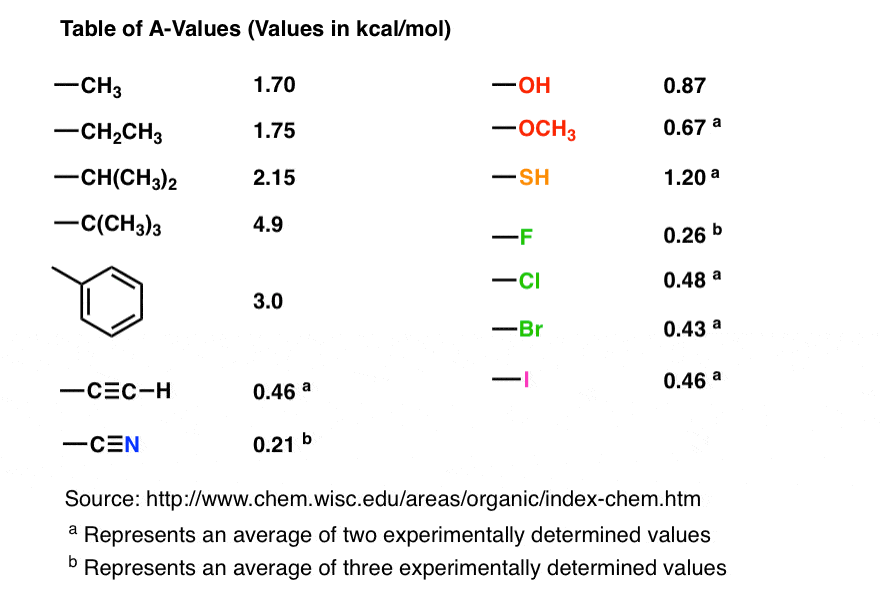
7. خلاصه: “ارزش ها”
خوب است که کمی کوتاه نویسی داشته باشید. برای یک سیکلوهگزان تک جایگزین، اختلاف انرژی بین کنفرورهای محوری و استوایی با یک جانشین معین به عنوان آن شناخته می شود. A-value.
برای مثال، مقدار A متیل 1.70، اتیل 1.75، OH 0.87، Br 0.43، i-Pr 2.15 و t-Bu 4.9 است.
مقادیر A مفید هستند زیرا افزودنی هستند. ما میتوانیم از آنها برای کشف تفاوتهای انرژی بین سیکلوهگزانهای دی و سهجانشین استفاده کنیم. که در پست بعدی در مورد آن صحبت خواهیم کرد.
پست بعدی: فراز و نشیب سیکلوهگزان ها
یادداشت
PS در اینجا جدول مختصری از مقادیر A مربوط به شیمی آلی مقدماتی آورده شده است. این ها از وب سایت عالی هانس رایش گرفته شده است. مقادیر ممکن است با ویکیپدیا متفاوت باشد زیرا ارقام متوسط هستند. [Note – these values are only valid for six-membered rings! but they do give you an idea of relative bulkiness of the substituents that can be applied to other ring sizes]
(پیشرفته) مراجع و مطالعه بیشتر
الف- ارزش ها
این موضوعی است که معمولاً در مقطع کارشناسی در شیمی آلی تدریس می شود. آ-مقادیر به صورت تجربی مشتق شده اند و نشان دهنده ترجیح ترمودینامیکی برای قرار گرفتن یک جایگزین در موقعیت محوری یا استوایی در سیکلوهگزان هستند.
- بررسی های پراش الکترونی ساختارهای مولکولی. II. نتایج به دست آمده با روش بخش چرخشی.
هاسل، او. ویرول، اچ.
Acta Chem. Scand. 1947، 1، 149-168
DOI: 3891/acta.chem.scand.01-0149 - ساختار مولکول های حاوی حلقه های سیکلوهگزان یا پیرانوز.
هاسل، او. اوتار، بی.
Acta Chem. Scand. 1947، 1، 929-943
DOI: 3891/acta.chem.scand.01-0929
Odd Hassel برای اولین بار تایید کرد که سیکلوهگزان در حال حاضر رایج وجود دارد صندلی تائیدیه. او همچنین پیشنهاد کرد که جانشینها میتوانند دو نوع موقعیت متفاوت روی حلقه بگیرند که آنها را پیوندهای c و e-e-باند نامید. او همچنین نشان داد که تحلیل ساختاری سیکلوهگزانها را میتوان به سایر حلقههای 6 عضوی غیراشباع مانند پیرانوزهایی که معمولاً در کربوهیدراتها یافت میشوند، گسترش داد. اود هسل بعداً جایزه نوبل شیمی را با پروفسور DHR Barton به خاطر کارش بر روی تجزیه و تحلیل ساختاری به اشتراک گذاشت. - خواص ترمودینامیکی و ساختار مولکولی سیکلوهگزان، متیل سیکلوهگزان، اتیل سیکلوهگزان و هفت دی متیل سیکلوهگزان
چارلز دبلیو بکت، کنت اس پیتزر و رالف اسپیتزر
مجله انجمن شیمی آمریکا 1947، 69 (10)، 2488-2495
DOI: 1021/ja01202a070
این مقاله ابتدا اصطلاحات «قطبی» و «استوایی» را برای دو نوع موقعیتی که جایگزینها میتوانند در سیکلوهگزان بگیرند، پیشنهاد میکند. - نامگذاری از سیکلواوراق قرضه هگزانی
بارتون، دی.، هاسل، او.، پیتزر، ک.، پرلوگ، وی.
طبیعت 1953، 172، 1096-1097
DOI: 1038/1721096b0
این اولین نمونه از اصطلاحات “محوری” و “استوایی” است که برای نشان دادن دو موقعیتی که جانشین ها می توانند در سیکلوهگزان بگیرند استفاده می شود. - همسایگی کربن و هیدروژن. نوزدهم مشتقات t-Butylcyclohexyl. تحلیل ساختاری کمی
S. Winstein و NJ Holness
مجله انجمن شیمی آمریکا 1955، 77 (21)، 5562-5578
DOI: 10.1021/ja01626a037
مقاله اولیه در مورد تعیین آ-مقادیر (به جدول XII مراجعه کنید) از طریق اندازهگیریهای جنبشی (solvolytic)، چیزی که پروفسور وینستین به آن معروف بود. مقدمه خلاصه خوبی از نحوه انجام آن دارد آ– ارزشها تعیین میشوند و بعداً پروفسور وینستین میگوید:مقدار انرژی که توسط آن یک گروه t-butyl موقعیت استوایی را ترجیح می دهد به اندازه کافی بزرگ است تا همگنی ساختاری را برای اکثر مشتقات 4-t-butylcyclohexyl تضمین کند.”، مطابق با آنچه امروزه معمولاً در کلاس های شیمی آلی تدریس می شود. - جدول انرژی های ساختاری-1967
جری آ. هیرش
مباحث استریوشیمی 1967، 1، 199-222
DOI: 1002/9780470147108.ch4
این مقاله شامل فهرست دقیقی از انواع مختلف گروههای عملکردی با مقادیر A، شامل ارجاع به منابع اصلی و جزئیات روشهای اندازهگیری است. - https://www2.chem.wisc.edu/areas/reich/handouts/a-values/a-values.htm
این صفحه در وب سایت پروفسور هانس رایش (U Wisconsin-Madison) حاوی یک لیست مفید از آ-ارزش ها، با ارجاعات. - تعیین تجربی انرژی آزاد ساختاری، آنتالپی و تفاوت آنتروپی برای گروه های آلکیل در آلکیل سیکلوهگزان ها با طیف سنجی تشدید مغناطیسی کربن-13 دمای پایین
هارولد بوث و جرمی آر اورت
شیمی. Soc., Perkin Trans. 2، 1980، 255-259
DOI: 10.1039/P29800000255
این مقاله استفاده از روشهای NMR را برای تعیین تفاوتهای انرژی آزاد بین آلکیل سیکلوهگزانهای جایگزین محوری و استوایی پوشش میدهد (در اصل، آ-ارزش های). - ترجیح ساختاری (مقدار) دوتریوم در مونودوتریوسیکلوهگزان از ادغام دوترون در دماهای پایین
فرانک ای ال آنت، دانیل جی اولری
چهار وجهی لت. 1989، 30 (9)، 1059-1062
DOI: 10.1016/S0040-4039(01)80358-0
این مقاله یک مطالعه NMR را برای تعیین این توصیف می کند آ– ارزش جانشین دوتریوم در سیکلوهگزان –D1. - تعادل ساختاری گروه آمینو
L. Eliel، EW Della، TH Williams
تت Lett. 1963، 4 (13)، 831-835
DOI: 10.1016/S0040-4039(01)90724-5
این مقاله مطالعهای را در مورد اندازهگیری مقدار A برای گروه آمینه در محیطهای خنثی و اسیدی (که در آن -NH است) توصیف میکند.3+).
