مقایسه دو واکنش جانشینی هسته دوست که به وضوح مکانیسم های متفاوتی دارند
شیمی یک علم تجربی است. هیچ رامانوجان بزرگی در رشته ما وجود ندارد که با شروع یک مجموعه ساده از مقدمات، بتواند تمام عمق و تنوع شیمی مدرن را استخراج و پیش بینی کند. نه، خیلی آشفته تر از این است.
شیمیدان ها باید به طور فعال طبیعت را بازجویی کنند تا اسرار او را بیاموزند. مواد را با هم اضافه می کنیم و مشاهداتی انجام می دهیم. با توجه به مشاهدات قابل تکرار کافی، در تعدادی از متغیرهای مختلف، ما شروع به دیدن الگوها می کنیم. و هنگامی که آن الگوها آشکار شدند، میتوانیم فرضیههایی بسازیم و آنها را آزمایش کنیم. فرضیه هایی که از آزمایش تجربی جان سالم به در می برند، در نهایت به عنوان «قوانین» شناخته می شوند، اگرچه آنها در واقع فقط نظریه های بسیار قوی هستند که جعل نشده اند.
این فقط یک راه طولانی برای گفتن این است که داده ها اول هستند و فرضیه ها در مرحله دوم قرار می گیرند – در عمل نگاه به عقب. از آنجایی که ما در مورد واکنش های جایگزینی صحبت می کنیم، اجازه دهید برخی از موارد جالب و به ظاهر متناقض را مرور کنیم. داده ها در مورد واکنش های جایگزینی که ثبت شده است، و سپس (در پست های بعدی) می توانیم به عقب نگاه کنیم و در مورد معنای آنها صحبت کنیم.
امروز ما 3 متغیر کلیدی واکنش های جایگزینی را بررسی کرده و نتایج را با هم مقایسه خواهیم کرد.
فهرست مطالب
- چگونه دو واکنش جانشینی هسته دوست بر اساس سوبسترا متفاوت است (متیل، آلکیل هالیدهای اولیه، ثانویه، سوم)
- چگونه دو واکنش جانشینی هسته دوست بر اساس قوانین نرخ متفاوت است (درجه اول در مقابل مرتبه دوم)
- چگونه دو واکنش جایگزینی بر اساس استریوشیمی متفاوت است (وارونگی در مقابل احتباس + وارونگی)
- با توجه به این اطلاعات، یک فرضیه برای دو مکانیسم جایگزینی ارائه دهید
1. چگونه دو واکنش جانشینی هسته دوست بر اساس سوبسترا (متیل، آلکیل هالیدهای اولیه، ثانویه، سوم) متفاوت است.
این نرخ واکنش چیزی است که ما به راحتی می توانیم اندازه گیری کنیم. برخی از واکنشهای جایگزینی با حرکت از آن، الگوی مشخصی را نشان میدهند اولیه بسترها (در اینجا سوبسترا یک آلکیل هالید است) به درجه سوم بسترها
در واکنش اول، آلکیل هالید اولیه در شرایط مشابه، واکنش سریع تری نسبت به آلکیل هالید سوم نشان می دهد.
با این حال، واکنش های جایگزینی وجود دارد که به عنوان نقطه مقابل عمل می کنند. در مثال دوم، آن است درجه سوم بستری که سریعترین واکنش را نشان میدهد و به دنبال آن بستر اولیه قرار میگیرد.
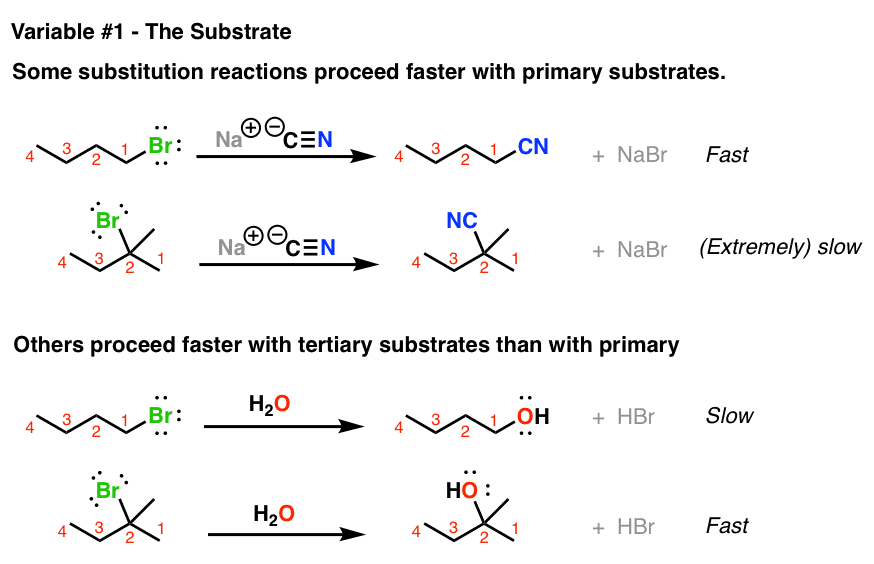
جالب هست!
2. چگونه دو واکنش جانشینی هسته دوست بر اساس قوانین نرخ متفاوت است (مرتبه اول در مقابل مرتبه دوم)
اندازه گیری نرخ همچنین به ما امکان می دهد بررسی کنیم که چقدر به آن وابسته است غلظت ها از واکنش های مختلف میتوانیم ببینیم وقتی دو یا چهار برابر میشویم چه اتفاقی برای نرخ میافتد (یا هشتگانه – این یک کلمه است؟) غلظت نوکلئوفیل یا سوبسترا.
در اولین واکنش، سرعت افزایش می یابد به صورت خطی همانطور که ما افزایش می دهیم تمرکز از سوبسترا یا هسته دوست. یعنی اگر غلظت بستر را ثابت نگه داریم و دو برابر غلظت هسته دوست، ما دو برابر نرخ.
با این حال، سرعت واکنش دوم تنها به غلظت سوبسترا حساس است. هرچقدر هم غلظت نوکلئوفیل را کم یا زیاد کنیم، نرخ تغییر نمی کند!
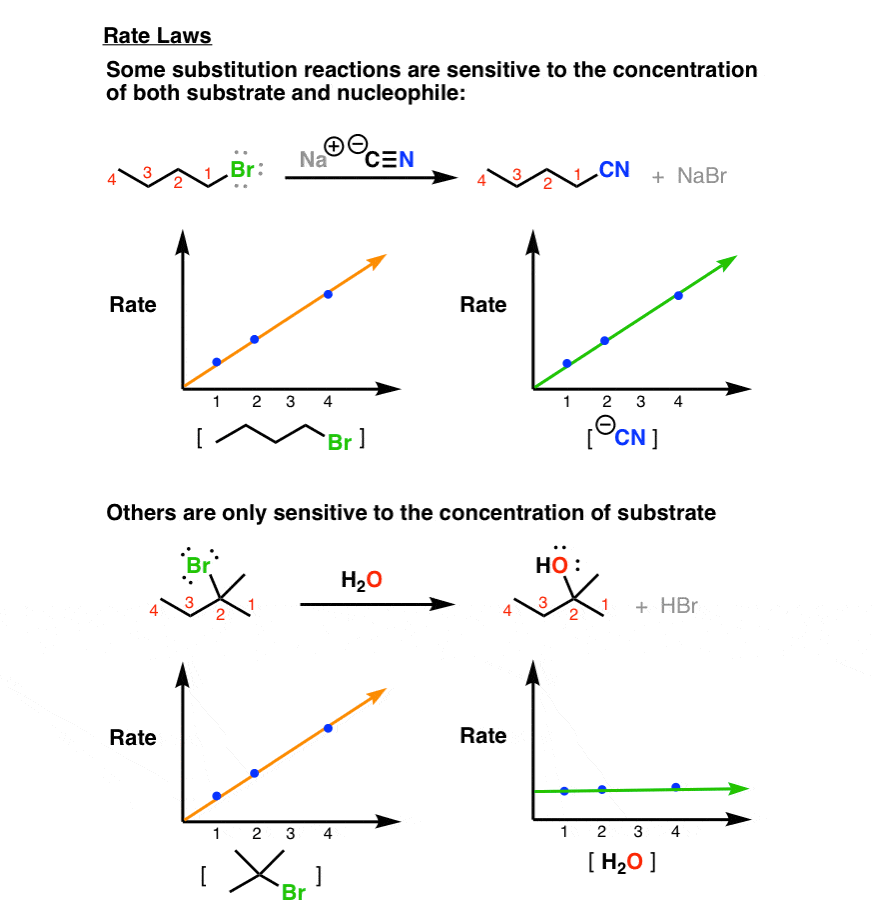
3. چگونه دو واکنش جانشینی بر اساس استریوشیمی متفاوت است (وارونگی در مقابل احتباس + وارونگی)
همچنین می توان چرخش نوری یک مولکول را که یکی از ویژگی های استریوشیمی آن است، اندازه گیری کرد. همانطور که تکنیک ها بیشتر اصلاح شد، ما قادر به جداسازی و کار با ترکیبات انانتیومری خالص هستیم.
مشاهده جالب: اگر با یک انانتیومر منفرد در واکنش بالا شروع کنید، یک انانتیومر منفرد به دست می آورید – با این تفاوت که پیکربندی مطلق معکوس شده است!
به این حالت وارونگی پیکربندی می گویند.
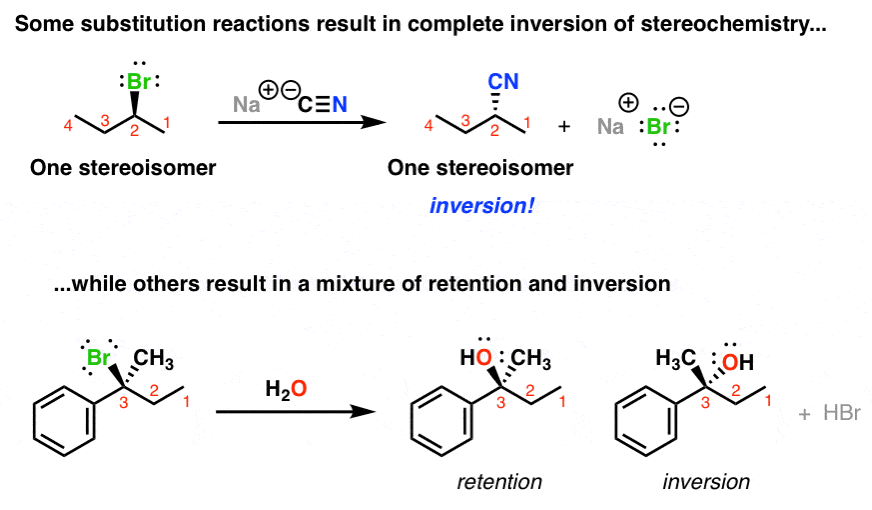
از سوی دیگر، در واکنش پایین، با شروع با یک انانتیومر منفرد، تمایل به دریافت مخلوطی از احتباس داریم. و وارونگی
(اگر مقدار حفظ و وارونگی برابر باشد، ما به آن “راسمی شدن” می گوییم. گاهی اوقات آنها دقیقاً برابر نیستند).
4. با توجه به این اطلاعات، یک فرضیه برای دو مکانیسم جایگزینی ارائه دهید
بنابراین با توجه به دادههایی که در اختیار داریم (و اینها فقط چند نمونه از نمونههای بیشماری هستند)، چگونه میتوانیم به فرضیههایی برای نحوه عملکرد این واکنشها دست پیدا کنیم؟
آنها باید توضیح دهند:
- پیوندها چگونه شکل می گیرند و چگونه می شکنند
- وابستگی به نوع بستر
- وابستگی به تمرکز
- مشاهدات استریوشیمی
این فرضیه ها نامیده می شوند مکانیسم ها. به این فکر کنید که هر یک از این دو واکنش چگونه می توانند به طور بالقوه کار کنند. سپس در پست بعدی اولین نوع واکنش تعویض را بررسی خواهیم کرد.
پست بعدی: مکانیسم SN2
