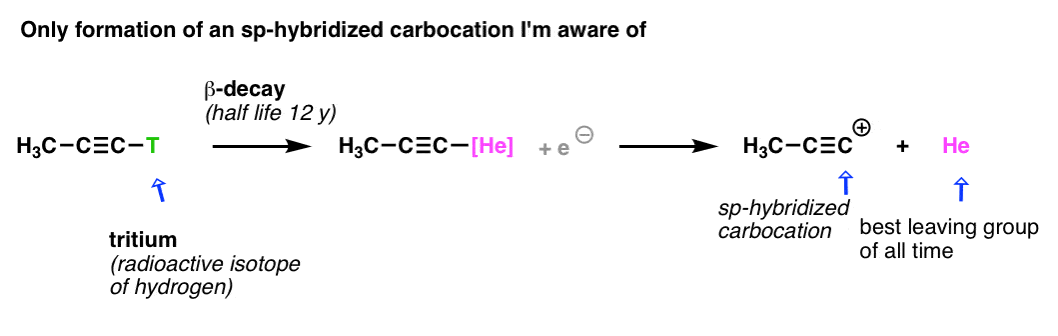
چگونه هیبریداسیون مداری بر استحکام باند تأثیر می گذارد
درک مفهوم اوربیتال های هیبریدی (پست قبلی را ببینید) به شما امکان می دهد پیش بینی های دقیقی در مورد روند قدرت اوراق قرضه داشته باشید. در این پست چندین نمونه از نحوه انجام این کار را ارائه خواهیم داد.
فهرست مطالب
- یک آزمون سریع (در مورد انرژی تفکیک باند)
- اصل کلیدی در هیبریداسیون مداری و نقاط قوت پیوند: هر چه کاراکتر s بیشتر باشد، پیوند قوی تر
- الکترون ها در س-اوربیتال ها در اوربیتال های p مربوطه نسبت به الکترون ها به هسته نزدیک تر هستند.
- خلاصه: همه چیز برابر است، شخصیت بزرگتر، پیوند قوی تر
- بخش پاداش: پاسخ به سؤالی که ممکن است چند نفر بپرسند
- شکاف باند همولیتیک در مقابل هترولیتیک
- یک تست برای شما
- آخرین چیز: این مفهوم همچنین توضیح می دهد که چرا CH3+ پایدارتر از NH است3+
- یادداشت
1. یک مسابقه سریع
بیایید با یک مسابقه سریع شروع کنیم.
قوی ترین پیوند C-H در زیر چیست؟
(به عبارت دیگر، کدام پیوند C-H دارای بالاترین انرژی تفکیک پیوند است؟)
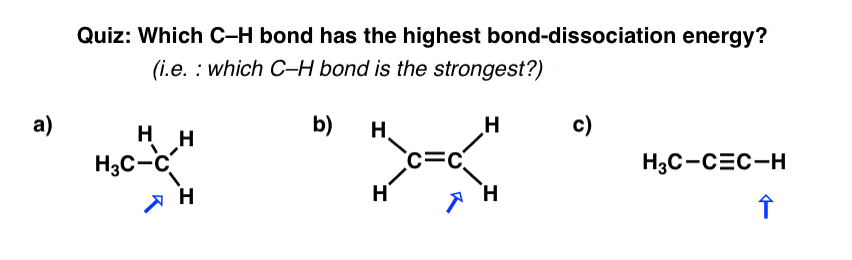
پاسخ C است.
- در a)، کربن sp3 هیبرید شده و انرژی تفکیک پیوند 105 کیلوکالری در مول است
- در ب) کربن sp است2 هیبرید شده و انرژی تفکیک پیوند 110 کیلوکالری در مول است
- در c)، کربن هیبرید شده است و انرژی تفکیک پیوند 126 کیلو کالری بر مول است.
2. اصل کلیدی در هیبریداسیون مداری و نقاط قوت پیوند: هر چه کاراکتر s بیشتر باشد، پیوند قوی تر
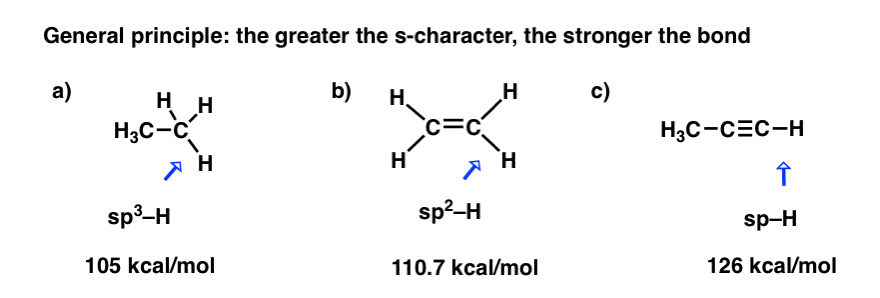
توجه داشته باشید که روند استحکام باند، در بالا، sp > sp است2 > sp3
به عبارت دیگر، کاراکتر s بیشتر روی کربن، پیوند قوی تر است.
بیایید دوباره این را امتحان کنیم. در مورد این سه پیوند C-C چطور؟
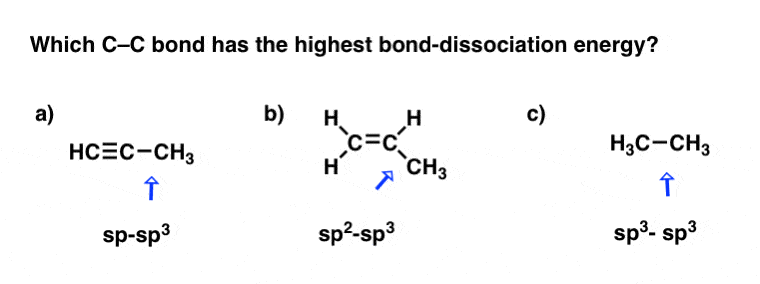
امیدوارم آنها را A > B > C رتبه بندی کرده باشید.
همه چیز برابر است: sp-sp3 پیوند قوی تر از sp است2-sp3 رابطه، رشته، که به نوبه خود قوی تر از sp3-sp3 رابطه، رشته.
چرا؟
3. الکترون ها در س-اوربیتال ها در اوربیتال های p مربوطه نسبت به الکترون ها به هسته نزدیک تر هستند.
به طور متوسط: الکترون ها در س اوربیتالها به هسته نزدیکتر هستند (و بنابراین بار مثبت مؤثرتری را احساس میکنند) نسبت به الکترونها در هسته مربوطه. پ اوربیتال ها
بنابراین، الکترونهای موجود در یک اوربیتال sp (50% کاراکتر s) نسبت به الکترونهای یک sp نیروی جاذبه بیشتری برای هسته تجربه میکنند.2 (33% s-character) یا sp3 (25% کاراکتر s) مداری.
“انرژی تفکیک پیوند” (BDE) که در بالا ذکر شد، معیاری از انرژی مورد نیاز برای است همولیتیک گسست یک پیوند (همو = یکسان لیز = شکستن). [See post: Bond Dissociation Energies = Homolytic Cleavage]
یعنی انرژی لازم برای شکستن پیوند را اندازه میگیرد به طوری که هر اتم به همان تعداد الکترون ختم میشود، مانند واکنشهای زیر:
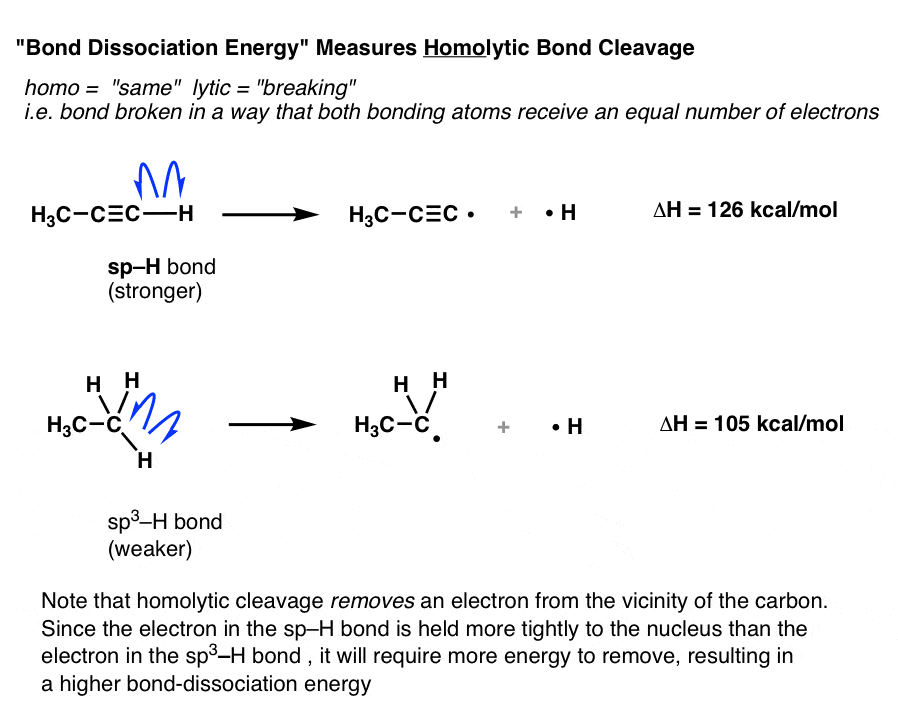
در واکنش های شکاف همولیتیک بالا، یک الکترون منفرد است حذف شده از اوربیتال مولکولی C-H و روی هیدروژن قرار می گیرد که تجزیه می شود. الکترون دیگر روی کربن باقی می ماند.
انرژی تفکیک پیوند برای پیوند sp-H بیشتر از sp است3-H زیرا برای برداشتن یک الکترون از اوربیتال مولکولی محکمتر sp-H و قرار دادن آن منحصراً روی اتم هیدروژن به نیروی (انرژی) بیشتری نیاز است.
بنابراین الکترونهای یک اوربیتال با کاراکتر s بیشتر به هسته نزدیکتر خواهند بود و نیروی الکترواستاتیک قویتری را احساس میکنند.
این به توضیح انرژی پیوند بالاتر کمک می کند.
شناخت نوع پیوندها در مولکول ها یک مهارت کلیدی است. (همچنین ببینید: اوراق قرضه CC سیگما در شش نوع، اوراق قرضه CC pi در یک نوع وجود دارد).
برای اکثر اهداف، این درس کلیدی پست را به پایان می رساند.
4. خلاصه: همه چیز برابر است، شخصیت بزرگتر، پیوند قوی تر
اما… اگر متوجه شدید که سعی می کنید با یک تناقض ظاهری که از قسمت دیگری از دوره نشات می گیرد، آشتی دهید، ادامه مطلب را بخوانید.
5. بخش پاداش: پاسخ به سؤالی که ممکن است چند نفر بپرسند
آلکین ها (pKآ 25) اسیدهای قوی تری نسبت به آلکان های معمولی (pK) هستندآ > 50).
به عنوان مثال، آلکین ها به آسانی توسط بازهای قوی مانند NaNH پروتونه می شوند2، در حالی که آلکان ها نیستند:
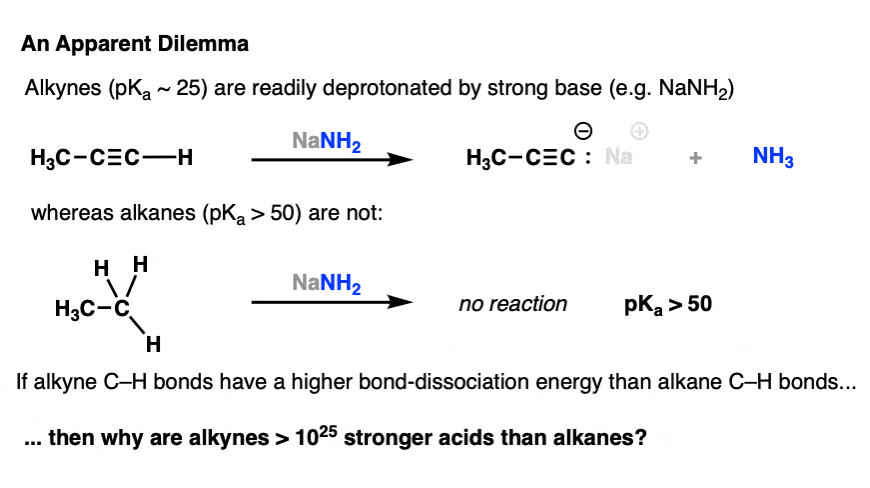
چرا؟ زیرا پیوند C-H در یک آلکین دارد بیشتر س-شخصیت، و جفت منفرد حاصل روی کربن نگه داشته می شود محکم تر به هسته، رندر پایه مزدوج پایدارتر.
اوه عزیزم. به نظر می رسد یک گروه خشمگین نزدیک می شود.
صبر کن! شما فقط گفتید که پیوندهای آلکین C-H هستند قوی تر نسبت به پیوندهای آلکانی C-H، زیرا آنها دارای شخصیت s بیشتری هستند و اکنون شما می گویید که آنها راحت تر شکستن زیرا آنها شخصیت s بیشتری دارند.
آیا این نباید آلکین بسازد؟ کمتر اسیدی است زیرا پیوندهای C-H دارای شخصیت s بیشتری هستند؟

چنگال ها را کنار بگذارید! یک توضیح کاملا منطقی برای این وجود دارد!
6. شکاف باند همولیتیک در مقابل هترولیتیک
منبع سردرگمی در اینجا چیست؟
بیایید الکترون ها را دنبال کنیم.
در نهایت راه حل این معضل تشخیص تفاوت بین این دو است همولیتیک شکاف (که همان چیزی است که انرژی تفکیک پیوند اندازه گیری می کند) و هترولیتیک برش (که در واکنش اسید-باز، از دست دادن H+ رخ می دهد).
بیایید به این دو فرآیند نگاه کنیم.
در شکاف همولیتیک یک پیوند C-H، یک الکترون به طور کامل از مجاورت کربن خارج شده و روی هیدروژن قرار می گیرد. به دلیل s-شخصیت بیشتر پیوند، حذف الکترون از کربن هیبرید شده sp دشوارتر از sp است.3 کربن هیبرید شده همانطور که در بالا گفتیم، به همین دلیل است که انرژی تفکیک پیوند برای پیوندهای آلکین C-H بیشتر از پیوندهای آلکان C-H است.
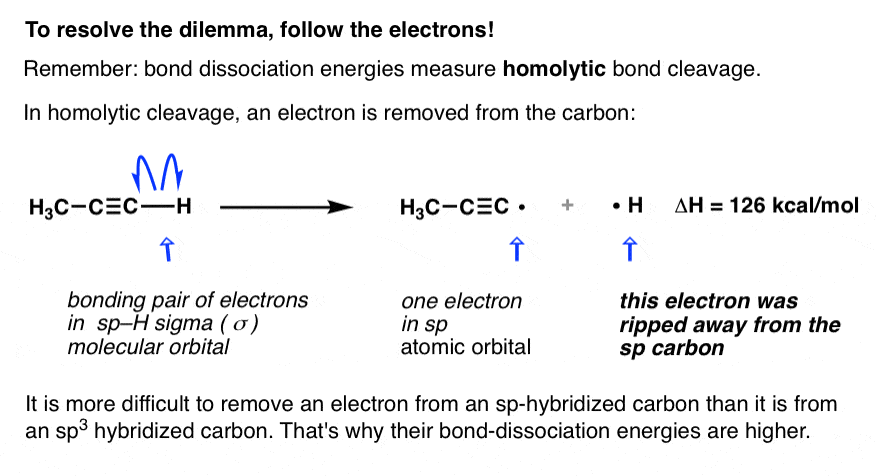 در یک واکنش اسید-باز، پیوند C-H نیز می شکند، اما به گونه ای می شکند که جفت الکترون روی اتم کربن باقی می ماند. از آنجایی که پیوند به گونه ای می شکند که منجر به یک ناهموار. ناجور توزیع الکترون ها نامیده می شود هترولیتیک شکاف پیوند (هترو = متفاوت، لیز = شکستن).
در یک واکنش اسید-باز، پیوند C-H نیز می شکند، اما به گونه ای می شکند که جفت الکترون روی اتم کربن باقی می ماند. از آنجایی که پیوند به گونه ای می شکند که منجر به یک ناهموار. ناجور توزیع الکترون ها نامیده می شود هترولیتیک شکاف پیوند (هترو = متفاوت، لیز = شکستن).
بیایید دوباره بگوییم: در یک واکنش اسید باز، جفت الکترون روی کربن می ماند، منجر به یک اتم کربن با بار منفی (یک “کربنیون”) می شود.
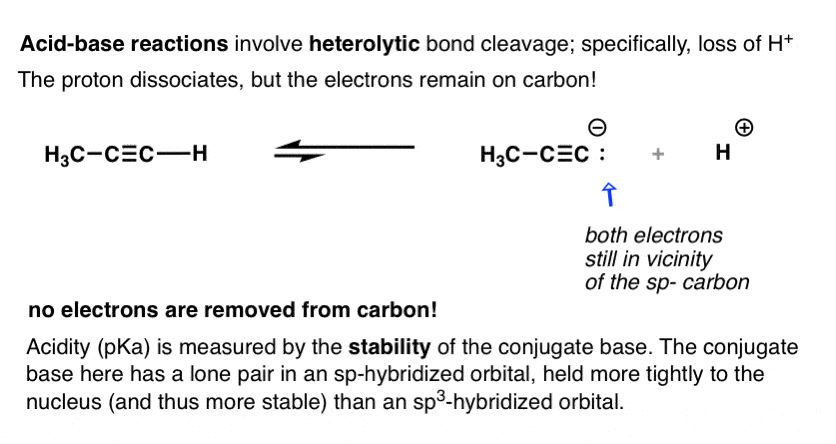
اسیدیته با pK اندازه گیری می شودآ، اندازه گیری تعادل بین اسید و باز مزدوج آن است. هرچه تعادل بیشتر به نفع پایه مزدوج باشد، pK کمتر استآ و هر چه اسید قوی تر باشد. به عبارت دیگر:
هر عاملی که پایه مزدوج را پایدارتر کند، اسیدیته را افزایش می دهد.
- در قاعده مزدوج یک آلکین، جفت تنها در یک اوربیتال sp- با 50٪ کاراکتر s نگه داشته می شود.
- در پایه مزدوج یک آلکان، جفت تنها در یک sp نگهداری می شود3 مداری با 25% کاراکتر s.
کدام جفت تنها پایدارتر خواهد بود؟
جفت تنها محکمتر به هسته – یعنی اوربیتال sp- چسبیده است.
به همین دلیل است که آلکین ها اسیدی تر از آلکان ها هستند: پایه مزدوج پایدارتر است.
امیدواریم این موضوع روشنتر کند که پیوندهای قویتر C-H و اسیدیته بیشتر C-H دو طرف یک پدیده هستند.
[You might find it helpful to think of sp orbitals as having a greater effective electronegativity than sp2 orbitals, which in turn have a greater electronegativity than sp3 orbitals. So the reason for the greater acidity of alkynes relative to alkenes is not really so different than the greater acidity of H–F relative to H2O. ]
7. آزمونی برای شما
در خطر بی سرنشینی، جنبه سومی از این پدیده وجود دارد که باید در نظر گرفت.
برش همولیتیک تنها می تواند یک راه اتفاق بیفتد. اما وجود دارند دو روش هایی برای رسم شکاف هترولیتیک پیوند C-H، و شاید متوجه شده باشید که من فقط یکی را نشان دادم.
راه دوم (البته بعید) وجود دارد که برش هترولیتیک می تواند رخ دهد. جفت الکترونهای پیوند C-H میتوانند به جای آن به هیدروژن مهاجرت کنند، نه کربن و در نتیجه یک آنیون هیدرید و یک کربوکاتیون ایجاد میشود. [Again, very unlikely, but bear with me here].
در اینجا یک تست برای شما دارم. بر اساس همه چیزهایی که تا به حال پشت سر گذاشته ایم، کدام یک از دو محصول زیر (A یا B) پایدارتر خواهد بود؟
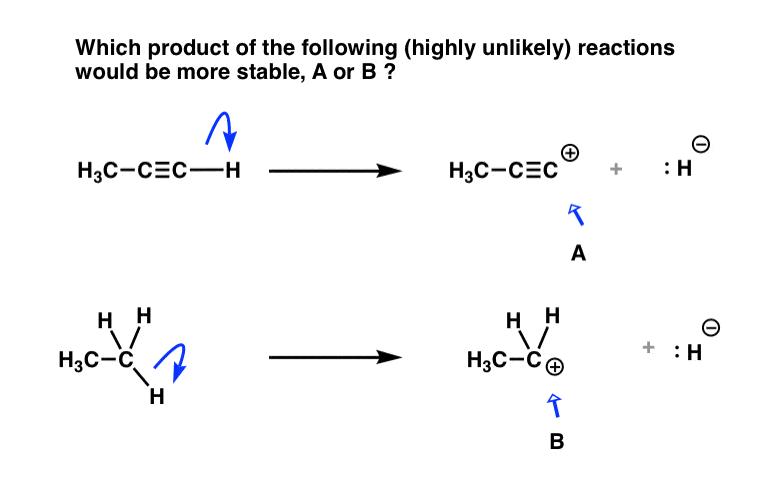
به آن فکر کنید.
- برای تشکیل A، باید یک جفت الکترون را از یک کربن هیبرید شده sp حذف کنیم.
- برای تشکیل B، باید یک جفت الکترون را از یک sp حذف کنیم3-کربن هیبرید شده
چه چیزی مطلوب تر است؟
- واکنش برای دادن A مستلزم حذف دو الکترون از یک کربن هیبرید شده با sp است.
- واکنش برای دادن B نیاز به حذف دو الکترون از یک sp دارد3 کربن هیبرید شده
واکنش به دادن ب باید بسیار آسان تر باشد، زیرا الکترون ها کمتر محکم نگه داشته می شوند. و در واقع، sp3کربوکاتیون های هیبرید شده مشاهده شده و حتی جدا شده اند.
در مقابل، کربوکاتیون های هیبرید شده sp مانند A بسیار ناپایدار هستند و هرگز به طور مستقیم مشاهده نشده اند. [Note 1]
این مشاهدات نیز با تمام مشاهدات بالا سازگار است!
8. آخرین چیز: این مفهوم همچنین توضیح می دهد که چرا CH3+ پایدارتر از NH است3+
همانطور که در بالا گفتم، می تواند مفید باشد که کربن های هیبرید شده sp را به عنوان الکترونگاتیوی موثرتری نسبت به sp در نظر بگیریم.2کربن های هیبرید شده که به نوبه خود الکترونگاتیوی بیشتری نسبت به sp دارند3 کربن های هیبرید شده ما از این برای توجیه دلیل استفاده کردیم آلکین ها اسیدهای قوی تر از آلکان ها، به طور مشابه چرا HF اسید قوی تر از H است2O.
این نیز می تواند باشد ورق زد، درست مانند مثال کربوکاتیون ما در بالا.
هر چه الکترونگاتیوی اتم بیشتر باشد، بیشتر است ناپایدار گونه های دارای کمبود الکترون تبدیل می شوند.
این به توضیح اینکه چرا، برای مثال، H3C+ (با شش الکترون ظرفیت) است بسیار پایدارتر از H3N+ (همچنین با شش الکترون ظرفیتی) که به نوبه خود است دور پایدارتر از اکسیژن یا فلوئور با شش الکترون ظرفیت. افزایش الکترونگاتیوی بر پایداری گونه های دارای کمبود الکترون تأثیری مشابه افزایش کاراکتر s دارد.
یادداشت
یادداشت 1: در اینجا یک تلاش قابل توجه برای ساخت کربوکاتیون های هیبرید شده sp-هیبرید شده است. تنها کاربرد هلیوم در شیمی آلی که من تا به حال دیده ام.