درجات غیر اشباع (شاخص کمبود هیدروژن)
- فرمول مولکولی یک ترکیب می تواند سرنخ هایی در مورد ساختار آن بدهد.
- فرمول برای یک آلکان از الگوی C پیروی می کندnاچn+2 که در آن n تعداد کربن است.
- هر پیوند یا حلقه پی تعداد هیدروژن ها را 2 کاهش می دهد.
- بنابراین فرمول مولکولی می تواند تعداد پیوندها یا حلقه های پی را در یک ساختار ناشناخته به ما بگوید.
- به این می گویند شاخص کمبود هیدروژن (IHD) یا درجات غیر اشباع
- فرمول کامل دارای تغییراتی است که هالوژن و نیتروژن را در بر می گیرد

فهرست مطالب
- چه چیزی در مورد IHD عالی است؟
- بازی در اطراف با فرمول های مولکولی: درجات غیر اشباع
- برای یک هیدروکربن بدون حلقه یا پیوند دوگانه، تعداد هیدروژن ها برابر است با دو برابر تعداد کربن، به علاوه 2
- هر پیوند یا حلقه دوتایی تعداد هیدروژن را 2 کاهش می دهد
- هر حلقه یا پیوند دوگانه “درجه اشباع” نامیده می شود
- مثال: بنزن (4 درجه غیراشباع)
- در مورد مولکول های حاوی اکسیژن چطور؟
- در مورد هالوژن ها چطور؟
- نیتروژن کمی مشکل است
- فرمول یکپارچه برای درجات غیراشباع
- استفاده از فرمول IHD در چهار مثال واقعی
- خودت امتحان کن
1. چه چیزی در مورد IHD عالی است؟
بهترین چیز در مورد IHD این است که استفاده از آن یک معادله آسان است که اطلاعات مفیدی در مورد ساختار یک ترکیب ناشناخته به شما می دهد. انجام آن به معنای واقعی کلمه یک دقیقه طول می کشد. محاسبه درجات غیر اشباع اولین کاری است که توصیه می کنم وقتی با تعیین ساختار یک ترکیب ناشناخته با فرمول مولکولی شناخته شده مواجه می شوید انجام دهید. در این پست می بینیم که این محاسبه در تعیین ساختار زنجیره جانبی فرمون تارس گوزن کلاچ بوده است.
قبل از شروع، ببینید آیا می توانید معادله موجود در کادر بالا را برای یافتن درجات غیر اشباع در اینها اعمال کنید. فوق العاده مولکول های شناخته شده ای که فرمول آنها در زیر آورده شده است.
- سی9اچ8O4
- سی21اچ30O2
- سی17اچ21نO4
- سی11اچ15نO2
سه مولکول اخیر تا حدی نمونههای «شیطان» هستند و در اکثر کشورها، اگر نگوییم همه، غیرقانونی هستند. امیدواریم که این انگیزه ای برای شما باشد که واقعاً محاسبه را انجام دهید! (پاسخ در انتهای پست).
2. بازی در اطراف با فرمول های مولکولی: درجات غیر اشباع
اجازه دهید این بحث را با جستجوی الگوها در فرمول های مولکولی شروع کنیم. ما با هیدروکربن هایی شروع می کنیم که هیچ پیوند یا حلقه مضاعفی ندارند.
آیا می توانید رابطه ای بین تعداد کربن و تعداد هیدروژن ها مشاهده کنید؟
به طور دقیق تر، آیا می توانید یک فرمول ارائه دهید؟
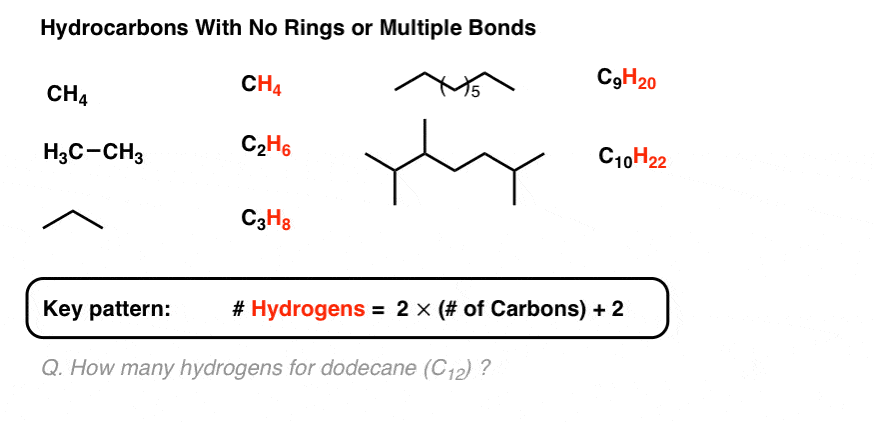
3. برای یک هیدروکربن بدون حلقه یا پیوند دوگانه، تعداد هیدروژن ها برابر است با دو برابر تعداد کربن، به اضافه 2
شما باید بتوانید ببینید که برای یک هیدروکربن بدون حلقه یا پیوند دوگانه، تعداد هیدروژن ها برابر است با دو برابر تعداد کربن به اضافه 2.
بنابراین برای مولکولی مانند دودکان (C12) انتظار داریم (12 x 2) + 2 = را ببینیم 26 هیدروژن
حال: وقتی یک پیوند مضاعف به مولکول اضافه می کنیم، چه اتفاقی برای فرمول مولکولی می افتد؟
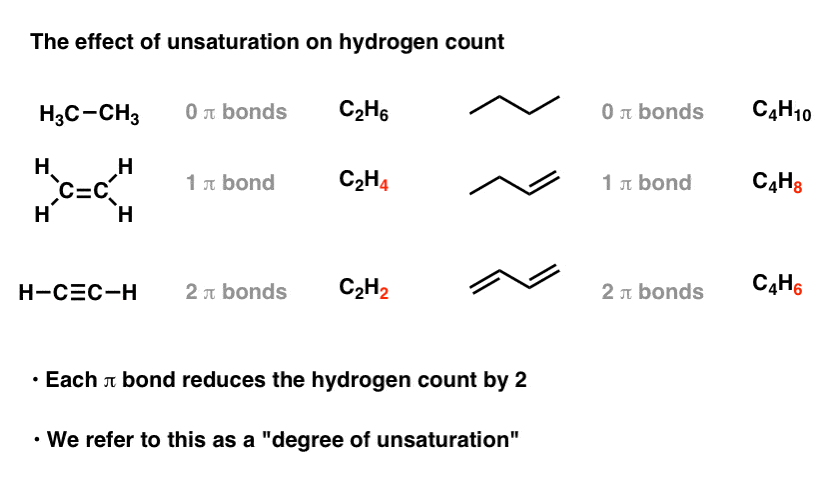
4. هر پیوند یا حلقه مضاعف تعداد هیدروژن را 2 کاهش می دهد
باید بتوانید ببینید که هر پیوند چندگانه (پیوند π) تعداد هیدروژنها در فرمول دو عدد کاهش مییابد. اتین (2 پیوند π) دو هیدروژن کمتر از اتن (پیوند π) دارد که دو هیدروژن کمتر از اتان دارد (پیوند π صفر).
هیدروکربنهای حاوی پیوند π اغلب هیدروکربنهای غیراشباع نامیده میشوند. آنها را می توان با هیدروژن (Pd/C، H2 ) برای دادن آلکان مربوطه بدون پیوند π، که سپس گفته می شود که با هیدروژن “اشباع” شده است. («چربیهای غیراشباع» را که حاوی آلکن هستند و «چربیهای اشباع شده» که حاوی آلکن نیستند، مقایسه کنید).
از آنجایی که هر پیوند پی منجر به از دست دادن 2 هیدروژن از فرمول مولکولی می شود، ما به آن به عنوان “درجه اشباع نشدن“.
بیایید توجه خود را به ترکیبات حلقوی معطوف کنیم. آیا متوجه اثر مشابهی شده اید؟
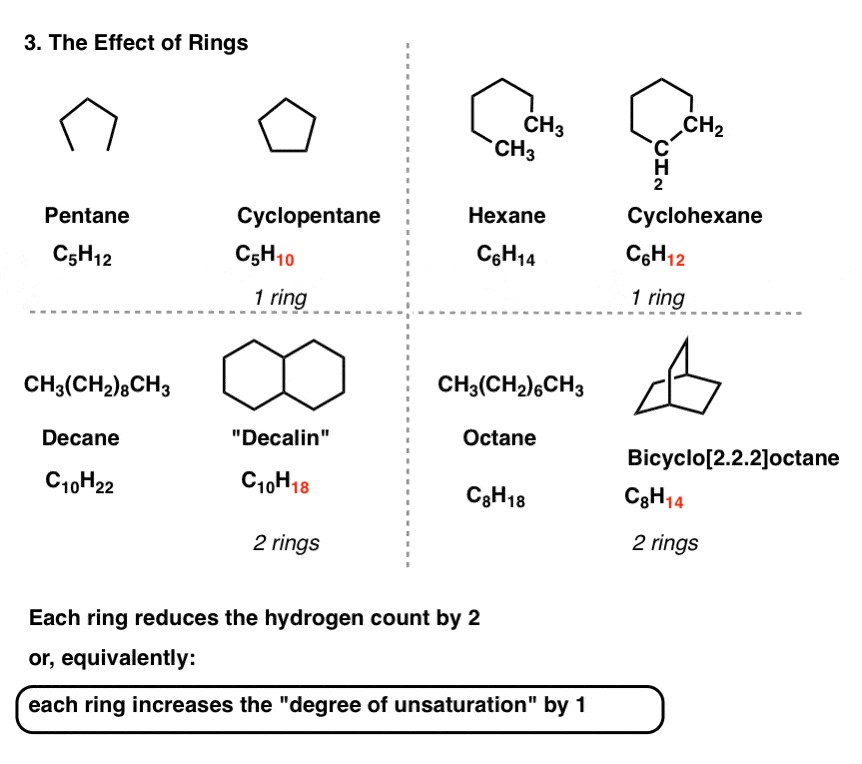
تو باید! هر حلقه در مولکول تعداد هیدروژن ها را دو برابر کاهش می دهد.
5. هر حلقه یا پیوند دوگانه “درجه اشباع” نامیده می شود
از این رو، هر حلقه یک “درجه غیر اشباع” را به مولکول وارد می کند.
ممکن است بپرسید: اگر ما یک مولکول با حلقه داشته باشیم چه؟ و اوراق قرضه چندگانه؟ خودت ببین.
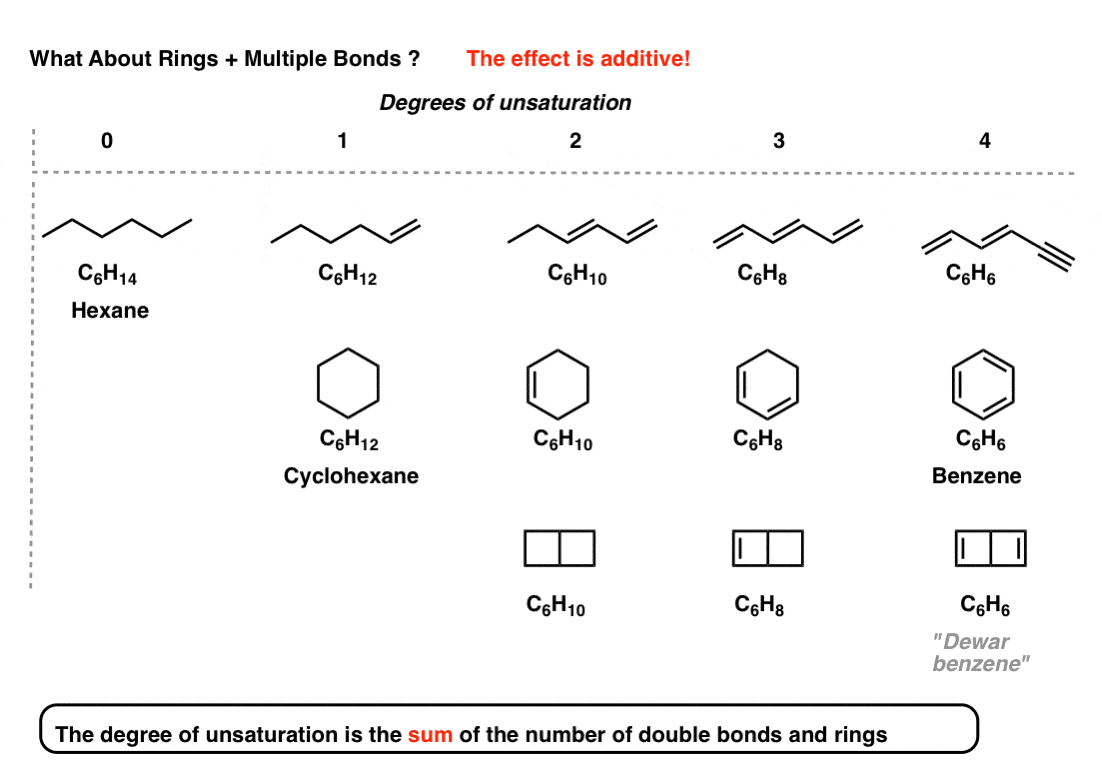
اثر افزودنی است. یعنی “درجات غیر اشباع” است مجموع از تعداد پیوندها و حلقه های دوگانه.
توجه داشته باشید که به شما نمی گوید چند پیوند دوگانه وجود دارد یا چند حلقه وجود دارد. صرفاً مجموع آنها را به شما می گوید.
6. مثال: بنزن (4 درجه غیر اشباع)
به عنوان مثال، بنابراین فرمول مولکولی C6اچ6 (4 درجه غیر اشباع) توسط مولکول ها با
- پیوندهای 4 پی
- 3 پیوند پی و یک حلقه (بنزن)
- دو پیوند پی و دو حلقه (دیوار بنزن بسیار ناپایدار، سنتز شده در سال 1963)
- یک پیوند پی و سه حلقه (بنزوالن حتی ناپایدارتر، یک ماده منفجره تماسی، که در سال 1971 سنتز شد)
- و بله، حتی پیوندهای صفر پی و چهار حلقه (پریسمان، سنتز شده در سال 1973).
[Historical side note: the formula of benzene was known to be C6H6 from Michael Faraday in 1825, but the correct structure was not proposed until 1865 (Kekule) and not confirmed until 1929, by Catherine Lonsdale’s X-ray studies . Just a reminder that knowing the molecular formula only gets you so far. ]
نکته مفید: اگر 4 درجه غیراشباع در یک مولکول ناشناخته مشاهده کردید، فکر کردن به “حلقه بنزن” نقطه خوبی برای شروع است.
7. مولکول های حاوی اکسیژن چطور؟
تا اینجای کار خیلی خوبه. بیایید ادامه دهیم. در مورد مولکول های دارای اکسیژن چطور؟
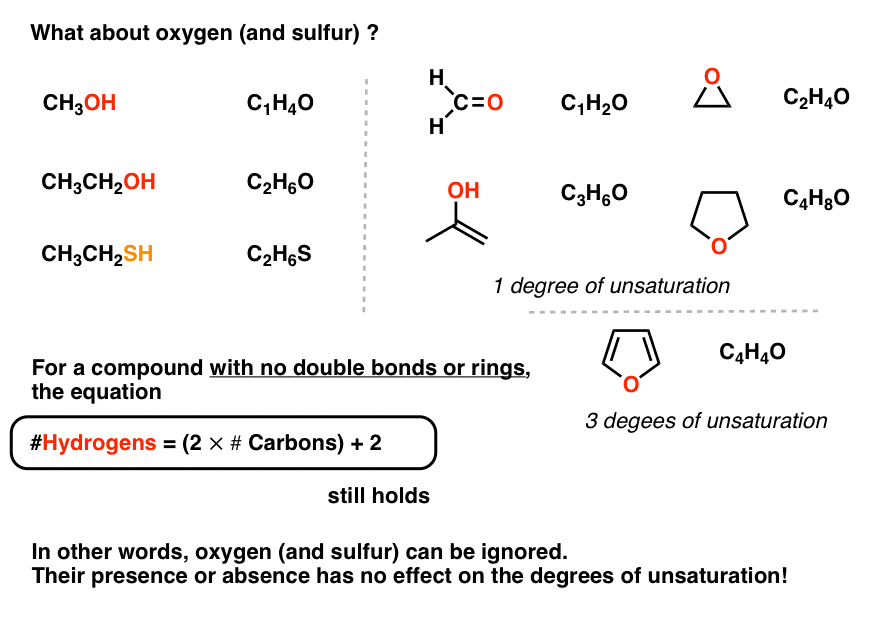
همین قوانین اعمال می شود! ما میتوانیم تعداد هیدروژنها را از روی تعداد کربنها محاسبه کنیم، گویی که اکسیژن وجود ندارد.
توجه داشته باشید که پیوند π حاوی اکسیژن همچنان به عنوان “درجه اشباع نشدن” به حساب می آید (به فرمالدئید، CH مراجعه کنید.2O).
8. در مورد هالوژن ها چطور؟
خوب. در مورد هالوژن هایی مانند کلر، فلوئور، ید و برم چطور؟
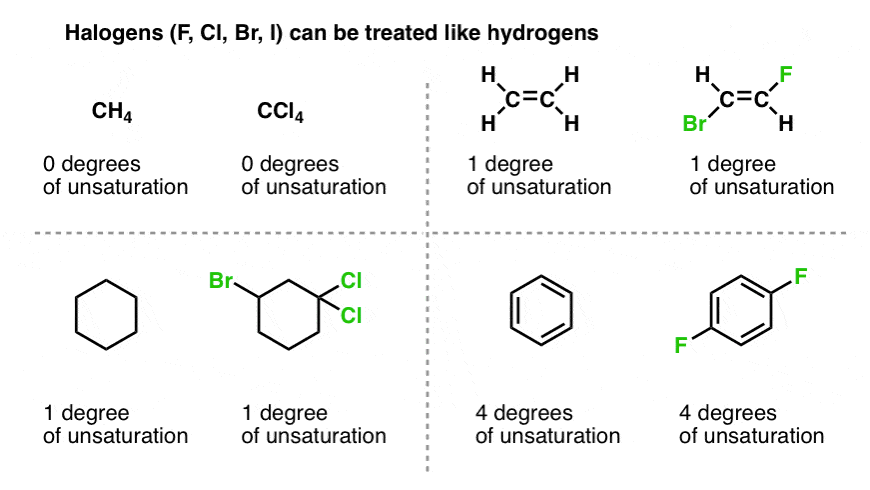
برای اهداف فرمول ما که هیدروژن ها را به کربن ها برای مولکول های بدون حلقه یا پیوند دوگانه مرتبط می کند، هالوژن ها را می توان به عنوان هیدروژن شمارش کرد. یعنی تتراکلرید کربن (CCl4) دارای درجات غیراشباع (صفر) مشابه CH است4.
بنابراین می توانیم معادله یک مولکول بدون پیوند دوگانه یا حلقه را به صورت زیر تغییر دهیم:
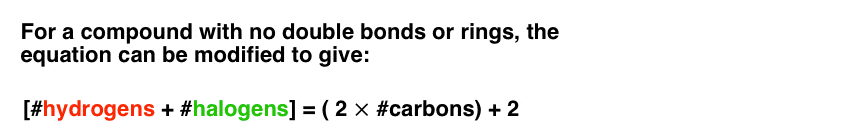
9. نیتروژن کمی مشکل است
ما نیتروژن را برای آخرین بار ذخیره کرده ایم، زیرا کمی عجیب است. سعی کنید الگوی تأثیر نیتروژن بر فرمول ما را ببینید.
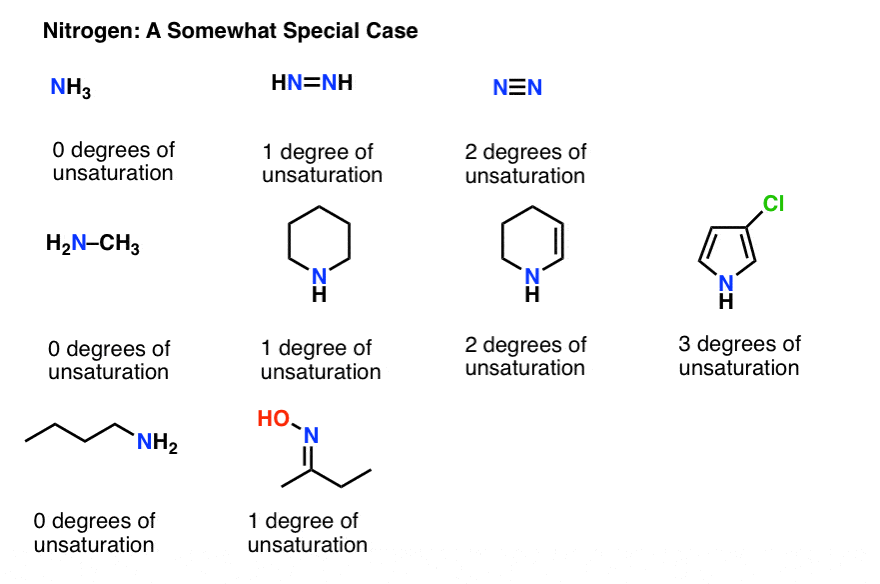
خوب، ممکن است متوجه شده باشید ما نمیتوانیم مانند اکسیژن، نیتروژن را نادیده بگیریم.
راه کار کردن معادله با نیتروژن این است که تعداد نیتروژن را به سمت راست معادله اضافه کنید، مانند زیر:
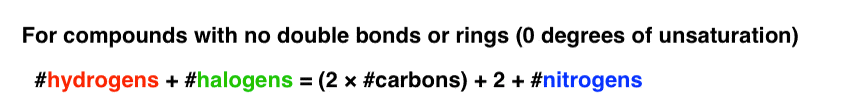
آن را با کاداورین امتحان کنید (C5اچ14ن2) که فاقد پیوند یا حلقه دوگانه است.
10. فرمول یکپارچه برای درجات غیر اشباع
تا کنون معادله ما فقط برای ترکیبات “اشباع” بدون پیوند دوگانه یا حلقه اعمال شده است.
چگونه می توانیم از این برای ایجاد یک فرمول کلی برای “درجات غیر اشباع” استفاده کنیم که در واقع … مفید است؟
زمان ریاضی. اگر سمت چپ را به سمت راست ببریم به این می رسیم:
![]()
صفر برابر با درجات اشباع نشدن در این حالت است.
اگر یک پیوند یا حلقه دوگانه معرفی کنیم، معادله “2” را برمیگرداند.

هر درجه متوالی غیر اشباع این عدد را 2 افزایش می دهد. به عنوان مثال، 2-کلروپیریدین C5اچ4NCl به ما 8 می دهد:

حالا 8 درجه اشباع نیست. این فقط تعداد هیدروژنهایی است که از آلکان غیر حلقوی مربوطه با همان تعداد کربن «مفقود شده» هستند.
برای اینکه این معادله درجات واقعی عدم اشباع را به ما بدهد، ما باید همه چیز را بر دو تقسیم کنیم.
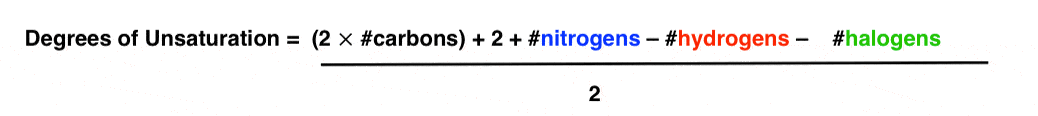
ما واقعاً میتوانیم با استفاده از نمادهای H، C، N و X برای نشان دادن هیدروژنها، کربنها، نیتروژنها و هالوژنها چیزها را متراکم کنیم.
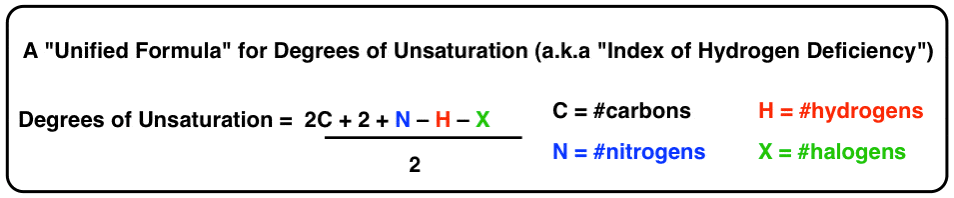
این شکل نهایی ما برای معادله “درجات غیر اشباع” یا “شاخص کمبود هیدروژن” در صورت تمایل است.
11. استفاده از فرمول IHD در چهار مثال واقعی
خوب، حالا برای نمونه های واقعی که در بالا ذکر کردم.
- سی9اچ8O4
- سی21اچ30O2
- سی17اچ21نO4
- سی11اچ15نO2
بیایید هر یک از آنها را به فرمول خود متصل کنیم. شما باید دریافت کنید:
- سی9اچ8O4 [6 degrees of unsaturation]
- سی21اچ30O2 [7 degrees of unsaturation]
- سی17اچ21نO4 [8 degrees of unsaturation]
- سی11اچ15نO2 [5 degrees of unsaturation]
حالا بیایید به هر یک از مولکول ها نگاه کنیم. متوجه خواهید شد که درجات غیراشباع محاسبه شده با مجموع آن مطابقت دارد [multiple bonds and rings] در مولکول
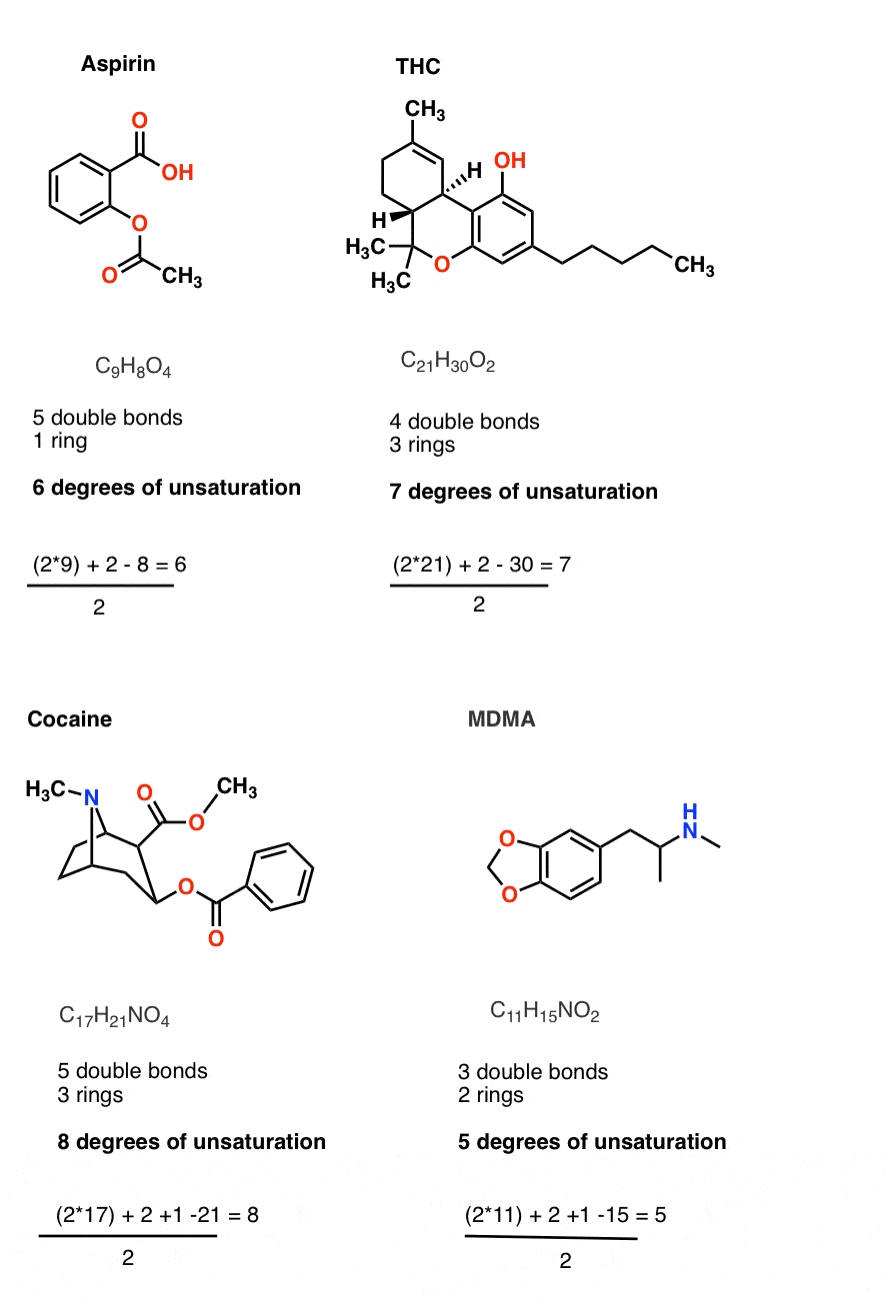
فوق العاده مفید فوق العاده آسان.
با ساختاری که در مقابل شما قرار دارد به نظر واضح می رسد. اما اگر با ناشناختهای سر و کار دارید، میتواند بسیار مفید باشد، همانطور که در پست گذشته در مورد هورمون غده تارسال گوزن دیدیم.
در پست بعدی شروع به کندوکاو در رازهای طیف سنجی می کنیم. ما با یکی از سادهترین تکنیکهای طیفسنجی – طیفسنجی UV-Vis – شروع میکنیم و نشان میدهیم که چگونه میتوان از آن برای ارائه سرنخهایی درباره ساختار مولکولهای مختلف استفاده کرد.
