ما در پست های قبلی زمان زیادی را صرف “ساختن” و ترسیم اوربیتال های مولکولی برای گونه های مختلف کرده ایم. در این پست ما یک میانبر بسیار مفید را یاد خواهیم گرفت که به ما کمک می کند سطوح انرژی سیستم های چرخه ای pi را ترسیم کنیم. فوق العاده سریع.
این ترفند “دایره های یخبندان” یا گاهی اوقات “روش چند ضلعی” نامیده می شود.
فهرست مطالب
- اوربیتال های مولکولی بنزن را می توان بر روی یک شش ضلعی قرار داد و راس آن به سمت پایین باشد.
- اوربیتالهای مولکولی سیکلوبوتادین را میتوان روی مربعی قرار داد که راس آن به سمت پایین باشد.
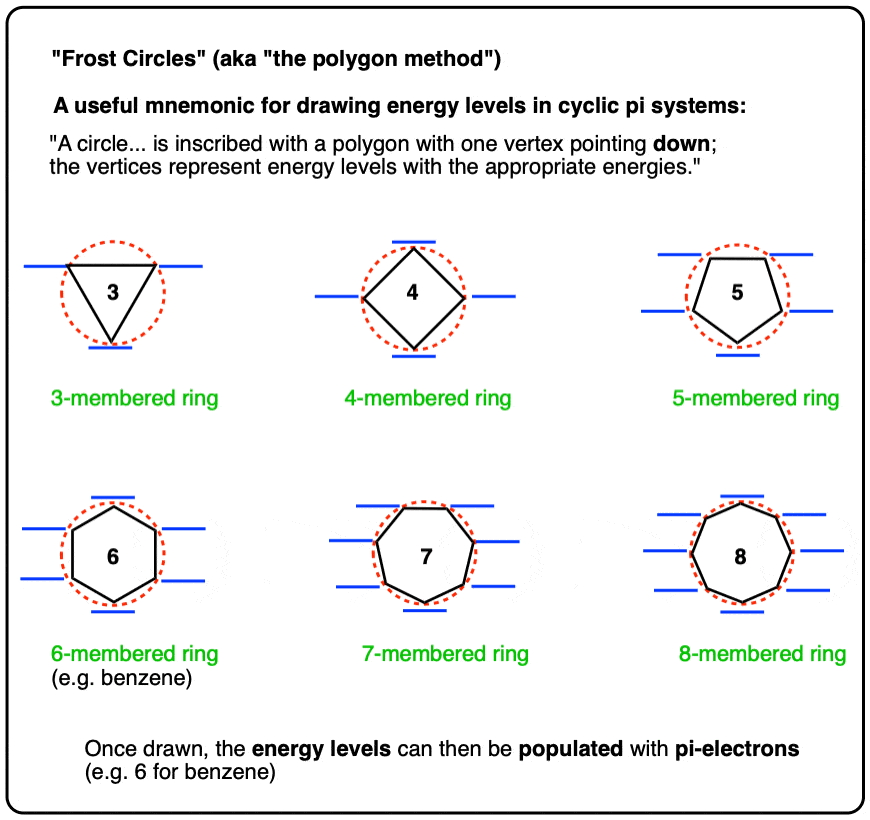
- دایره های فراست (روش چند ضلعی): یادگاری مفید برای ترسیم سطوح انرژی در سیستم های چرخه ای Pi
- دایره های فراست برای حلقه های سه عضو
- دایره های فراست برای حلقه های چهار عضو
- دایره های فراست برای حلقه های پنج عضوی
- حلقه های شش نفره
- حلقه های هفت نفره
- حلقه های هشت نفره
- خلاصه: حلقه های فراست
- یادداشت
- (پیشرفته) مراجع و مطالعه بیشتر
1. اوربیتال های مولکولی بنزن را می توان بر روی یک شش ضلعی قرار داد که راس آن به سمت پایین باشد.
اولین: به یاد بیاورید که ما شاهد بودیم که سطوح انرژی اوربیتال های مولکولی بنزن به شکل زیر است:
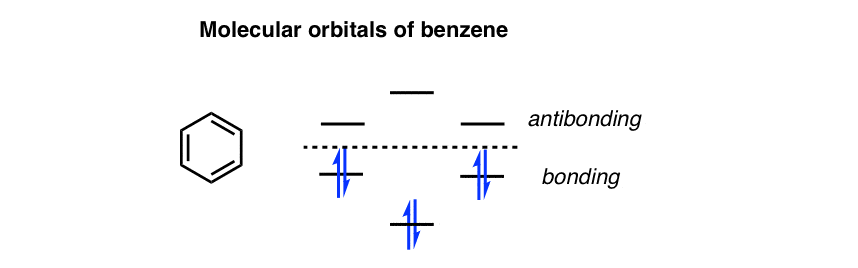
مشاهده مفید: این سطوح انرژی را می توان روی یک شش ضلعی قرار داد که راس آن به سمت پایین باشد. مثل این!
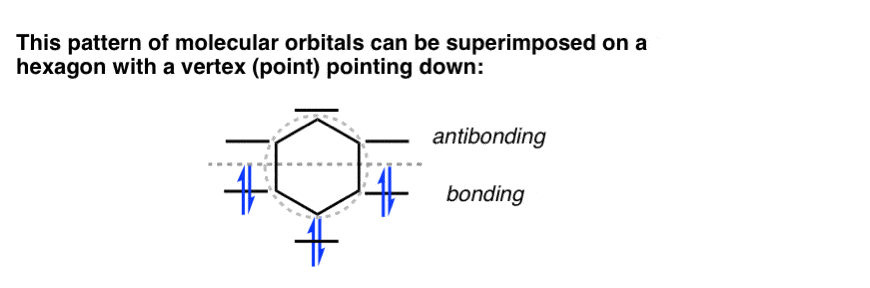
یکی دیگه انجام بدیم
2. اوربیتالهای مولکولی سیکلوبوتادین را میتوان روی مربعی قرار داد که راس آن به سمت پایین باشد.
ما دیدیم که اوربیتال های مولکولی سیکلوبوتادین چگونه به نظر می رسند. دو بالاترین سطح انرژی هرکدام به تنهایی اشغال شده اند (و بدون اتصال، برای راه اندازی) که به توضیح اینکه چرا سیکلوبوتادین بسیار دیدنی است کمک می کند. ناپایدار.
سطوح انرژی برای سیکلوبوتادین را می توان بر روی a قرار داد الماس، که فقط یک نام فانتزی برای مربعی است که راس آن به سمت پایین است.
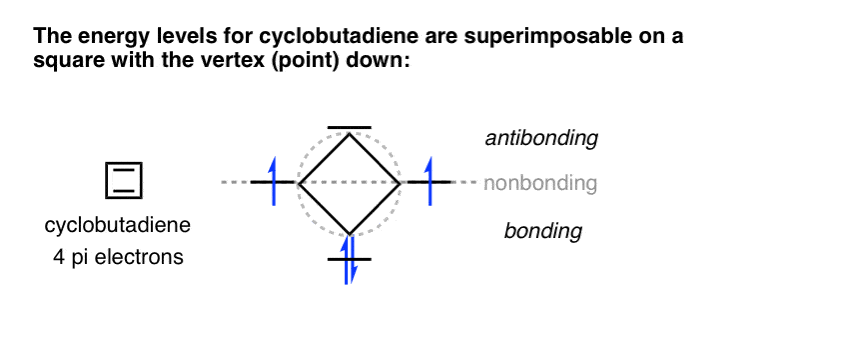
خیلی باحاله شاید تعجب کنید…. برای چند ضلعی های دیگر هم کار می کند؟
3. دایره های فراست (روش چند ضلعی): یادگاری مفید برای ترسیم سطوح انرژی در سیستم های چرخه ای Pi
در واقع این کار را می کند. در سال 1953، فراست مقاله ای را منتشر کرد که در آن این روش برای ترسیم سطوح انرژی در سیستم های چرخه ای را با نسخه ساده شده به شرح زیر توصیف کرد. [Note 1]
یک دایره… با یک چند ضلعی با یک راس رو به پایین حک شده است. رئوس نشان دهنده سطوح انرژی با انرژی های مناسب است.
رئوس زیر خط نیمه راه دایره در نظر گرفته می شود اوربیتال های پیوندی، و رئوس بالای خط نیمه در نظر گرفته می شوند اوربیتال های ضد پیوند. اگر رئوس دقیقاً در وسط باشند (همانطور که برای حلقه های 4 و 8 عضوی هستند) نشان دهنده اوربیتال های غیر پیوندی.
این ایده در نمودار زیر برای حلقه های 3، 4، 5، 6، 7 و 8 عضو ارائه شده است:
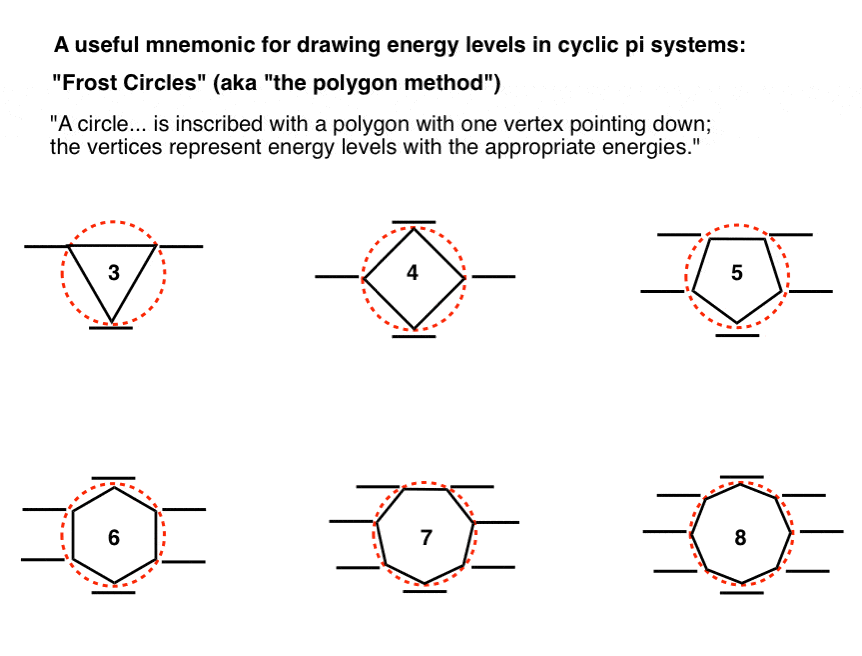
این یک یادگاری بسیار مفید است! این کار ما را در ساخت سطوح انرژی از پایه صرفه جویی می کند.
برای رسم اوربیتال های مولکولی یک سیستم pi حلقوی، تنها کاری که باید انجام دهیم این است که چند ضلعی مناسب را رسم کنیم، راس به پایین، و سپس آن را با الکترون پر کنیم..
بیایید ببینیم چگونه میتوانیم این «دایرههای فراست» را برای حلقههای ۳، ۴، ۵، ۶، ۷ و ۸ عضوی اعمال کنیم. (اگرچه از ترسیم دایره های واقعی صرف نظر می کنیم و فقط روی موقعیت اوربیتال ها تمرکز می کنیم).
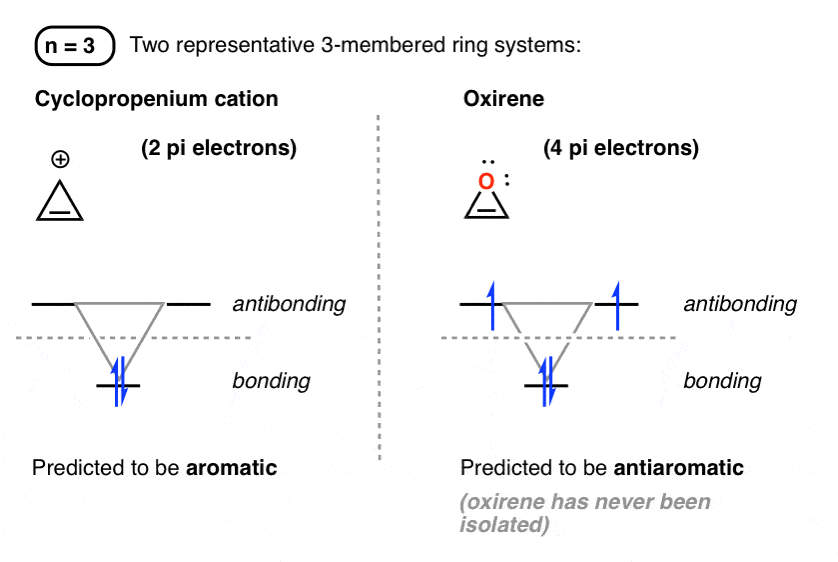
4. دایره های فراست برای حلقه های سه عضوی
بسته به تعداد الکترونهای پی، دو پیکربندی مهم از سطوح انرژی برای سیستمهای سه عضوی pi حلقوی وجود دارد.
با دو الکترون پی، ما انتظار داریم که یک معطر مولکول یک مثال کاتیون سیکلوپروپنیوم (در پایین سمت چپ) است که در واقع معطر است.
با 4 الکترون پی، یک مولکول ضد آروماتیک انتظار می رود. Oxirene (در پایین سمت راست) که هرگز جدا نشده است، در این دسته قرار می گیرد.
5. دایره های فراست برای حلقه های چهار عضو
سیکلوبوتادین در بالا و در آخرین پست توضیح داده شد. توجه داشته باشید که نمودار اوربیتال مولکولی پیشبینی میکند که اگر دو عدد از الکترونهای پی را جدا کنید، دی کاتیون سیکلوبوتن حاصل باید آروماتیک باشد. (در واقع داروهای سیکلوبوتن جایگزین شده توسط گروهی از افراد قابل تخمین، جورج اولاه، سنتز شده و معطر هستند) [Note 2]
6. دایره های فراست برای حلقه های پنج عضوی
سیستمهای چرخهای 5 عضوی pi با الکترونهای 6 پی آروماتیک پیشبینی میشوند. نمونه ها فراوان است. مانند آنیون سیکلوپنتادینیل (در پایین سمت چپ)، فوران (پایین سمت راست)، پیرول، تیوفن، ایمیدازول و بسیاری دیگر. و بله، آرسل ها نیز معطر هستند، اما احتمالاً نیازی به این نداشتید که من به شما بگویم.
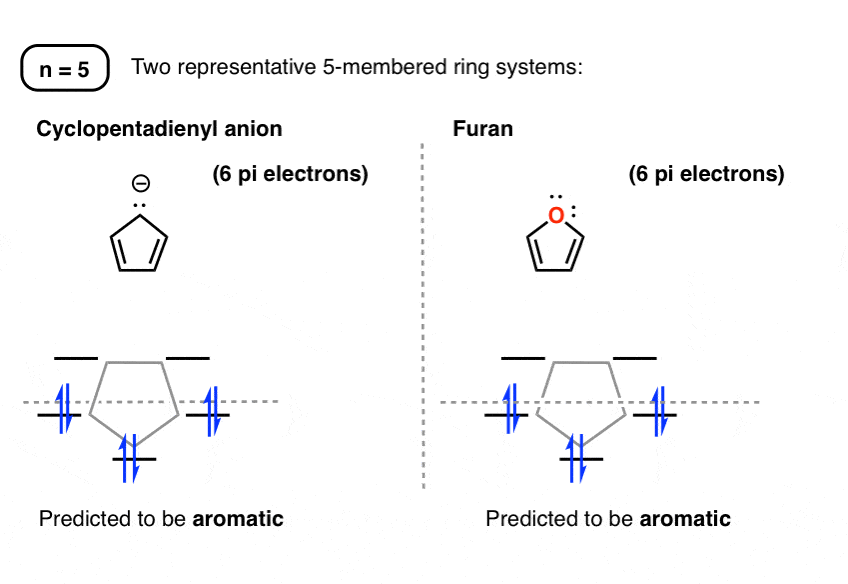
اگرچه در اینجا کشیده نشده است، حذف الکترون های 2 پی منجر به یک سیستم ضد آروماتیک می شود. کاتیون سیکلوپنتادینیل یک نمونه کلاسیک است.
7. حلقه های شش نفره
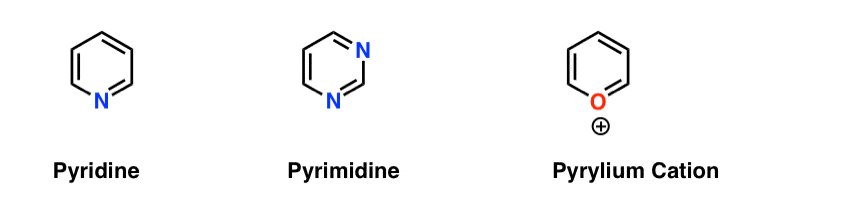
قبلاً در بالا توضیح داده شده است – اما توجه داشته باشید که قوانین را می توان نه تنها برای بنزن، بلکه برای “هتروسیکل ها” (یعنی حلقه های معطر با حداقل یک اتم حلقه غیر کربنی) مانند پیریدین، پیریمیدین و حتی “کاتیون پیریلیم” نیز اعمال کرد.
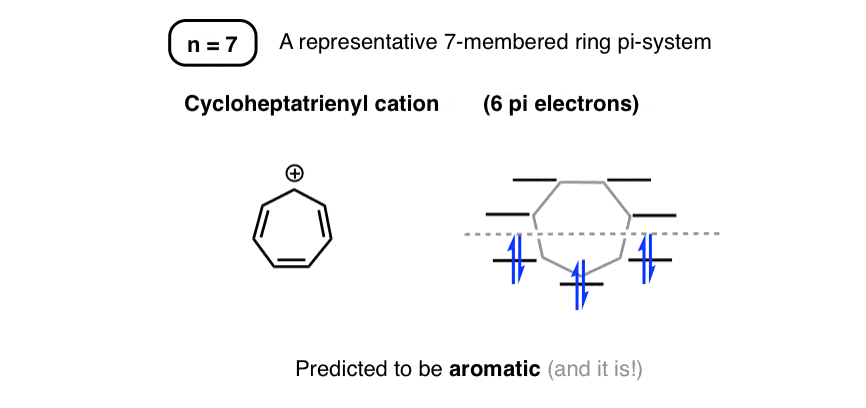
8. حلقه های هفت نفره
سیستمهای چرخهای 7 عضوی pi با الکترونهای 6 پی آروماتیک پیشبینی میشوند.
برای حلقه ای که به طور کامل از اتم های کربن تشکیل شده است، این مربوط به کاتیون سیکلوهپتاترینیل (گاهی اوقات به عنوان “یون تروپیلیوم” شناخته می شود).
ما عادت کردهایم کربوکاتیونها را واسطههای ناپایدار با طول عمر کوتاه بدانیم. اما یون تروپیلیوم معطر آنقدر نمک پایدار است که می توانید آن را در یک بطری قرار دهید. آلدریچ آن را می فروشد.
روش دایره فراست سطوح انرژی یون تروپیلیوم را به ما می دهد:
9. حلقه های هشت نفره
با 8 الکترون پی، سیکلواکتاتتران ضد آروماتیک پیشبینی میشود و اوربیتالهای مولکولی آن به شکل زیر پیشبینی میشود:
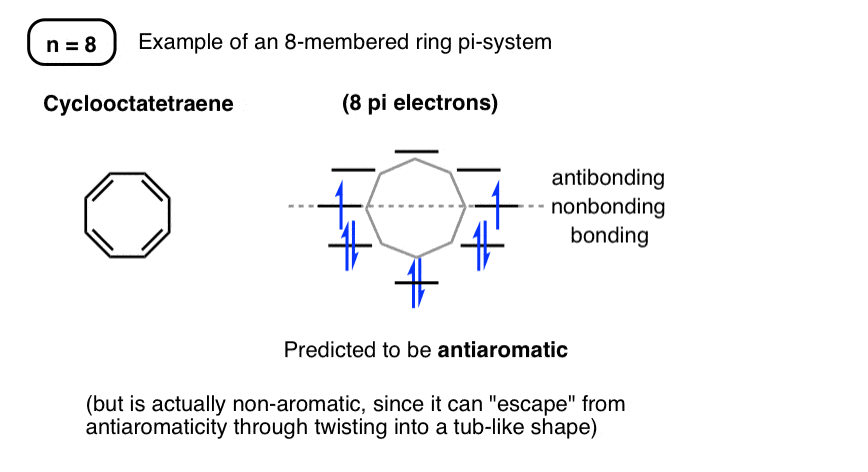
با این حال، اگر پست قبلی در مورد ضد رایحه را بخوانید، به یاد خواهید آورد که سیکلواکتاتتران می تواند با اتخاذ یک شکل وان مانند از ضد آروماتیک بودن فرار کند. بنابراین، سطوح مداری مولکولی که ما از روش چندضلعی پیشبینی میکنیم، دقیقاً با سطوح انرژی واقعی خود سیکلواکتاتتران مطابقت ندارد – برای مثال، این یک رادیکال نیست.
با این حال، این کاملاً پایان داستان نیست. درست همانطور که سیکلوبوتادین ضد آروماتیک را می توان از طریق حذف دو الکترون معطر ساخت، پایداری سیکلواکتاتتران (از لحاظ نظری ضد آروماتیک) نیز می تواند با حذف یا اضافه کردن دو الکترون پی تنظیم شود تا به ترتیب 6 یا 10 پی الکترون به دست آید.
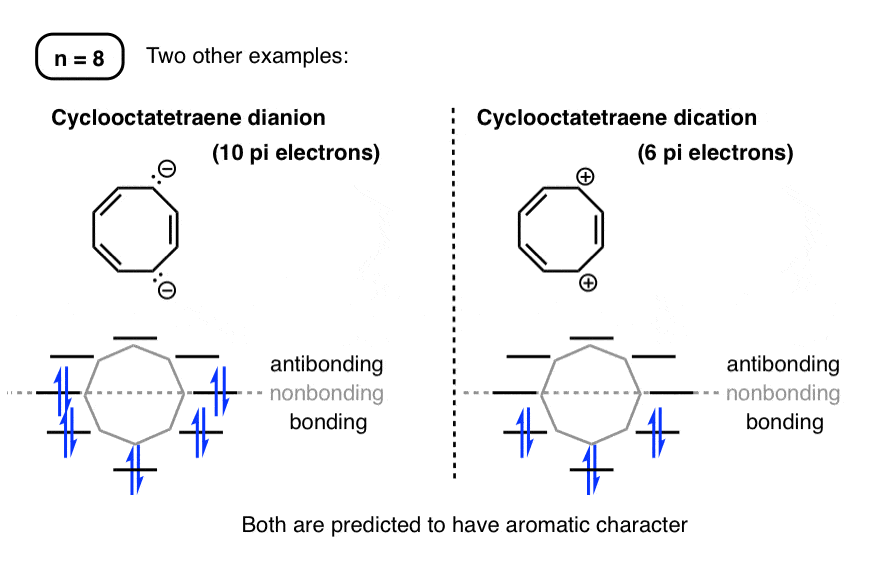
بستگان شیمیایی (“مشتقات”) سیکلوکتاتتران (6 الکترون پی) و سیکلواکتاتتران دیانیون (الکترون 10 پی) سنتز شده اند و مشخص شده اند که دارای خصوصیات آروماتیک هستند.
بنابراین ما پیش بینی می کنیم که این مولکول ها هستند مسطحبر خلاف خود سیکلواکتاتتران. [In fact, this has been confirmed for the cyclooctatetraene dianion by X-ray crystallography – reference]
10. خلاصه: حلقه های فراست
در حالی که هیچ پایانی برای چیزهای جالب در مورد معطر بودن وجود ندارد (هموآروماتیک، کسی هست؟) این پست درمان ما را در حال حاضر به پایان می رساند.
در سری بعدی مقالات، در نهایت به بحث در مورد واکنشهای ترکیبات معطر میپردازیم، که با مهمترین نوع واکنش آغاز میشود: جایگزینی معطر الکتروفیل.
با تشکر فراوان از Matt Knowe برای کمک به این مقاله.
یادداشت
یادداشت 1. نسخه پیچیده تر این است:
دایره ای با مرکز α با شعاع 2β با چند ضلعی با یک راس رو به پایین حک شده است. رئوس نشان دهنده سطوح انرژی با انرژی های مناسب است
ممکن است بپرسید این اصطلاحات “α” و “2β” چیست؟ پاسخ فراتر از محدوده آن چیزی است که در اینجا بحث خواهیم کرد، اما ماهیت این است که آنها اصطلاحات مهمی در روش مداری مولکولی هوکل هستند، راهی برای ساده کردن معادله موج شرودینگر برای سیستم های پی با استفاده از الکترون های پی و الکترون های سیگما به طور جداگانه. این یک روش قدرتمند و مفید برای محاسبه انرژی سیستم های pi و درک واکنش آنها است.
تبصره 2. با این حال، پایداری ناشی از آروماتیک بودن در سیکلوبوتادین باید بطور قابل توجهی کاهش یابد، با این حال، توسط دافعه کولمبی ناشی از ماهیت دی کاتیونی مولکول (در نهایت مانند بارها دفع می شود). به طور مشابه، پایداری ناشی از آروماتیک بودن دیانیون سیکلواکتاتتران تا حدودی با دفع دو بار منفی آن کاهش می یابد.
(پیشرفته) مراجع و مطالعه بیشتر
سنتز و جداسازی سیکلواکتاتتران دیانیون:
- CYCLOÖCTATETRAENYL DIANION
توماس جی. کاتز
مجله انجمن شیمی آمریکا 1960 82 (14)، 3784-3785
DOI: 10.1021/ja01499a077
در این مقاله پروفسور توماس کاتز از دانشگاه کلمبیا نشان می دهد که چگونه می توان دیانیون سیکلواکتاتتران را با کاهش سیکلواکتاتتران با دو معادل فلز پتاسیم تهیه کرد. -
ساختار 10.pi. الکترون سیکلواکتاتتران دیانیون در دیگلیم پتاسیم 1،3،5،7-تترمتیل سیکلواکتاتتران دیانیون، [K((CH3OCH2CH2)2O)]2[C8H4(CH3)4]
استفن زی گلدبرگ، کنت ان. ریموند، کالیفرنیا هارمون و دیوید اچ تمپلتونمجله انجمن شیمی آمریکا 1974 96 (5)، 1348-1351
DOI: 10.1021/ja00812a015
این اثر 1974 اولین ساختار بلوری منتشر شده از دیانیون سیکلواکتاتتران را دارد و نشان میدهد که واقعاً مسطح است و دارای ویژگیهای ساختاری سازگار با آروماتیک بودن است. - Cyclooctatetraene Dianion رایگان: مسطح بودن، آروماتیک بودن، و چالش های نظری
الکساندر یو. سوکولوف، دی. براندون ماگرز، جودی آی وو، وسلی دی. آلن، پل در برابر آر. شلایر، و هنری اف. شفر، سوم
مجله تئوری و محاسبات شیمی 2013 9 (10)، 4436-4443
DOI: 10.1021/ct400642y
سیکلواکتاتتران نیز همینطور است در حقیقت معطر؟ این مقاله نشان می دهد که در حالی که دیانیون سیکلواکتاتتران دارای تثبیت رزونانس قابل توجهی است (25 کیلو کالری در مول، در مقابل حدود 33 کیلوکالری در مول برای بنزن)، این تثبیت توسط دفع کولمبی آنیون ها غرق می شود، و همانطور که توسط مفسر Frosty the Circle اشاره شده است: مانند بسیاری از آنیونهای باردار چند برابر، COT2- تنها بهصورت مجزا وجود دارد… بهعنوان یک حالت رزونانس کوتاهمدت که در بالای COT خنثی قرار دارد.» «…. کمپلکس جبرانکننده بار COT2- با دو کاتیون سدیم منجر به یک ترکیب Na2COT پایدار از نظر ترمودینامیکی میشود».
