روابط پادپرپلانار بین CH و گروه ترک: حلقههای واکنش E2 و سیکلوهگزان
در اینجا ما به یک بسیار می رسیم قابل آزمایش کاربرد واکنش E2 – نحوه رسم محصولات واکنش های E2 در حلقه های سیکلوهگزان!
فهرست مطالب
- در واکنش E2، گروه ترک همیشه “ضد دور صفحه” نسبت به هیدروژنی است که روی کربن مجاور حذف می شود (“بتا کربن”)
- در حلقههای سیکلوهگزان، واکنشهای E2 فقط زمانی رخ میدهد که گروه خروجی محوری باشد.
- در واکنشهای E2 حلقههای سیکلوهگزان، تنها راهی که گروه خروجی و باند CH میتوانند ضد دور صفحه باشند این است که در وجههای مخالف حلقه قرار گیرند.
- چند مثال: محصول اصلی E2 در هر مورد چه خواهد بود؟
- جایگزینهای سیکلوهگزان میتوانند بر سرعت واکنشهای حذف E2 در حلقههای سیکلوهگزان تأثیر بگذارند.
- هر چه غلظت کنفورمر با گروه خروجی محوری بیشتر باشد، حذف سریعتر خواهد بود.
- یادداشت
- (پیشرفته) مراجع و مطالعه بیشتر
1. در واکنش E2، گروه خروجی همیشه “ضد دور صفحه” نسبت به هیدروژنی است که روی کربن مجاور حذف می شود (یعنی “بتا کربن”)
آخرین بار ما واکنشهای E1 و E2 را با هم مقایسه کردیم و یکی از تفاوتهای کلیدی را در استریوشیمی واکنش E2 ذکر کردیم. به یاد داشته باشید که در E2، گروه ترک همیشه “ضد” هیدروژنی است که روی کربن مجاور حذف می شود. [That means that they’re directly opposed to each other, or 180°; kind of like the minute hand and the hour hand when a clock reads 6:00].
این یک جزئیات بسیار مهم است که بتوان آن را در واکنش ها اعمال کرد.
2. در حلقههای سیکلوهگزان، واکنشهای E2 فقط زمانی رخ میدهد که گروه خروجی محوری باشد.
یکی از راه هایی که اغلب مطرح می شود، بحث در مورد حلقه های سیکلوهگزان است. اگر به خاطر داشته باشید، در ساختار صندلی سیکلوهگزان، گروه ها می توانند محوری (مستقیم به سمت بالا یا پایین) یا استوایی (با اشاره به “تا حدودی به بالا” یا “تا حدودی پایین” باشند.
برای اینکه یک هیدروژن “ضد” یک گروه ترک شود، لازم است که هر دو گروه محوری باشند. با دقت به حلقه سیکلوهگزان در سمت چپ نگاه کنید، جایی که گروه خروجی استوایی است – ببینید چگونه گروهی که “ضد” است پیوند CC است. [highlighed in red]?
آن E2 هرگز کار نخواهد کرد!
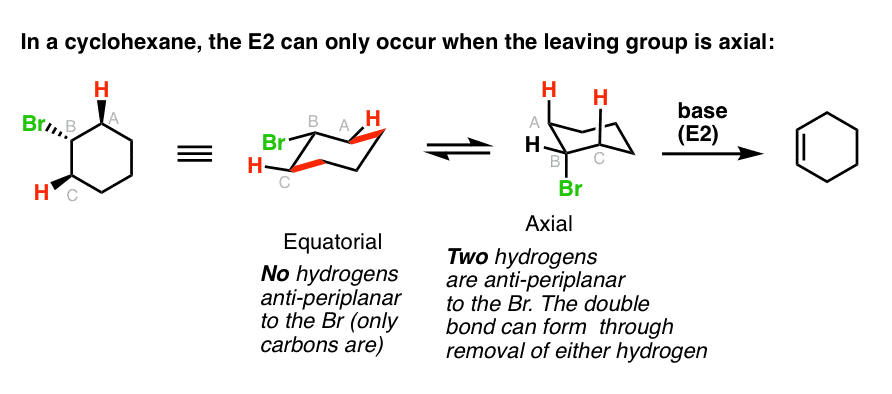
بنابراین اگر استوایی گروه خروجی را روی صندلی سیکلوهگزان بکشید، شما باید چرخاندن صندلی را انجام دهید تا گروه خروجی محوری باشد. این در مثال دست راست نشان داده شده است، جایی که E2 در واقع می تواند اتفاق بیفتد.
3. در واکنشهای E2 حلقههای سیکلوهگزان، تنها راهی که گروه خروجی و باند CH میتوانند ضد دور صفحه باشند این است که در وجههای مخالف حلقه قرار گیرند.
این ما را به نکته دوم می رساند. اگر گروه ترک، فرض کنید، روی “بالایی” سیکلوهگزان باشد، می توانید فقط در جایی که هیدروژن روی آن قرار دارد، یک آلکن به کربنهای مجاور تشکیل میدهند چهره مقابل
ممکن است مثال دفعه قبل را به خاطر بیاورید که در آن نتوانستیم آلکن “Zaitsev” را تشکیل دهیم زیرا Br یک گوه بود و یک گروه آلکیل روی کربن همسایه وجود داشت که در طرف مقابل قرار داشت. در این مورد ما فقط می توانیم آلکن کمتر جایگزین را تشکیل دهیم. با این حال، اگر گروه متیل تغییر کند، E2 برای دادن محصول Zaitsev ممکن می شود:
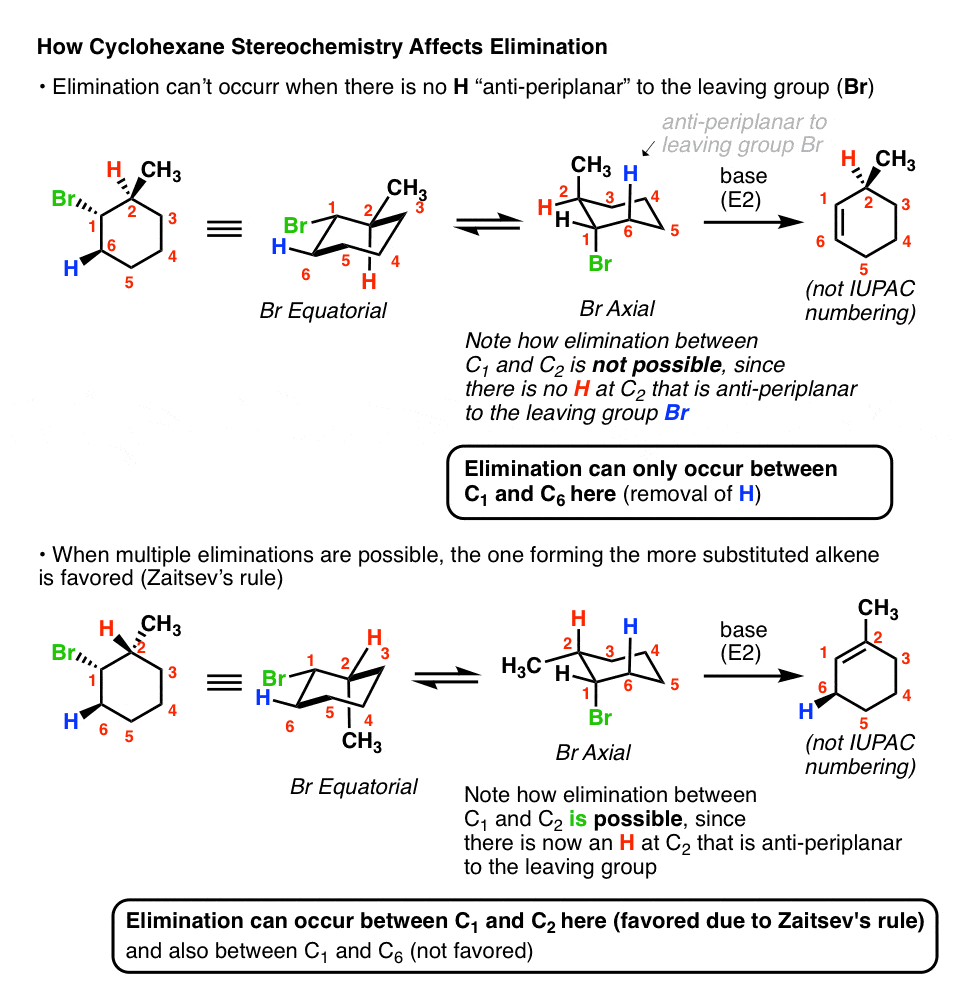
نکته اصلی اینجاست [and trust me, this comes up in tests, a lot!] این است که شما همیشه می خواهید به این نکته توجه کنید که گروه ترک شما در کدام سمت حلقه قرار دارد و مطمئن شوید که E2 که کشیده اید واقعاً امکان پذیر است.
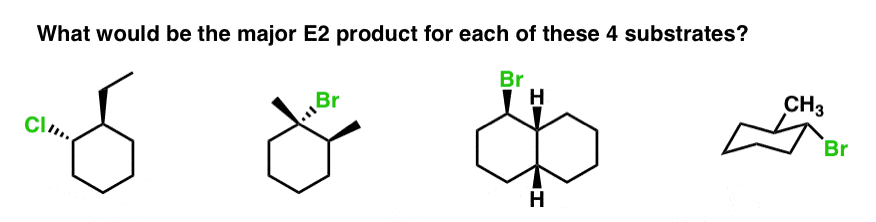
4. چند مثال: محصول اصلی E2 در هر مورد چه خواهد بود؟
در اینجا چند مثال دیگر برای فکر کردن وجود دارد. محصول اصلی E2 در هر مورد چه خواهد بود؟
اکنون، اجازه دهید در مورد یک کاربرد بسیار جالب از آنچه که قبلاً بحث کردیم صحبت کنیم. این کمی پیشرفتهتر است، اما ببینید آیا میتوانید آن را دنبال کنید. آن چیزی که در مورد E2 بحث کردیم را با آنچه قبلاً در مورد صندلی چرخدار سیکلوهگزان آموخته اید پیوند می دهد.
5. جایگزینهای سیکلوهگزان میتوانند بر سرعت واکنشهای حذف E2 در حلقههای سیکلوهگزان تأثیر بگذارند.
تصور کنید دو آلکیل هالید دارید و ساختارهای کمی متفاوت دارند. ما مشاهدات زیر را انجام می دهیم: E2 با ماده اولیه دوم به طور قابل توجهی سریعتر از E2 با محصول اول است. سوال: چرا ممکن است این باشد؟
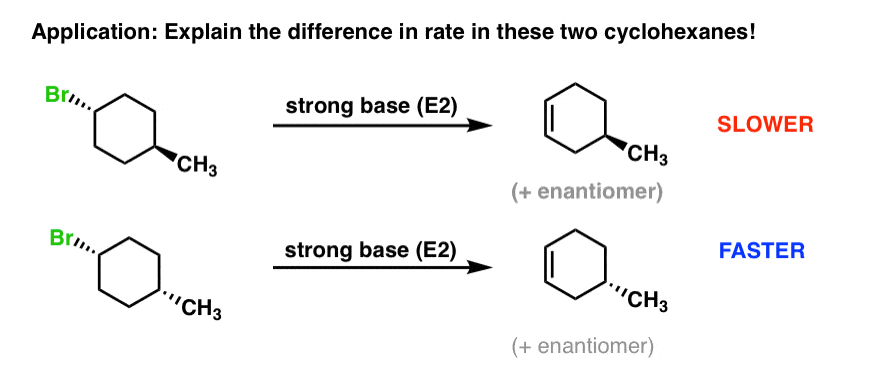
به منظور درک آنچه در جریان است، ترسیم اشکال صندلی سیکلوهگزان هر دوی این مولکول ها کمک خواهد کرد. پس بیایید این کار را انجام دهیم و سپس نگاهی دقیقتر بیندازیم.
چه خبر است؟ هر مولکول یک تعادل بین دو شکل صندلی خواهد داشت.
در مولکول بالا، ترکیب سمت چپ ترجیح داده می شود، زیرا گروه متیل حجیم* [CH3 is actually bulkier than Br] استوایی است. بنابراین تعادل به نفع مولکول دست چپ خواهد بود.
در مولکول پایین، سمت راست ترین ترکیب مطلوب است، زیرا گروه متیل حجیم استوایی است. بنابراین تعادل به نفع مولکول سمت راست خواهد بود.
6. هر چه غلظت کنفورمر با گروه خروجی محوری بیشتر باشد، حذف سریعتر خواهد بود.
به چیز جالب توجه کردید؟ به یاد داشته باشید که برای اینکه E2 رخ دهد، گروه خروج باید محوری باشد. بنابراین تنها یک ترکیب وجود دارد که در آن این امکان برای هر حلقه وجود دارد. با این حال، در مثال بالا، Br فقط در محوری است کمترین ثبات ساختار، در حالی که در مثال پایین، Br در حالت محوری است پایدارترین ساختار. از آنجایی که مثال پایین دارای یک خواهد بود غلظت بالاتر در جایی که Br محوری باشد، سریعتر خواهد بود.
جالب نیست چطور همه چیز به هم پیوند می خورد؟ مفاهیمی که در یک فصل یاد می گیرید می توانند برگردند و در فصل های بعدی به کار گرفته شوند!
در پست بعدی در مورد مثال دیگری صحبت خواهیم کرد که قانون زایتسف در آن اعمال نمی شود.
پست بعدی: پایه های حجیم در واکنش های حذف
یادداشت
پاسخ به سوال بالا:
(پیشرفته) مراجع و مطالعه بیشتر
- Abspaltungsreaktionen und ihr sterischer Verlauf
والتر هوکل، ورنر تاپه، گونتر لگوتکه
لیب ان شیمی. 1940، 543 (1)، 191-230
DOI: 10.1002/jlac.19405430117
مطالعه اولیه استریوشیمی E2 بر روی مشتقات منتیل. - مکانیسم واکنش های حذف قسمت هجدهم. سینتیک و دوره فضایی حذف از هگزاکلریدهای بنزن ایزومر
ED Hughes، CK Ingold، و R. Pasternak
جی. شیمی. Soc. 1953، 3832-3839
DOI: 10.1039/JR9530003832
نام این مقاله کمی گیج کننده است زیرا “بنزن هگزا کلرید” این کار را انجام می دهد نه رجوع به هگزاکلروبنزن شود، اما 1،2،3،4،5،6–هگزا کلرو سیکلوهگزان. همانطور که در مقاله توضیح داده شد، هگزا کلروسیکلوهگزان بسته به جهت اتم های کلر، چند ایزومر دارد. بسته به جهت گیری اتم های کلر در ایزومر، محصولات مختلفی به دست می آیند، بر این اساس که آیا یک مسیر E2 در آن موقعیت(ها) امکان پذیر است یا خیر. - مکانیسم های واکنش های حذف. X. تبادل دوتریوم در دیهیدروکلریناسیون مبتنی بر پایه بتا-بنزن هگزا کلرید
استنلی جی کریستول و دلبرت دی فیکس
مجله انجمن شیمی آمریکا 1953، 75 (11)، 2647-2648
DOI: 1021/ja01107a027
مطالعه کلاسیک ایزومرهای هگزا کلرو سیکلوهگزان – همه اتم های کلر روی اتم های کربن مجاور هستند ترانس به یکدیگر، بنابراین غیرممکن است که هیدروژن و کلر مجاور را به یک ضد رابطه بدون ایجاد فشار حلقه - مکانیسم واکنش های حذف قسمت نوزدهم. سینتیک و سیر فضایی حذف از کلریدهای منتیل ایزومر
ED Hughes، CK Ingold، و JB Rose
جی. شیمی. Soc. 1953، 3839-3845
DOI: 10.1039/JR9530003839
این مقاله قانون زایتسف را در یک سیستم سیکلوهگزان نشان می دهد. نئومنتیل کلرید 78% 3-منتن و 22% 2-منتن با EtO می دهد.– در اتانول - مکانیسم واکنش های حذف قسمت XXII. حذف غیرعادی از یون تری متیل نئومنتیلامونیوم
ED هیوز و جی. ویلبی
جی. شیمی. Soc. 1960، 4094-4101
DOI: 10.1039/JR9600004094
این مقاله به خوبی مفاهیم توضیح داده شده در این بخش را نشان می دهد. یون منتیلامونیوم نمی تواند برای تولید 3 الفین از بین برود، زیرا ضد موقعیت روی C4 توسط گروه ایزوپروپیل اشغال شده است. فقط 2-الفین از حذف با منتیل-LG (LG = گروه ترک، کلرید، تری متیل آمین و غیره) به دست می آید. که در نئومنتیل-LG، گروه ایزوپروپیل نیست ضدو بنابراین 3 الفین قابل دسترسی است. با این حال، بازده 3-الفین از 88٪ به 65٪ در هنگام EtO کاهش می یابد.– به جای OH استفاده می شود–و هنگام استفاده از پایه های حجیم تر (مثلا tBuO) احتمالاً کاهش بیشتری پیدا می کند–). - همسایگی کربن و هیدروژن. نوزدهم مشتقات t-Butylcyclohexyl. تحلیل ساختاری کمی
S. Winstein و NJ Holness
مجله انجمن شیمی آمریکا 1955، 77 (21)، 5562-5578
DOI: 10.1021/ja01626a037
این مقاله کلاسیک پروفسور وینستین است که مفهوم آن را معرفی می کند آ-ارزش های. اشاره مختصری به تأثیر جهت گیری محوری/استوایی گروه ترک بر واکنش پذیری وجود دارد. هنگامی که گروه خروجی محوری است، مسیر E2 مورد علاقه است، اما زمانی که گروه خروجی استوایی است، ترکیبی از E1 و Sن1 صورت می گیرد.
