افزودن اسید توانایی ترک گروه را افزایش می دهد
مطمئنا، تشخیص هالوژن ها (Cl، Br، و I) به عنوان دارای توانایی گروه ترک بالا، و همچنین توزیلات (TsO-) و mesylate (TsO-) یک چیز است، اما اگر یک گروه عملکردی مانند HO- داشته باشید چه؟ چگونه هیدروکسید دانگ را ترک می کنید؟ ادامه مطلب
فهرست مطالب
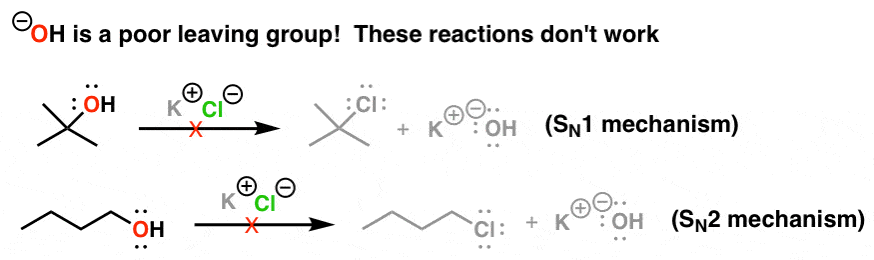
- بازهای ضعیف گروه های خروجی خوبی هستند – و یون هیدروکسید (-OH) گروه خروجی خوبی نیست
- افزودن اسید گروه ترک را از باز قوی (-OH) به باز بسیار ضعیف تر H تبدیل می کند.2O
- اسید مزدوج همیشه یک گروه ترک بهتر است
- هالوژن ها را می توان با افزودن اسیدهای لوئیس مانند یون نقره (Ag+) به گروه های ترک بهتر تبدیل کرد.
- یادداشت
1. بازهای ضعیف گروه های خروجی خوبی هستند – و یون هیدروکسید (-OH) گروه خروجی خوبی نیست
یکی از عوامل کلیدی که تعیین می کند آیا یک واکنش جایگزینی هسته دوست رخ خواهد داد یا نه، هویت گروه ترک است. قبلاً دیده بودیم که گروه های خوب ترک پایگاه های ضعیفی هستند (پست را ببینید: چه چیزی یک گروه خوب را ترک می کند؟)
این بدان معناست که اگر یک هالوژن (Cl، Br، یا I) یا یک توزیلات (OTs) یا Mesylate (OMs) روی مولکول خود مشاهده کردید، همه اینها کاندیدهای خوبی برای ترک گروه هستند، زیرا Cl(-)، Br(- )، I(-)، TsO(-)، و MsO(-) همگی بازهای ضعیف هستند.
مشکل اینجاست اگر یک گروه عاملی روی یک مولکول داشته باشیم که بخواهیم آن را در یک واکنش جانشینی مشارکت دهیم، اما این یک گروه ترک خوب مانند موارد ذکر شده در بالا نباشد، چه؟ به عنوان مثال، واکنش های ذکر شده در زیر کار نکن، زیرا گروه ترک (HO-) یک پایگاه قوی و در نتیجه یک گروه ترک ضعیف است.
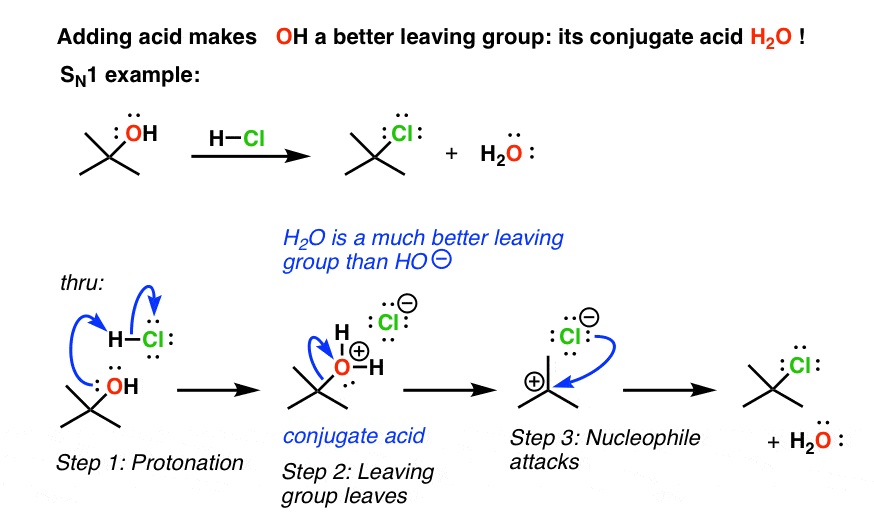
2. افزودن اسید، گروه ترک را از باز قوی (-OH) به باز بسیار ضعیف تر H تبدیل می کند.2O
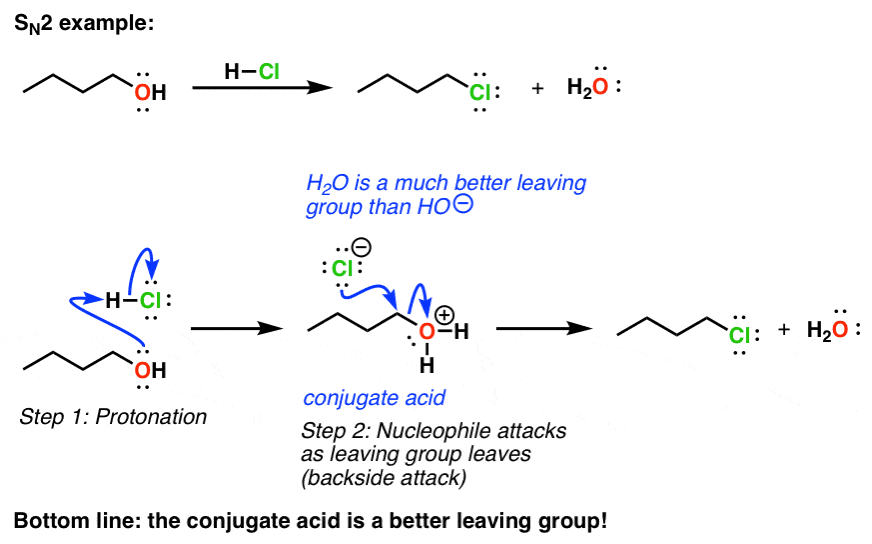
چه کاری می توانیم انجام دهیم تا OH (و سایر گروه های مشابه) را درگیر کنیم تا بتوانند در واکنش های جایگزینی شرکت کنند؟ خب، ما نیاز داریم که گروه خروجی مان پایگاه ضعیف تری باشد. چگونه آن را به پایگاه ضعیف تری تبدیل کنیم؟ با حذف مقداری از چگالی الکترونی آن. بهترین راه برای انجام این کار این است که آن را با اسید درمان کنید. این باعث می شود اسید مزدوج از گروه خروجی ما که یک خواهد بود پایه ضعیف تر و سپس این واکنش ها به خوبی پیش خواهد رفت.
اینجا یک S استن2 مثال:
3. اسید مزدوج همیشه یک گروه ترک بهتر است
برای قرار دادن تعدادی اعداد روی آن، اگر به pK نگاه کنیدآ جدول، خواهید دید که pKآ از اچ2O (آب) حدود 14 است (به پست مراجعه کنید: نحوه استفاده از یک pKآ جدول). پایه مزدوج آن HO(–) است. وقتی اسید اضافه می کنیم آب تبدیل به H می شود3O(+)، که دارای pK استآ از -1.7. به عبارت دیگر، این اسید بسیار قویتر است و بنابراین باز مزدوج آن (آب، H2O) است بسیار ضعیف تر. به عبارت دیگر، با افزودن اسید، آن را به یک گروه ترک بهتر تبدیل کرده ایم.
به هر حال، این یک پدیده عمومی است اسید مزدوج همیشه گروه ترک بهتری خواهد بود.
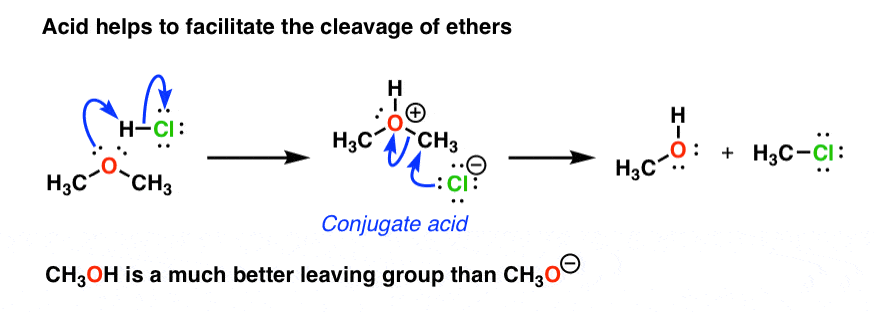
این نه تنها برای OH، بلکه سایر گروه های عملکردی نیز کاربرد دارد. برای مثال، اترها (R–O–R) برخی از غیر فعالترین گونههایی هستند که میبینید. با این حال، اگر یک اسید بسیار قوی به یک اتر اضافه کنید، می توانید آن را باز کنید تا یک الکل و یک آلکیل هالید ایجاد کنید:
4. هالوژن ها را می توان با افزودن اسیدهای لوئیس مانند یون نقره (Ag+) به گروه های خروجی بهتر تبدیل کرد.
ما می توانیم از این برای ساختن استفاده کنیم هالوژن ها بهتر است گروه ها را ترک کنند. هالوژن ها به آسانی الکل ها و اترها با H+ واکنش نشان نمی دهند، اما واکنش نشان می دهند انجام دادن با اسیدهای لوئیس خاصی واکنش نشان می دهد [remember – a Lewis acid accepts a lone pair]. یکی از اسیدهای لوئیس که با هالیدها توجه زیادی را به خود جلب می کند Ag+ (یون نقره) است.
ممکن است آن را به عنوان AgNO ببینید3 یا AgBF4 (ضد یون NO3(-) یا BF4(-) اینجا فقط یک تماشاگر است). هنگامی که Ag+ با هالوژنی مانند Cl ترکیب میشود، گونه R-Cl-Ag (+) پیوند C-Cl بسیار ضعیفتری دارد، به این معنی که بهتر میتواند در واکنشهای جایگزینی شرکت کند. با آلکیل هالیدهای ثانویه یا سوم، نتیجه معمولاً تشکیل یک کربوکاتیون است.
یک ترفند ساده این است که هالیدهای نقره در آب نامحلول هستند، بنابراین اگر آب به عنوان حلال انتخاب شود، از دست دادن AgCl است. غیر قابل برگشت. سپس کربوکاتیون توسط حلال آب به دام می افتد.
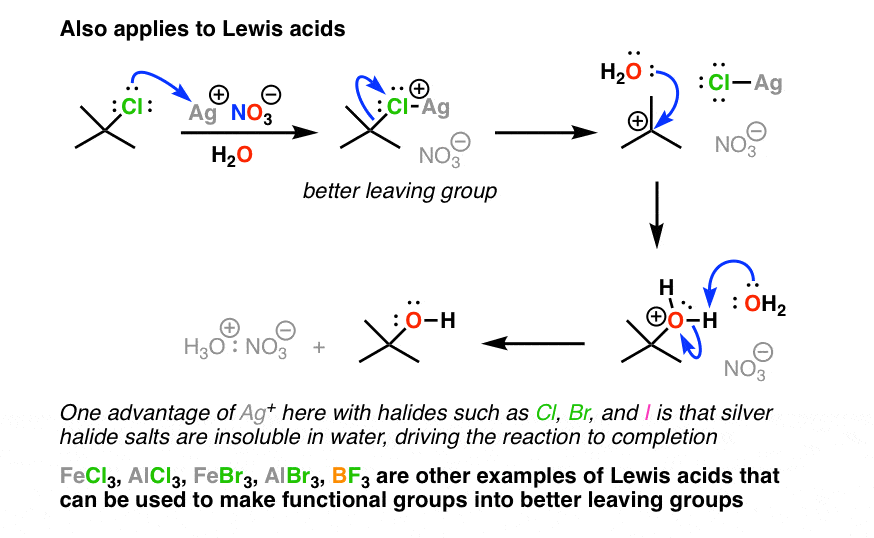
در نهایت، اینجا هنوز همان پدیده است. چه از یک اسید برونستد یا یک اسید لوئیس استفاده کنیم، اسید مزدوج همیشه گروه ترک بهتری استو اسید میتواند برای انجام واکنشهای جایگزینی با سرعتی بسیار سریعتر از آنچه در غیر این صورت انجام میشد مفید باشد.
در پست بعدی بیایید S را با هم مقایسه کنیمن1 و اسن2 واکنش
پست بعدی: مقایسه واکنش های SN1 و SN2