نمودار مداری مولکولی بوتادین و نحوه ساخت آن
در آخرین پست این مجموعه، اوربیتالهای مولکولی پی سیستم آلیل پی را ساختیم که از سه اوربیتال p متوالی به صورت مزدوج تشکیل شده است. در این مقاله نحوه ساخت نمودار مداری مولکولی پی بوتادین را نشان خواهیم داد.
فهرست مطالب
- نکات مفید در مورد ترسیم اوربیتال های مولکولی Pi یک سیستم مزدوج: یک بررسی سریع
- سیستم بوتادینیل پی (n = 4)
- اوربیتال مولکولی کم انرژی (π1) سیستم بوتادین پی دارای گره های صفر است
- اوربیتال مولکولی با بالاترین انرژی (π4) دارای سه گره است
- اوربیتال مولکولی دوم با کمترین انرژی (π2) دارای یک گره
- اوربیتال مولکولی سوم با کمترین انرژی (π3) دارای دو گره است
- نمودار اوربیتال مولکولی کامل برای سیستم بوتادینیل (n=4)
- پر کردن اوربیتال های مولکولی بوتادین با الکترون
- شناسایی “HOMO” و “LUMO” بوتادین
- یادداشت
- (پیشرفته) مراجع و مطالعه بیشتر
1. ترسیم اوربیتال های مولکولی Pi یک سیستم مزدوج: یک بررسی سریع
در پست آخر دیدیم که:
- تعداد اوربیتال های مولکولی (n) برای یک سیستم پی برابر است با تعداد اوربیتال های کمک کننده پ اوربیتال ها برای سیستم آلیل، n=3. ما سه نفر مشارکت داشتیم پ اوربیتال ها و در نتیجه سه اوربیتال مولکولی pi.
- اوربیتال کم انرژی همیشه دارای گره های صفر است پ-اوربیتال ها (توجه داشته باشید که می گوییم “بدون گره بین اوربیتال های p” زیرا گره بین تک تک لوب ها را که ذاتی همه اوربیتال های p است محاسبه نمی کنیم). یعنی در اوربیتال کم انرژی، تمام فازهای کمک کننده پ-اوربیتال ها به همین ترتیب تراز شده اند.
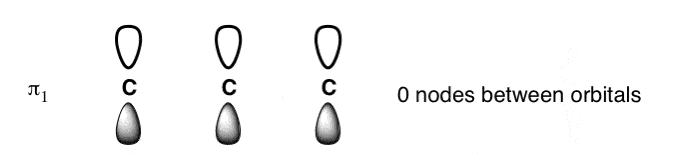
- تعداد گره های بین پ-اوربیتال ها برای هر سطح انرژی متوالی 1 افزایش می یابد، به طوری که اوربیتال با بالاترین انرژی دارای (n-1) گره (همه فازهای مشارکت کننده) است. پ-اوربیتال ها متناوب).
- اوربیتالهای کمتر و بالاترین انرژی همیشه آسانترین اوربیتالهای مولکولی پی برای ترسیم هستند. ابتدا ترسیم آنها مفید است.
- ترفند ترسیم اوربیتال(های) انرژی میانی این است که بفهمیم گره(ها) را در کجا قرار دهیم.. گره ها به گونه ای قرار می گیرند که هستند متقارن نسبت به مرکز سیستمی با 1 گره دارای نود در مرکز است (در واقع درست روی اتم مرکزی). یک سیستم با 2 گره، گره ها را در فاصله مساوی نسبت به مرکز خواهد داشت.
- این مفید است که ابتدا همه اوربیتال های سیستم pi را ترسیم کنیم، و سپس پی الکترون ها را به آن اضافه کنید.
پست امروز در واقع هیچ مفهوم جدیدی را معرفی نمی کند. ما فقط می خواهیم همه چیز را از پست قبلی در مورد ساختن اوربیتال های سیستم آلیل (n=3) بگیریم و آن را برای ترسیم اوربیتال های سیستم بوتادینیل (n=4) به کار ببریم.
ما درک کاملی از اهمیت اوربیتالهای مولکولی برای بوتادین در مدت کوتاهی به دست خواهیم آورد، زمانی که شروع به کاوش در واکنش کوچک عجیبی کنیم که توسط اتو دیلز و کورت آلدر در سال 1928 کشف شد.
2. سیستم بوتادینیل پی (n = 4)
همانطور که از نام آن پیداست، بوتادین از 4 کربن با دو پیوند پی مجاور تشکیل شده است. همانطور که در این پست قبلی در مورد مزدوج و رزونانس نشان دادیم، این دو پیوند پی مزدوج هستند: هر چهار اوربیتال p همگی با یکدیگر همسو هستند و در یک سیستم pi بزرگتر ساخته می شوند. به همین دلیل است که میتوانیم چگالی الکترون در بوتادین را با اشکال تشدید توصیف کنیم، که توزیعهای جایگزین الکترونهای پی را در مولکول نشان میدهند.
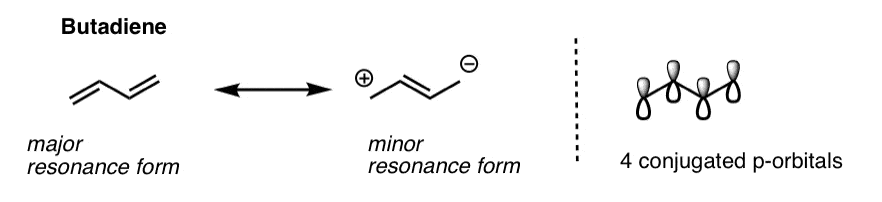
از آنجایی که بوتادین از 4 اوربیتال منفرد p تشکیل شده است، سیستم پی بوتادین حاوی 4 پی خواهد بود. اوربیتال های مولکولی.
با استفاده از اصولی که از ترسیم اوربیتال های مولکولی پی سیستم آلیل آموختیم، بیایید سعی کنیم شکل هر یک از این چهار اوربیتال مولکولی را ترسیم کنیم.
3. اوربیتال مولکولی کم انرژی (π1) سیستم بوتادین پی دارای گره های صفر است
اوربیتال مولکولی با کمترین انرژی دارای اوربیتال های p با فازهایی در تراز کامل با یکدیگر خواهد بود. ترسیم این کار بسیار آسان است: فقط چهار اوربیتال متوالی p را با لوب های آنها به همان ترتیب ترسیم کنید.
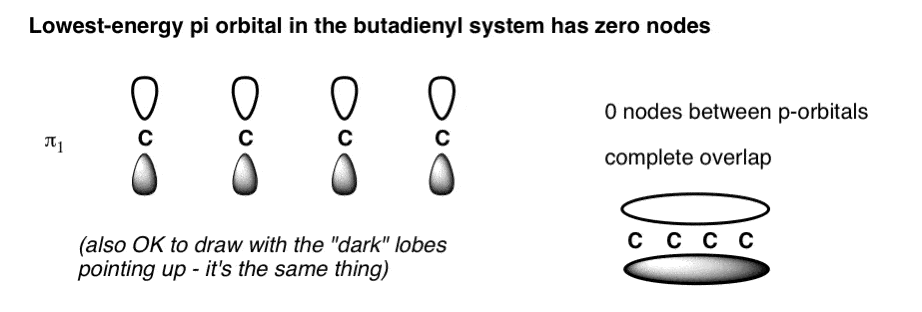
همچنین میتوانستیم سیستم پی را با تمام لوبهای سایهدار به سمت بالا بکشیم: این همان چیزی است. همپوشانی سازنده بین لوب ها منجر به یک اوربیتال پی می شود که در تمام طول سیستم پی (بالا سمت راست) گسترش می یابد. هیچ گره ای بین خود اوربیتال های p وجود ندارد. یک تفسیر فیزیکی از این اوربیتال این است که یک الکترون در این اوربیتال در طول سیستم پی غیرمکانی شده است. [note]
4 اوربیتال مولکولی پر انرژی (π4) دارای سه گره است
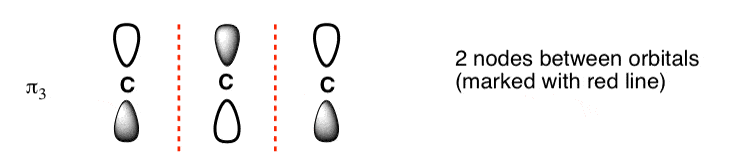
رسم اوربیتال مولکولی با بالاترین انرژی نیز بسیار آسان است. فقط n (در مورد ما 4) اوربیتال p رسم کنید و فازهای هر کدام را به طور متناوب تغییر دهید. این یک سیستم pi با سه گره (مناطقی که لوب ها علامت تغییر می کنند) ایجاد می کند. ما گره ها را به صورت خطوط قرمز نقطه چین رسم کرده ایم.
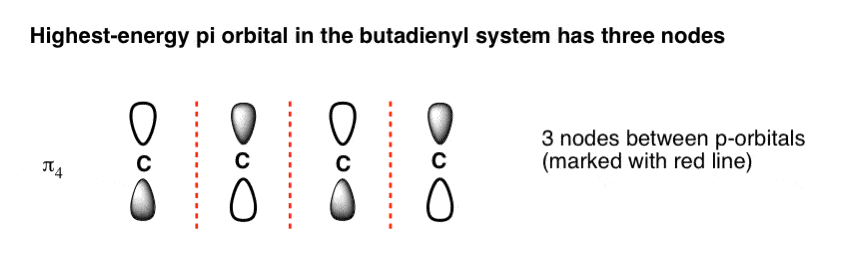
5. اوربیتال مولکولی دوم با کمترین انرژی (π2) دارای یک گره
دومین اوربیتال مولکولی کم انرژی در بوتادین دارای 1 گره خواهد بود. ترفند این است که بدانید آن را کجا قرار دهید.
همانطور که در سیستم آلیل دیدیم، گره را نمی توان در هر جایی قرار داد. خواص ریاضی معادله موج شرودینگر (که نیازی به وارد شدن به آن نیست) موقعیت آن را دیکته می کند. خوشبختانه، قرار دادن گره برای این اوربیتال بسیار ساده است: فقط آن را در وسط قرار دهید.(به هر حال این برای همه سیستم هایی که دارای یک گره هستند صدق می کند).
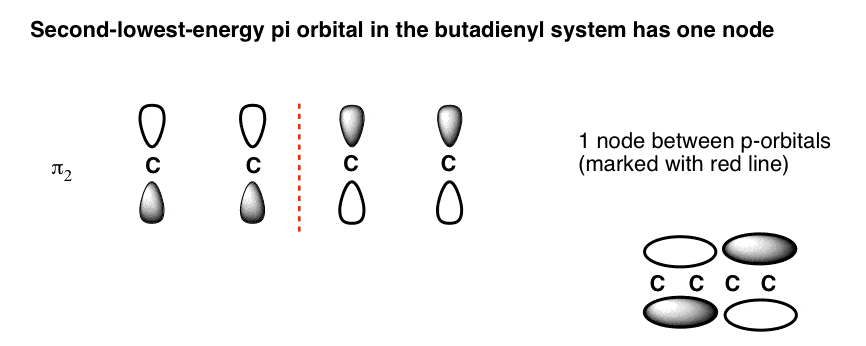
توجه داشته باشید که چگونه فازها در مرکز اوربیتال پی می چرخند. این با وضعیتی مطابقت دارد که ما انتظار داریم برای دو پیوند پی غیر متقابل مجاور ببینیم، جایی که الکترونها هر کدام به اوربیتالهای pi محدود میشوند که هر کدام دو کربن را در بر میگیرند، با یک گره در وسط (بالا سمت راست).
6. سومین اوربیتال مولکولی کم انرژی (π3) دارای دو گره است
در نهایت به سومین اوربیتال مولکولی کم انرژی (یا اگر ترجیح می دهید، دومین اوربیتال بالاتر) می رسیم. این دو گره دارد.
آنها را کجا قرار دهیم؟
اصل کلی این است که قرار می گیرند به صورت متقارن با توجه به مرکز این چیزی است که تصویر مداری به نظر می رسد: [Note]
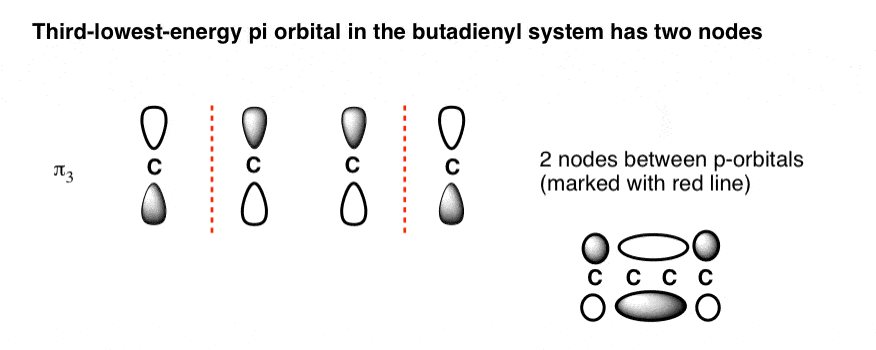
این به ما یک اوربیتال 2 کربنی پی در مرکز می دهد که توسط دو اوربیتال تک کربنی در دو طرف آن قرار دارد.
7. نمودار اوربیتال مولکولی کامل برای The سیستم بوتادینیل (n=4)
اکنون که همه قطعات را در اختیار داریم، تنها کاری که برای ساختن نمودار اوربیتال مولکولی برای سیستم بوتادینیل باید انجام دهیم این است که اوربیتال ها را به ترتیب افزایش انرژی مرتب کنیم. این شکل زیر را به ما می دهد (توجه داشته باشید که هنوز هیچ الکترونی به آن اضافه نکرده ایم).
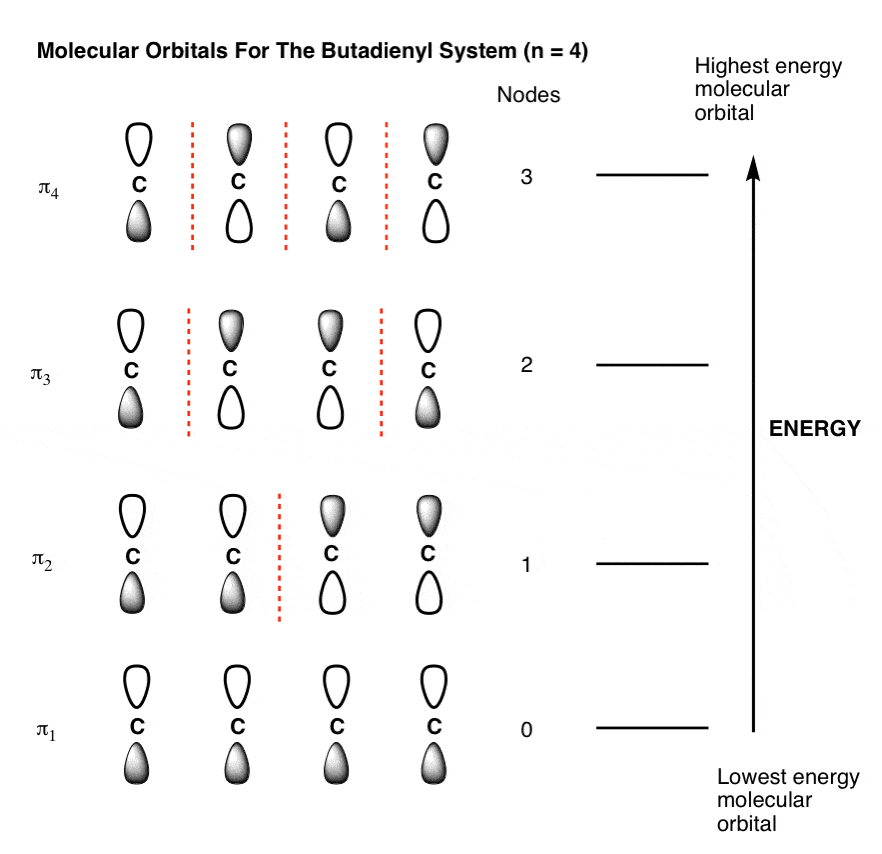
نمودار مداری مولکولی بدون الکترون مانند یک ساختمان آپارتمانی بدون افراد است. بنابراین بیایید ساده ترین مولکول ممکن را برای اعمال در این سیستم انتخاب کنیم: بوتادین.
8. پر کردن اوربیتال های مولکولی بوتادین با الکترون
بوتادین دارای دو پیوند دوگانه با دو الکترون است که در مجموع 4 الکترون پی دارد. ابتدا اوربیتالهای مولکولی کمانرژی را پر میکنیم که به ما نشان میدهد:
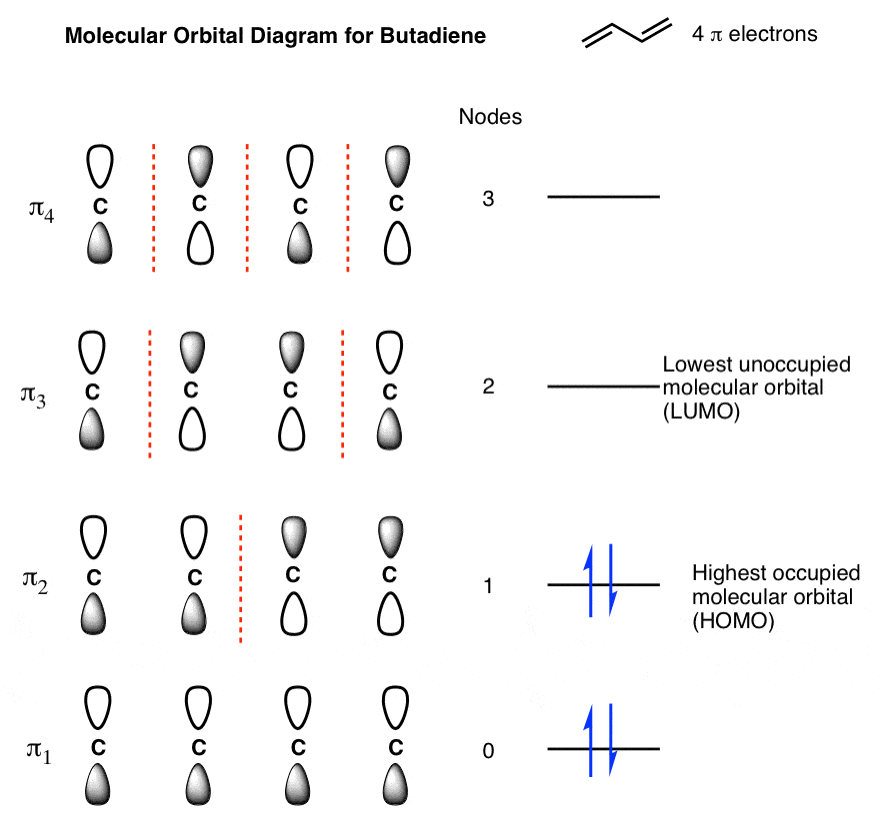
ما دو اوربیتال مولکولی را در این نمودار برجسته کردهایم که مورد توجه خاص هستند، زیرا، همانطور که خواهیم دید، آنها جایی هستند که معمولاً عمل انجام میشود. گاهی اوقات اوربیتال های مرزی نامیده می شوند.
9. شناسایی “HOMO” و “LUMO” بوتادین
را بالاترین اوربیتال مولکولی اشغال شده (HOMO) π2 است. میتوانید HOMO را کمی شبیه «الکترونهای ظرفیت» سیستم pi در نظر بگیرید: آنها به آسانی از بین میروند. اگر بوتادین در واکنشی شرکت کند که در آن الکترون دهنده (هسته دوست) است، الکترون های آن از آن مدار می آیند.
را کمترین اوربیتال مولکولی اشغال نشده (LUMO) π3 است. LUMO کمترین انرژی مداری است که اشغال نشده است. اگر بوتادین در واکنشی شرکت کند که گیرنده الکترون (الکتروفیل) است، الکترون ها به آن اوربیتال اهدا می شوند.
به زودی در مورد HOMO و LUMO چیزهای بیشتری برای گفتن خواهیم داشت، اما فعلاً کافی است.
اکنون بر اساس آنچه امروز از سر گذرانده ایم، یک مسابقه برای شما داریم:
- چگونه نمودار مداری مولکولی کاتیون پنتادینیل را رسم می کنید (n=5)؟
- آیا می توانید نمودار MO آنیون رادیکال بوتادینیل را ترسیم کنید؟

پاسخ های زیر
با تشکر از توماس استرابل برای کمک در این پست.
یادداشت
[Note] من نمیخواهم وارد ذرات درون جعبه شوم، اما اگر به الکترونها بهعنوان امواج نگاه کنید و به انرژیهای آنها بر اساس E=hν فکر کنید، هرچه «جعبه» یک الکترون طولانیتر باشد، انرژی آن کمتر خواهد بود. . این یک استدلال سریع است که چرا تغییر مکان الکترون ها از نظر انرژی مطلوب است.
نکته 2. قرار نیست در اینجا به درمان هوکل اوربیتال های مولکولی دست بزنیم. فلمینگ، “اوربیتال های مرزی و واکنش های شیمیایی آلی” جایی است که اگر کنجکاو هستید برای درمان دقیق و در عین حال عملی نظریه اوربیتال مولکولی به آن بروید.
پاسخ ها. کاتیون پنتادینیل:
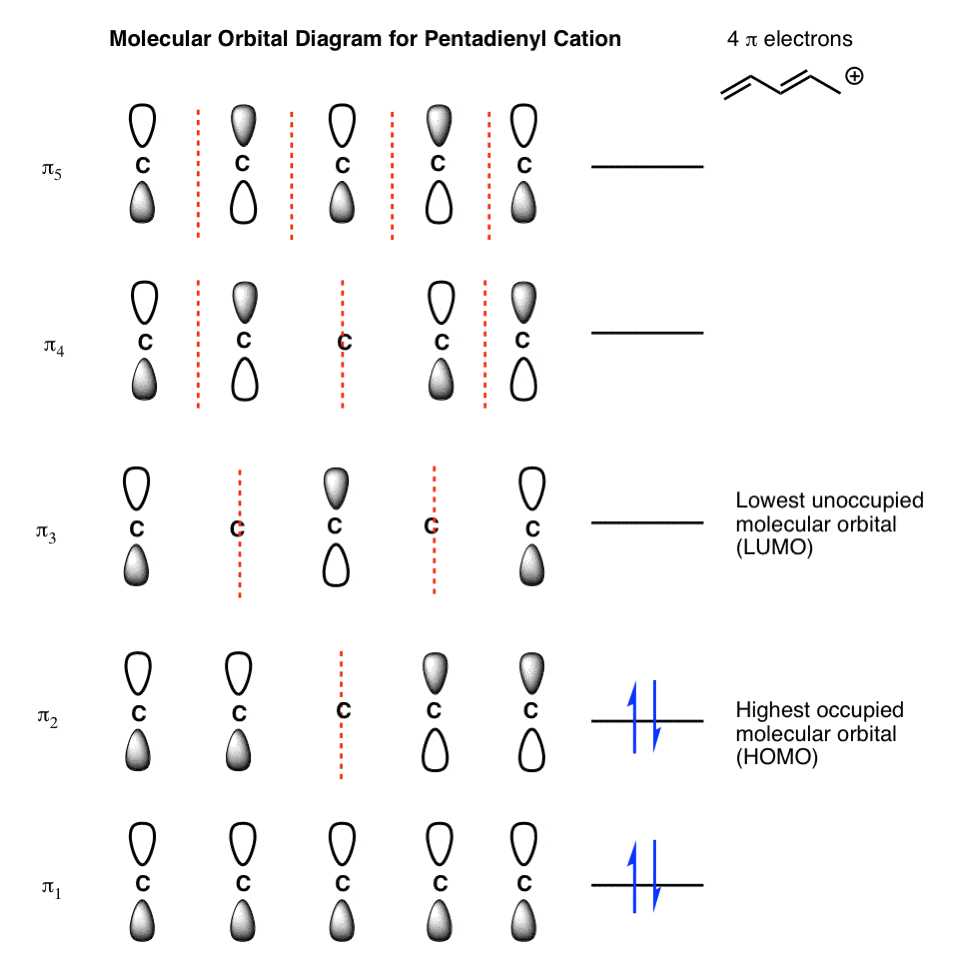
آنیون رادیکال بوتادینیل: فقط نمودار MO خود را برای بوتادین بگیرید و یک الکترون را در π3 (یعنی LUMO بوتادین) قرار دهید. واقعاً به همین سادگی است.
