اوربیتال های مولکولی پی بنزن
امروز، بیایید نحوه ترسیم اوربیتال های مولکولی بنزن را بررسی کنیم. ما آنها را با اوربیتال های مولکولی برای هگزاترین (خطی) مقایسه خواهیم کرد. نکته مهم این است که از تضاد اوربیتالهای مولکولی این دو سیستم 6 الکترونی پی، معمای عمیق و اسرارآمیز چرایی پایداری غیرعادی بنزن را باز میکنیم.
اسپویلر سریع. در اینجا اوربیتال های مولکولی بنزن به نظر می رسد.
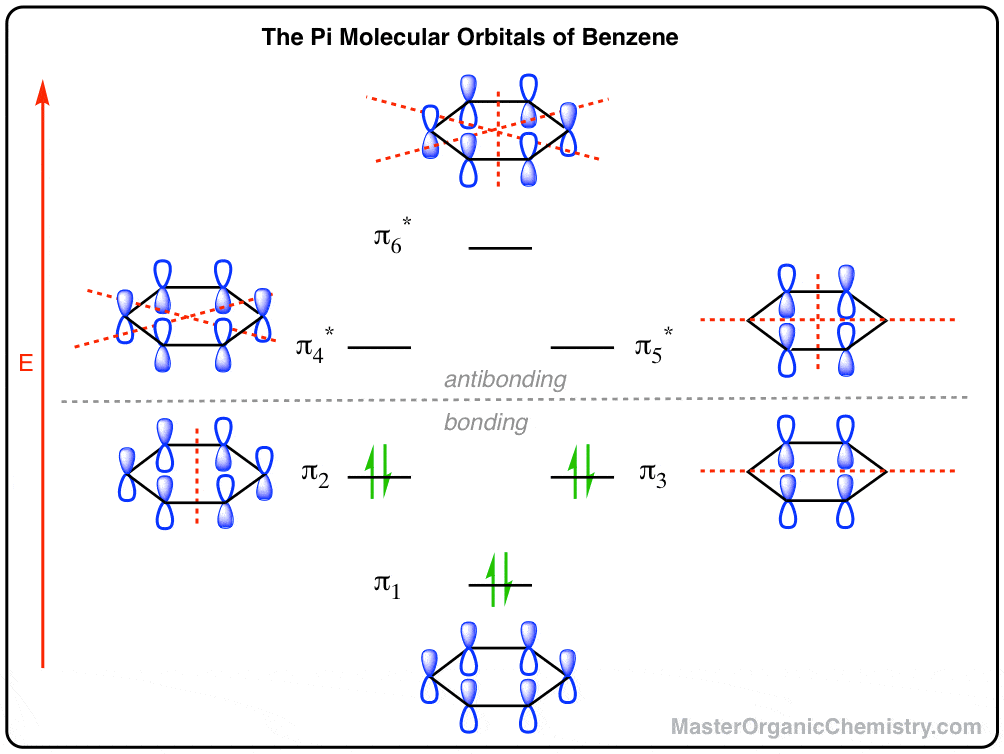
بقیه این پست توضیح خواهد داد که چگونه به این نقاشی رسیدیم و معنی آن چیس
1. Quickie Review: نحوه ترسیم اوربیتال های مولکولی Pi برای یک سیستم Pi داده شده
قبلاً ما به اوربیتالهای مولکولی سیستم آلیل و بوتادین نگاه کردهایم. ما چند درس کلیدی برای ترسیم اوربیتالهای مولکولی سیستمهای pi (خطی) آموختیم که در اینجا بهسرعت دوباره آنها را بازخوانی میکنم.
ترسیم اوربیتالهای پی را کمی شبیه ساختن یک ساختمان آپارتمانی در نظر بگیرید، البته با کدهای عجیب ساختمان شهرداری و رفتار دمدمیشده مستاجر.
تعداد اوربیتال های مولکولی pi در سیستم پی برابر است با تعداد اوربیتال های p اتمی کمک کننده. برای بوتادین (n=4) دیدیم که سطوح انرژی سیستم pi مانند یک ساختمان آپارتمانی چهار طبقه روی هم چیده شده است. هر دو هگزاترین و بنزن دارای شش اوربیتال p کمک کننده هستند (n=6)، بنابراین باید برای هر کدام شش اوربیتال pi را انتظار داشته باشیم.
تعداد گره ها با هر سطح انرژی متوالی افزایش می یابد. “گره” جایی است که بین اوربیتال های p مجاور تغییری در فاز ایجاد می شود (یعنی جایی که آنها نمی توانند به طور سازنده همپوشانی داشته باشند). پایینترین سطح انرژی (در صورت تمایل «طبقه همکف») همه اوربیتالهای p را یکسان تراز میکند، و بنابراین دارای گرههای صفر بین اوربیتالهای p است (بدون احتساب گره ذاتی اوربیتالهای p که در اوربیتالهای p قرار دارد. صفحه مولکول). این امر بیشترین تغییر مکان ممکن الکترون ها را فراهم می کند و از این رو کمترین انرژی را دارد. در اینجا “طبقه همکف” برای بوتادین به نظر می رسد:
بالاترین سطح انرژی (“پنت هاوس” ساختمان ما) دارای (n-1) گره است. دیدیم که برای بوتادین (n=4) بالاترین سطح انرژی دارای سه گره بین اوربیتال ها است (اینجا با خطوط قرمز مشخص شده است).
طبقه همکف و پنت هاوس ساده ترین سطوح برای ترسیم هستند، زیرا از قوانین ساده پیروی می کنند: همه فازها را تراز کنید یا همه فازها را جایگزین کنید.
بخش دشوار ترسیم اوربیتال ها در سطوح انرژی میانی است، به دلیل آیین نامه شهرداری مکانیک کوانتومی که من آن را قانون گره متعادل می نامم. از آنجا که (ریاضی)، گره ها را نمی توان در هر جایی قرار داد. آنها همیشه به طور متقارن با توجه به مرکز مداری مرتب شده اند.
یک گره منفرد باید از مرکز اوربیتال مولکولی عبور کند.
دو گره باید در فاصله مساوی از مرکز قرار گیرند (یعنی به گونه ای که نسبت به مرکز متعادل باشند)
هر سطح انرژی متوالی یک گره اضافی اضافه می کند. توجه داشته باشید که یک اوربیتال با تعداد فرد گره همیشه یک گره در مرکز خواهد داشت.
وظیفه نهایی در ترسیم اوربیتالهای مولکولی این است که ساختمان خود را با مستاجر (الکترونها) با استفاده از اصل آشنای Aufbau پر کنیم: با شروع از طبقه همکف، هر واحد (اوربیتال) هر بار یک الکترون را پر میکند، تا حداکثر دو نفر اشغال شوند. .1
حالا بیایید این چارچوب را برای هگزاترین و بنزن اعمال کنیم.
2. ساختن نمودار اوربیتال مولکولی پی برای بنزن: هگزاترین و بنزن هر کدام شش اوربیتال مولکولی پی دارند.
امیدوارم سرراست! شش اوربیتال p در سیستم های پی بنزن و هگزاترین، شش اوربیتال مولکولی پی تولید می کنند.
سطوح در هگزاترین مانند یک ساختمان شش طبقه روی هم قرار می گیرند. بنزن آرایش متفاوتی دارد، به دلایلی که به سرعت در زیر خواهیم دید.
توجه داشته باشید که سه اوربیتال پایینی همگی اوربیتال های پیوندی و سه اوربیتال بالایی آنتی باند هستند. فقط سه “طبقه” پایین در هگزاترین خنثی اشغال شده است. (اگر هر طبقه در این ساختمان کاملاً پر از مستاجران (الکترون) می شد، ساختمان به سرعت خود ویران می شد. صحبت از یک ساختمان لعنتی)
3. اوربیتال های مولکولی کم انرژی هگزاترین و بنزن دارای گره صفر هستند.
با پیروی از الگوی توضیح داده شده در بالا برای بوتادین، ابتدا “طبقه همکف” را ترسیم می کنیم، با مراحل تمام اوربیتال های p به یک شکل تراز شده اند. فرقی نمیکند که لوبهای “سایهدار” یا “سفید” را به سمت بالا بکشید یا پایین، تا زمانی که همه آنها به یک شکل کشیده شوند.
در اینجا آنها برای هگزاترین و بنزن به نظر می رسند:
4. “پنت هاوس” از M.O. نمودار (بالاترین سطح انرژی) دارای حداکثر تعداد گره است
اوربیتالهای مولکولی با بیشترین انرژی دارای اوربیتال p با فازهای کاملاً متناوب هستند.
مانند طبقه همکف، ترسیم اوربیتال مولکولی با بالاترین انرژی (“پنت هاوس”) یک سیستم pi نیز ساده است.
تمام اوربیتال های p را با فازهای متناوب رسم کنید. هیچ دو اوربیتال p مجاور نباید دارای لوب هایی با فاز یکسان باشند.
برای سیستمهای خطی، دیدهایم که این بالاترین سطح انرژی (n–1) گرهها را میدهد. برای هگزاترین (n=6) به این معنی است که بالاترین سطح انرژی 5 گره خواهد داشت.
بنزن چطور؟ اینجاست که همه چیز جالب می شود.
5. بنزن دارای صفحات گرهی است. حداکثر سطح انرژی دارای 3 صفحه گره است
در مورد سیستم های چرخه ای، قانون (n-1) شکست می خورد. رسم اوربیتال مولکولی بنزن با 5 گره مانند حل 5 وجه مکعب روبیک است: غیر ممکن. اگر میتوانید ثابت کنید که اشتباه میکنم، یک میلیون دلار: امتحانش کنید!
با این حال، میتوانیم به راحتی مداری را ترسیم کنیم که در آن همه فازها متناوب باشند. با این حال، در این مورد، میتوانیم شش مکان را بشماریم که در آن فازها تغییر میکنند. به جای اینکه به این گره ها به عنوان گره های جداگانه نگاه کنید، شاید مفیدتر باشد که آنها را به عنوان سه نه در نظر بگیرید
صفحات دال، که مولکول را در نقاط مختلف برش می دهند.
این اوربیتال دارای همپوشانی صفر بین اوربیتالهای p مجاور است و بنابراین الکترونها در این اوربیتال کمترین مکانیابی ممکن را دارند. بنابراین آنها بالاترین انرژی را دارند.
6. گره ها را در سطوح انرژی متوسط بنزن در کجا قرار می دهیم؟
همانطور که در بالا گفتیم، مشکل در ساخت اوربیتالهای مولکولی pi این است که بدانیم گرهها را در کجا در سطوح میانی قرار دهیم.
برای هگزاترین، طبقه دوم (یک گره) نسبتاً ساده است: ما گره را در مرکز قرار می دهیم، مانند این:
رسم یک سیستم پی چرخه ای با یک گره غیرممکن است، اما می توانیم یک سیستم را با یک صفحه گره رسم کنیم. برای مثال، در اینجا، صفحه گرهای را ترسیم کردهایم که دو تا از پیوندهای منفرد را قطع میکند:
اما صبر کن! در واقع یک راه دوم برای انجام آن وجود دارد. ما همچنین میتوانیم یک صفحه گره از میان اتمها ترسیم کنیم، مانند این.
این دو اوربیتال مولکولی (π2 و π3 ) تعداد صفحات گرهای یکسان دارند و بنابراین انرژی یکسانی دارند. روشی که ما معمولاً این را در شیمی توصیف میکنیم این است که میگوییم اوربیتالها انحطاط دارند.
این واقعاً تفاوت اصلی در تصویر مداری مولکولی یک سیستم چرخهای در مقابل یک سیستم غیر چرخهای است: دو واحد میتوانند در یک طبقه با هم وجود داشته باشند. برای بنزن، این منجر به کاهش انرژی می شود.
7. پر کردن بقیه تصویر برای بنزن
در اینجا “طبقه” سوم، چهارم و پنجم برای سیستم hexatriene pi است که به ترتیب دارای دو، سه و چهار گره هستند.
برای بنزن، سطح بعدی دارای دو صفحه گره است. باز هم، دو راه برای انجام این کار وجود دارد: بریدن از طریق پیوندها، یا بریدن از طریق اتم ها. باز هم اینها از همان انرژی هستند.
8. دیاگرام مداری مولکولی بنزن: قرار دادن همه آنها در کنار هم
مرحله آخر این است که همه اوربیتال های pi را با هم مرتب کنیم (بر اساس “طبقه”) و سپس هر سطح را با الکترون ها (“مستاجر”) پر کنیم.
در اینجا تصویر اوربیتال مولکولی کامل برای هگزاترین است:
تصویر کامل مداری مولکولی برای بنزن در بالای پست ترسیم شده است، اما اینجا دوباره برای لذت بدون پیمایش شماست:
تفاوت کلیدی را می بینید؟ توصیف آن به عنوان “انباشته شدن کارآمدتر سطوح انرژی” دور از دسترس نیست.
9. چرا بنزن از هگزاترین پایدارتر است؟
یک سیستم pi حلقوی دو راه را برای قرار دادن یک صفحه گرهی منفرد امکان پذیر می کند: پیوند از طریق پیوند، یا از طریق اتم. در بنزن، این بدان معنی است که “طبقه” دوم و سوم هر کدام دو واحد با انرژی یکسان دارند – آنها “دژنراتیو” هستند.
برای پیروی از قیاس تا حدی خام ما، هر دو ساختمان دارای شش “مستاجر” هستند، اما در بنزن، این مستاجران به اندازه سطح زمین نیستند – و بنابراین انرژی بالقوه کمتری دارند.
از نظر شیمی، بیشترین اوربیتالهای مولکولی اشغال شده (HOMO) بنزن از نظر انرژی کمتر از بالاترین اوربیتال مولکولی اشغال شده (HOMO) هگزاترین هستند. و برای اهداف ما، انرژی کمتر پی الکترون ها به واکنش پذیری کمتر تبدیل می شود. [نکته 3]
این یک قیاس ناقص است، اما برای اهداف ما، این کار را انجام می دهد.
در پست بعدی، بیایید ببینیم که آیا میتوانیم اوربیتالهای مولکولی را برای سیکلوبوتادین ضد آروماتیک بررسی کنیم و به طور مشابه در مورد ناپایداری غیرمعمول آن بینشی به دست آوریم.
از تام استرابل برای مشارکت در این مقاله سپاسگزاریم.
