انباشته شدن بهتر = نقطه ذوب بالاتر

عکس بالا نشان می دهد که شاید یکی از بدترین بازی های تتریس تا کنون انجام شده است. در دفاع از من، هدف خیلی بازی کردن نبود، بلکه گرفتن عکس از تنظیمات عالی که باشگاه راه آهن مدل فناوری در کنار موزه MIT برپا کرده بود، با یک ماکت از ساختمان سبز که می توانید تتریس بازی کنید، بود. بر. واقعا بدترین مکان روی زمین
تتریس در اصل یک بازی آجرکاری روی تایمر است. به شما کاشیها داده میشود و باید آنها را بچرخانید تا “خطهایی” در پایین ایجاد کنید، که پس از تکمیل به سرعت ناپدید میشوند. اگر فاصلهای در این بین باقی بماند، آنها باقی میمانند – (برای مثالها، فقط به بالا نگاه کنید). چیزی که تتریس را سخت می کند، چیدمان اشکال مختلف آن است. اغلب باید آنها را بچرخانید تا بتوانید به درستی روی هم چیده شوند.
اگر میخواهید بازی را به طرز عجیبی آسان کنید، فقط آن را طوری بسازید که هر کاشی شبیه به کاشی سمت چپ باشد. یا دشوار، به قطعه سمت راست.
شما متوجه چیزی خواهید شد – هرچه قطعات ساده تر باشند، راحت تر در کنار هم قرار می گیرند، که تناسب محکم تری را با فضاهای کمتر فراهم می کند. در اینجا، با قرار دادن یک پیچ در بلوک، ما آنها را سخت تر می کنیم.
این چه ربطی به شیمی دارد؟
هنگامی که ترکیبات یخ می زنند، این فرآیند بسیار شبیه به چیدن آجر است. هر چه مولکولها متقارنتر باشند، آسانتر خواهند بود و فاصلههای کمتری بین مولکولها وجود خواهد داشت. فضاهای کمتر = چیدمان بهتر. از این رو، هنگامی که هگزان را با ایزومر ساختاری آن، 2-متیل پنتان مقایسه می کنید، هگزان به دلیل آرایش منظم ساختار آن، نقطه ذوب بسیار بالاتری دارد.
انباشته شدن بهتر، نقطه ذوب بالاتر. پرونده بسته شد. درست؟ نه کاملا.
همچنین در مورد مساحت سطح است.
داستان خوبی است: شاخه شدن نقطه ذوب و نقطه جوش را کاهش می دهد. اما پیچیده تر می شود.
به این سه نمونه از مشتقات هگزان منشعب (برای مقایسه با هگزان) نگاه کنید.
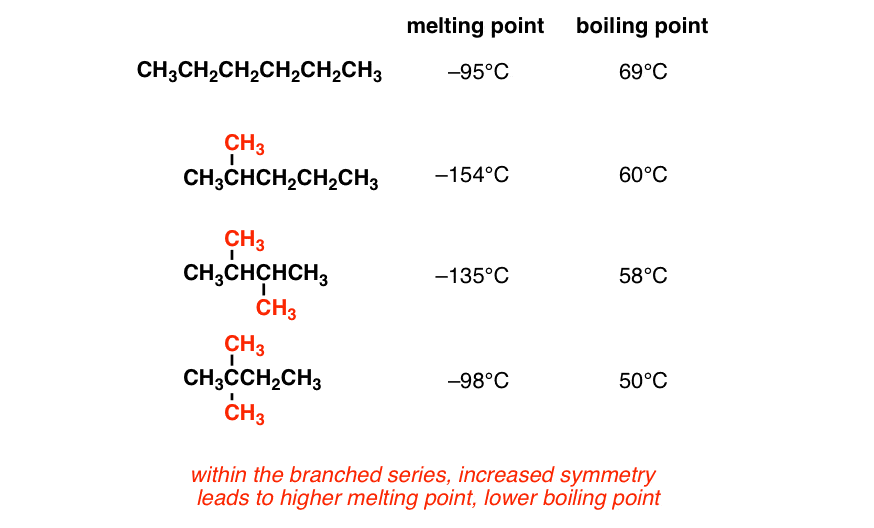
به نظر می رسد با افزایش انشعاب، نقطه ذوب را افزایش و نقطه جوش را کاهش می دهیم. چه خبر است؟
n-hydrocarbon را به عنوان یک مورد خاص در نظر بگیرید و فعلاً آن را نادیده بگیرید. با ساده ترین ترکیب شاخه دار شروع کنید، با افزایش انشعاب، این کار را انجام خواهید داد افزایش دادن نقطه ذوب، اما نزول کردن نقطه جوش چرا؟
رفتن از “شاخه” به “بسیار منشعب” یک مولکول را فشرده تر و کروی تر می کند. با کاهش سطح مولکول (به یاد داشته باشید که کره ها کمترین نسبت سطح به حجم را در بین هر شکلی دارند) فشرده تر می شوند و در نتیجه بسته بندی آسان تر می شوند. این پدیده نقطه ذوب را توضیح می دهد.
نقطه جوش چطور؟
نقطه جوش مربوط به نیروهای بین مولکول ها است که در مورد هیدروکربن ها فعل و انفعالات واندروالس است. اگر تا به حال تصاویر میکروسکوپی از پای یک مارمولک را دیده باشید – که به آن اجازه می دهد از دیوارها بالا برود – خواهید دید که هیچ چسبی وجود ندارد اما لنت ها دارای سطح فوق العاده ای هستند. همه چیز در مورد تعاملات واندروالس است.
همانطور که ما نزول کردن سطح، ما می رویم نزول کردن برهمکنش بین مولکولی Van Derwaals و در نتیجه کاهش نقطه جوش.
روابط کلیدی
بنابراین در اینجا روابط وجود دارد:
خطی در مقابل شاخه -> نقاط ذوب/جوش بالاتر به دلیل انباشتگی بهتر و تماس سطحی.
خیلی شاخه در مقابل شاخه -> کروی بیشتر -> انباشته شدن بهتر -> نقطه ذوب بالاتر
بسیار شاخه در مقابل شاخه -> کروی بیشتر – -> سطح پایین تر -> نقطه جوش پایین تر.
اگر همه اینها مبهم، متناقض و مبهم به نظر می رسد، خوب، شما یک نکته دارید. موضوع ساده ای نیست. به عنوان مثال آخر، من 2،2،3،3،-tetramethylbutane را به شما میدهم. ایزومر ایزواکتان (بنزین) با نقطه ذوب 95 درجه سانتیگراد. اثبات بیشتر، گویی بیشتر مورد نیاز است، که پیش بینی نقطه ذوب/جوش از ساختارهای شیمیایی می تواند یک کار احمقانه باشد.
