نامگذاری، خواص و ساختار الکل
در این سری پست های بعدی قصد داریم به واکنش های این افراد بپردازیم الکل ها.
به عنوان یک گروه عاملی، الکل ها نسبتاً اولیه در شیمی آلی معرفی شدند. با این حال، واکنشهای آنها معمولاً تا پایان سازمان 1 پوشش داده نمیشود – حداقل پس از بررسی موضوعاتی مانند واکنشهای جایگزینی و حذف. به این دلیل که همانطور که خواهیم دید، واکنش های الکل ها اغلب در این دسته بندی ها قرار می گیرند.
ما واکنش های الکل ها را در زمان مناسب پوشش خواهیم داد. اما امروز، بیایید با آشنایی با ساختار، نامگذاری و خواص فیزیکی پاهای خود را خیس کنیم.
فهرست مطالب
- ساختار و نامگذاری الکل ها: اولیه، ثانویه و سوم
- خواص فیزیکی الکل ها: پیوند هیدروژنی
- خواص فیزیکی الکل ها: نقطه جوش
- الکل ها “قطبی” هستند و حلالیت قابل توجهی در آب دارند
- خودت امتحان کن
1. ساختار و نامگذاری الکل ها: اولیه، ثانویه و سوم
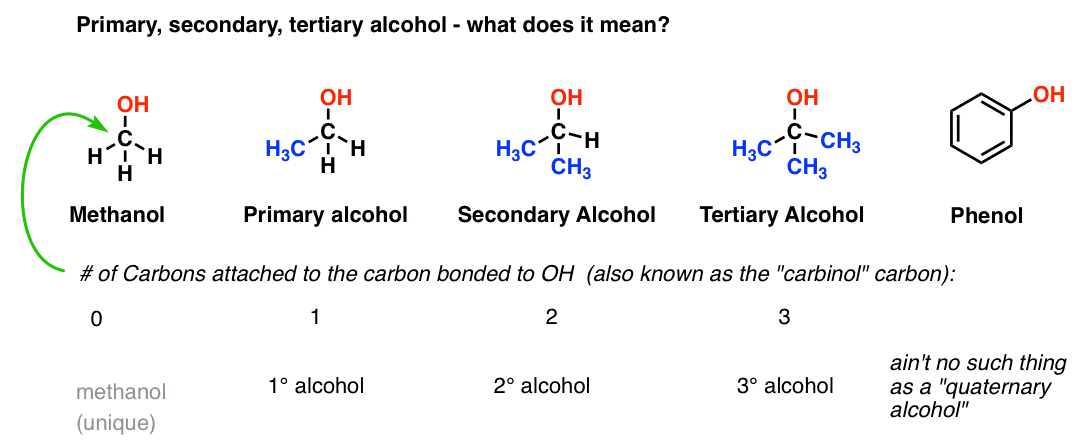
الکل ها مولکول های آلی حاوی گروه عاملی “هیدروکسیل”، “OH” هستند که مستقیماً به کربن پیوند دارند. کربنی که مستقیماً به OH متصل است، از نظر فنی کربن “کاربینول” نامیده می شود، اگرچه این نامگذاری اغلب در کلاس های مقدماتی معرفی نمی شود. کربن کربینول (کربن متصل به OH)، با این حال، کلید درک رایجترین طبقهبندیهایی است که ما برای الکلها استفاده میکنیم، که الکلهای «اولیه»، «ثانویه» و «ثالثیه» هستند.
برای تعیین اینکه آیا یک الکل اولیه، ثانویه یا سوم است، کربن متصل به OH را بررسی کنید. اگر آن کربن به آن متصل باشد یکی کربن، الکل است اولیه; دو، ثانوی; سه، درجه سوم. اگر کربن صفر و سه هیدروژن (یک موقعیت منحصر به فرد) آن متانول است. گروه های هیدروکسیل متصل به حلقه های معطر “فنول” نامیده می شوند.
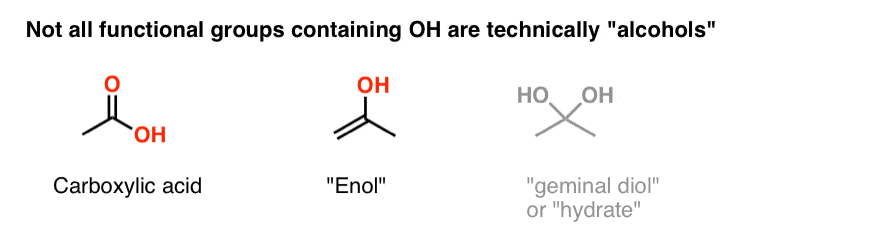
توجه داشته باشید که همه گروه های عاملی حاوی OH الکل نیستند. اگر OH به یک کربونیل (C=O) متصل باشد، آن گروه عاملی “اسید کربوکسیلیک” نامیده می شود. OH متصل به یک آلکن “انول” (ene + ol) نامیده می شود. و گروههای عملکردی بد بو دیگری مانند هیدراتها (“دیول جمینال”) وجود دارند که واقعاً در یک دسته جداگانه از خود الکلها قرار دارند.
نامگذاری عمیق تر الکل ها چیزی نیست که من در حال حاضر در این وبلاگ صحبت کنم. انواع ویدئوها و منابع فوق العاده در اینترنت وجود دارد که نام الکل ها را با جزئیات شرح می دهد و من با خوشحالی شما را در حال حاضر به آنها ارجاع خواهم داد.
در اینجا یک مثال توسط لیا فیش، به عنوان مثال.
2. خواص فیزیکی الکل ها: پیوند هیدروژنی
کلید درک خواص فیزیکی الکل ها – و همانطور که بعداً خواهیم دید، واکنش پذیری آنها – درک این است که چگونه قطبی شده گروه هیدروکسیل است. الکترونگاتیوی اکسیژن 3.5 و هیدروژن 2.2 است. اکسیژن، که برای الکترونها از هیدروژن “حریصتر” است، بیش از “سهم” خود از دو الکترون در پیوند OH خواهد داشت. این به این معنی است که اکسیژن بیشتر “غنی از الکترون” خواهد بود (بیشتر منفی) و هیدروژن بیشتر «فقیر الکترونی» (بیشتر مثبت) نسبت به پیوندی که در آن الکترون ها به طور کاملاً مساوی به اشتراک گذاشته می شوند، باشند. ما می گوییم که چگالی الکترون در پیوند OH به شدت به سمت اکسیژن “قطبی” است. راه دیگری برای گفتن همین موضوع این است که پیوند OH یک “دوقطبی” قوی دارد.
از آنجایی که بارهای مخالف جذب می شوند، این بارهای جزئی در محلول به گونه ای قرار می گیرند که اکسیژن های منفی جزئی روی یک مولکول با هیدروژن های تا حدی مثبت در مولکول دیگر برهم کنش می کنند. این برهمکنشهای بین مولکولها، که ما آنها را «پیوندهای هیدروژنی» مینامیم، تقریباً 1/10 به اندازه پیوندهای معمولی قوی هستند و بسیار گذرا هستند و به طور متوسط فقط کسری از ثانیه طول میکشند. با این حال، تأثیر پیوند هیدروژنی این است که مولکولها را به «چسبیدن» به یکدیگر هدایت میکند.
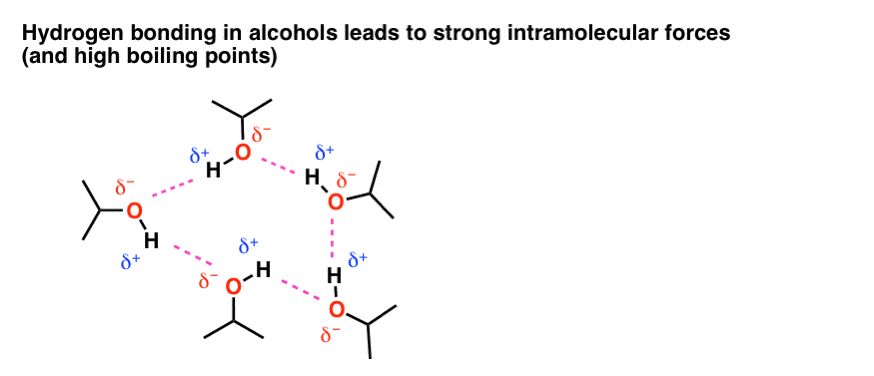
یک تشبیه غیرعلمی میتواند مقایسه دوقطبیهایی باشد که منجر به پیوند هیدروژنی میشوند با نحوه چسبیدن “قلابهای” Velcro به Velcro “fuzz”. آنها لزوماً پیوندهای قوی نیستند، اما به اندازه کافی چسبنده هستند:
3. خواص فیزیکی الکل ها: نقطه جوش
این دو مفهوم مهم دارد.
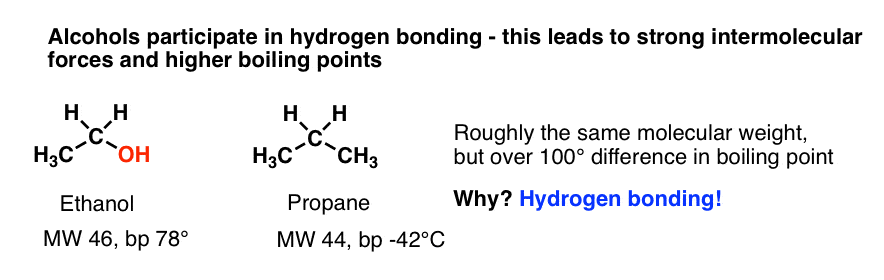
اولین، گروه های هیدروکسیل تا حد زیادی نقطه جوش را افزایش می دهند. ببینید چه اتفاقی برای نقطه جوش پروپان (یک آلکان) می افتد که یک CH وجود دارد3 گروه با یک گروه OH جایگزین می شود – وزن مولکولی یکسان است، اما بیش از 100 درجه سانتیگراد اختلاف در نقطه جوش وجود دارد. [Why is it important to compare molecules of roughly similar molecular weight? Because boiling points also with increased Van Der Waals interactions, which are roughly proportional to increased surface area. Keeping the molecular weights constant ensures we’re comparing apples to apples in this respect].
اگر یکی خوب است، پس مطمئناً بیشتر بهتر است؟ آره! تعویض CH3 روی پروپانول با یک گروه OH به ما “اتیلن گلیکول”، “دی-ال” می دهد (در واقع “دیول مجاور” نامیده می شود زیرا الکل ها روی کربن های مجاور هستند). با داشتن دو برابر بیشتر گروه های هیدروکسیل، ما انتظار داریم که حتی قطبی تر از پروپانول باشد و در نتیجه نقطه جوش بالاتری داشته باشد. این درست است – نقطه جوش اتیلن گلیکول 197 درجه سانتیگراد است.

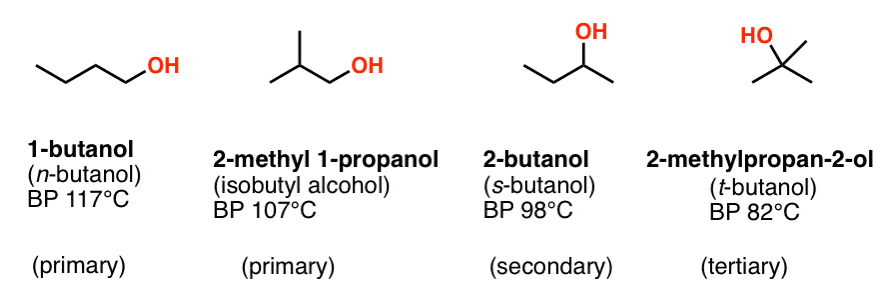
تفاوت در نقطه جوش بین الکل های اولیه، ثانویه و سوم می تواند ظریف باشد. به طور کلی، هرچه گروه هیدروکسیل “در معرض” تر باشد، گروه های OH بیشتری می تواند با آنها تعامل داشته باشد و نقطه جوش بالاتر می رود. ایزومرهای بوتانول یک مثال کامل هستند. ببینید که چگونه الکل های اولیه (1-بوتانول و 2-متیل-1-پروپانول) دارای نقطه جوش بالاتری نسبت به الکل ثانویه (2-بوتانول) هستند که نقطه جوش بالاتری نسبت به الکل سوم (t-butanol) دارند.
4. الکل ها قطبی هستند و حلالیت قابل توجهی در آب دارند
مفهوم کلیدی دوم پیوند هیدروژنی این است که گروه هیدروکسیل ایجاد می کند حلالیت آب بسیار بیشتر بر روی مولکول های آلی این به این دلیل است که آب خود یک حلال پیوند هیدروژنی است و بنابراین دوقطبی گروه هیدروکسیل میتواند به خوبی با گروه هیدروکسیل H2O تعامل داشته باشد. به عنوان مثال، اتانول و آب در همه نسبت ها قابل مخلوط شدن هستند («امتزاج پذیر» کلمه ای است که ما در واقع استفاده می کنیم).[تازمانیکهبوتانولزنجیرهآلکیلچربشروعبهتداخلباحلالیتآبکند[Itisn’tuntilbutanolthatthegreasyalkylchainstartsinterferingwithwatersolubility
ما اغلب می گوییم که گروه های هیدروکسیل یک گروه عملکردی “قطبی” هستند. حلال های حاوی OH به طور کلی در نظر گرفته می شوندقطبی” حلال ها به دلیل دوقطبی بزرگ. همچنین ممکن است شنیده باشید که از الکل ها به عنوان “پروتیک قطبی” حلال ها این در مورد چیست؟ این به یکی از ویژگی های کلیدی الکل ها مربوط می شود – توانایی آنها برای شرکت در واکنش های اسید-باز. موضوع پست بعدی همینه!
