هیدروهالوژناسیون آلکین – افزودن HX به آلکین ها – HCl، HBr، و HI
در سه پست قبلی در مورد آلکینها، واکنشهای جدیدی را که مختص آلکینها هستند (در مقابل آلکنها) معرفی کردهایم:
با تمام تمرکز بر روش هایی که شیمی آلکین می تواند از شیمی آلکن متفاوت باشد، یادآوری همه روش هایی که از طریق آنها شبیه هستند مفید است.
در این پست به یک الگوی مکانیسم واکنش کلیدی که با آلکن ها مشاهده کردیم برمی گردیم: به اصطلاح “مسیر کربوکیشن” – و بررسی خواهیم کرد که چگونه بسیاری از واکنش های آلکن هایی که با آنها آشنا هستیم می توانند با آلکین ها نیز استفاده شوند.
1. افزودن هالیدهای هیدروژن به آلکین ها (یک بار) – هیدروهالوژناسیون
سه مثال عمده در این دسته، واکنش اسیدهای هیدروهالیک (H-Cl، H-Br و HI) با آلکین ها است. اگر به یاد داشته باشید، هنگامی که به آلکن ها اضافه شد، این معرف ها عبارت بودند از:
- توسط پیوند π آلکن مورد حمله قرار می گیرد تا یک کربوکاتیون ایجاد کند (روی کربن جایگزین شده، انتخاب منطقه ای “مارکونیکوف”) و به دنبال آن
- حمله یون هالید به کربوکاتیون
از آنجایی که آلکینها صرفاً در افزودن پیوند π دوم با آلکنها متفاوت هستند، انتظار داریم که این واکنشها برای آلکینها نیز کار کنند. و آنها انجام می دهند!
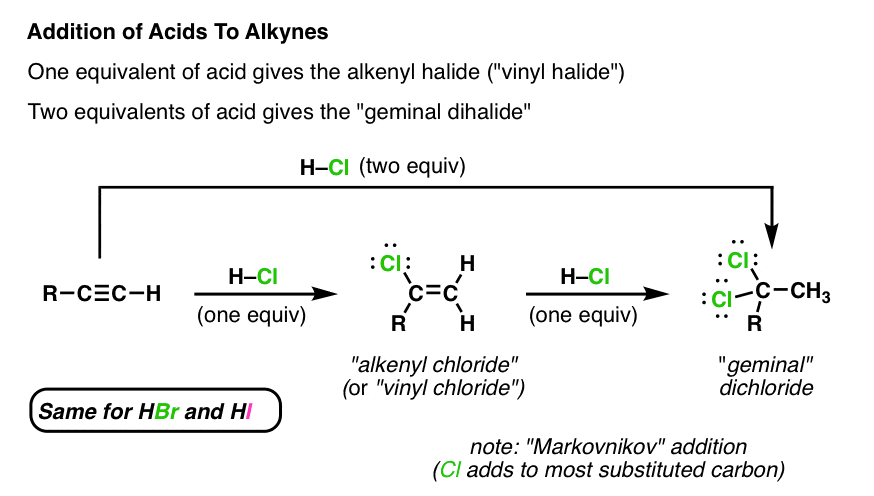
اگر یک آلکین را با یک معادل واحد H–Cl درمان کنیم [note – we’ll just use H-Cl in all of these examples, but HBr and HI work in exactly the same way] در نهایت یک آلکنیل کلرید تشکیل می دهیم. توجه داشته باشید که اتم کلر به جانشین ترین کربن آلکن متصل می شود [“Markovnikov” regioselectivity].
توجه داشته باشید که محصول اینجا هنوز دارای پیوند π است.
2. افزودن یک معادل دوم HX به یک آلکین
ممکن است تعجب کنید که آیا ممکن است این پیوند π با a واکنش نشان دهد معادل دوم H-Cl. پاسخ بله است. [Note – it is possible to just “stop” the reaction at this stage if we use just one equivalent, because the product (alkenyl chloride) is less reactive towards HCl than the starting alkyne].
در واقع، اگر معادل دوم H-Cl را اضافه کنیم، به دو طرف پیوند CC π اضافه میشود و محصولی را به ما میدهد که در آن دو اتم کلر روی کربن یکسان هستند. به هر حال، ما به این می گوییم a دی کلرید “جمینال”. (به لاتین فکر کنید – “جوزا” = دوقلوها).
اگر به سادگی دو معادل H-Cl را به آلکین شروع کننده اضافه کنیم، می توانیم این محصول را بدست آوریم.
3. افزودن هالیدهای هیدروژن به آلکین ها – مکانیسم هیدروهالوژناسیون
بنابراین این واکنش چگونه ممکن است کار کند؟ به روشی بسیار شبیه به نحوه افزودن H-Cl به آلکن ها.
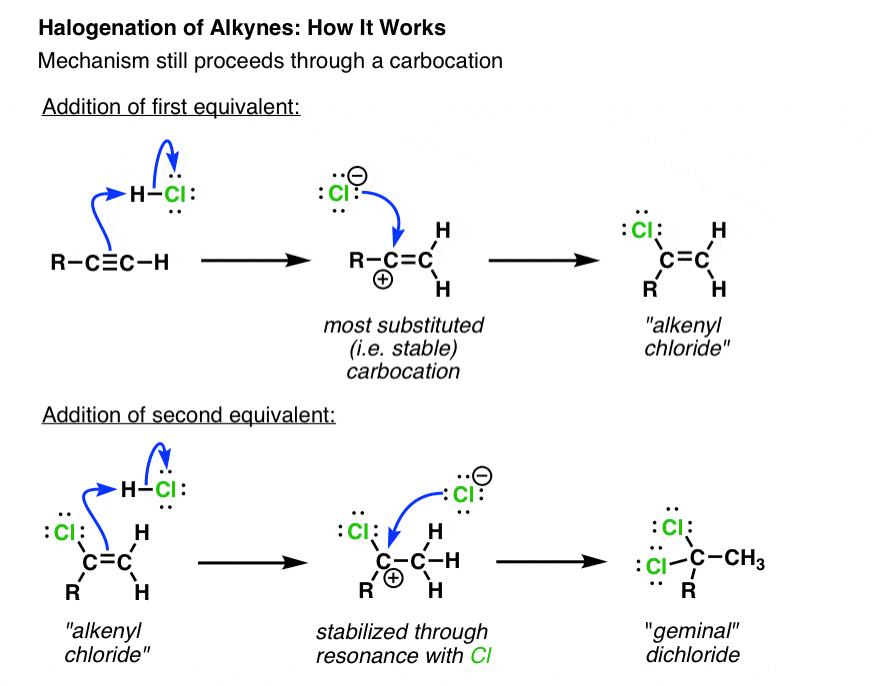
اولین مرحله پروتونه شدن آلکین با H-Cl است به گونه ای که پایدارترین واسطه کربوکاتیونی را به دست آورد. از آنجایی که کربوکاتیونها به میزان بیشتری توسط جایگزینهای آلکیل آزادکننده الکترون نسبت به هیدروژن تثبیت میشوند، کربوکاتیون جدید در انتهای آلکین حامل جانشین کربن تشکیل میشود. در مرحله بعد، کربوکاتیون توسط یون کلرید مورد حمله قرار می گیرد و آلکنیل کلرید می دهد.
در مورد معادل دوم H-Cl چطور؟ با توجه به این واقعیت که دی کلرید جمینال در اینجا محصول است، معقول ترین مکانیسم برای تشکیل آن صرفاً تکرار مراحل از واکنش اول است (همانطور که نشان داده شده است). با این حال لازم است به یک ویژگی جالب اشاره کنیم. توجه داشته باشید که کربوکاتیون در این مورد دارای یون کلرید است. از آنجایی که کربوکاتیون ها الکترون فقیر هستند، و کلر کاملاً یک عنصر الکترونگاتیو است، جالب است اشاره کنیم که توانایی آزادسازی الکترون گروه آلکیل [and the ability of chlorine to donate a lone pair to the carbocation] در اینجا بر خصلت الکترون گیر یون کلرید «پیروز شوید».
همانطور که در بالا ذکر شد، واکنش آلکین ها با HBr و HI (و همچنین HF، فقط در صورتی که کنجکاو باشید) دقیقاً همان مسیر را دنبال می کند.
[Note: there is considerable evidence to suggest that this reaction in fact proceeds not through a carbocation intermediate, but through a “termolecular” reaction incorporating two equivalents of H-X and the alkyne. This is covered inconsistently in courses and textbooks. I strongly suggest you double check your textbook to verify how it is taught in your course].
4. مقایسه آلکن ها و آلکین ها در “مسیر کربوکاتاسیون”
احتمالاً ارزش دارد که این پست را به پست مربوط به آلکنها و مسیر کربوکاتاسیون مرتبط کنیم و به شباهتها و تفاوتهای بین شیمی آلکنها و آلکینها توجه کنیم. امیدواریم این جدول مفید واقع شود:

5. خلاصه: افزودن هالیدهای هیدروژن به آلکین ها (هیدروهالوژناسیون)
همانند آلکنها، واکنشهایی که این مسیر را دنبال میکنند از طریق یک واسطه کربوکاتیونی پیش میروند و محصولات “مارکوونیکوف” را به عنوان اصلی ارائه میکنند.
تفاوت اصلی در این مسیر این است که هیدراتاسیون آلکن ها الکل می دهد. در حالیکه هیدراتاسیون آلکین ها مشتقات کربونیل می دهد (یعنی کتون ها/آلدئیدها) پس از توتومر کتو-انول انول میانی.
در پست بعدی، مسیر “حلقه 3 عضوی” با آلکین ها را بررسی خواهیم کرد.
پست بعدی: آلکین ها – مسیر حلقه 3 عضوی
یادداشت
پی نوشت: مسیر ترمولکولی برای هیدروهالوژناسیون آلکین ها
به نظر می رسد واسطه کربوکاتیون های وینیل علاوه بر آلکین ها در سطل “مکانیسم هایی که برای مخاطبان مقدماتی بیش از حد ساده شده اند” تعلق دارد، با این امید که کتاب های درسی در آینده به اجماع برسند.
پروفسور هیلتون وایس از کالج بارد می نویسد:
من روی این موضوع خیلی کار کرده ام و البته به نتایج خودم هم اعتقاد دارم. مقاله اولیه من در مورد رد واسطه کاتیون وینیل (قبل از انجام هر گونه تحقیق) در JChemEd 1993، ص 873 بود… شما ممکن است به کتاب درسی Maitland Jones یا Carey and Sundberg نگاه کنید. در واقع اعتقاد فعلی من این است که کاتیون وینیل در افزودن آلکین ها بسیار نادر است. در مقاله Stang در مورد بازآرایی “کاتیون وینیل تی بوتیل” با حلولیز تری فلات مربوطه، او با افزودن تری فلورومتان سولفونیک اسید به تی بوتیل استیلن، استر تری فلات را ساخت. این افزودن بدون بازآرایی رخ داد. اگر اسید تریفلیک (pKa =-10) یک آلکین را پروتونه نکند، هیچ چیز این کار را نخواهد کرد. آلکین های مزدوج (به عنوان مثال فنیل استیلن) می توانند کاتیون های وینیل مزدوج را تشکیل دهند اما فقط در اسیدهای قوی. اسیدهای آبی حتی نزدیک هم نیستند. (H3O+ =-1.7، HBr = -9، HCl = -7). اگر قوی ترین اسیدها از طریق یک جفت یون کوتاه مدت اضافه شوند، تعجب نمی کنم، اما حتی این نادر است. بیشتر کتابهای درسی میگویند که آلکنها و آلکینها با یک مکانیسم واکنش نشان میدهند: تا زمانی که خیلی نزدیک به آن نگاه نکنید، برای دانشآموزان آسانتر است. به هر حال، مکانیسم ترم مولکولی شامل یک پروتون و یک یون هالید نیست که به طور همزمان به آلکین حمله کنند. خیلی غیر محتمل ابتدا یک کمپلکس پی برگشت پذیر بین اسید و آلکین و به دنبال آن یک هالید متصل به ضد پری صفحه در کربن مثبت تر وجود دارد.
با تشکر از پروفسور ویس برای نوشتن. پیوندی به J. Chem. اد. مقاله اینجاست
(پیشرفته) مراجع و مطالعه بیشتر
اعتقاد بر این است که افزودن HX به آلکین ها از طریق یک کاتیون وینیل پس از پروتوناسیون اولیه آلکین انجام می شود.
- افزودنی های قطبی به الفین ها و استیلن ها. V. مکانیسم های دو مولکولی و ترمولکولی در هیدروکلره استیلن ها
رابرت سی. فاهی و دو-جی لی
مجله انجمن شیمی آمریکا 1968، 90 (8)، 2124-2131
DOI: 1021/ja01010a034
کلرید هیدروژن به آریل استیلن ها در اسید استیک اضافه می کند تا مخلوطی از a-chlorostyrens و وینیل استات مربوطه را به دست دهد. - واکنش استیلن ها با کلرید هیدروژن در اسید استیک. اثر ساختار بر سرعت واکنش AdR2 و Ad3
رابرت سی. فاهی، مایکل تی پین و دو-جی لی
مجله شیمی آلی 1974، 39 (8)، 1124-1130
DOI: 1021/jo00922a024
ترجیح مکانیزم به ساختار فردی آلکین و شرایط کلی واکنش بستگی دارد. - حلولیز وینیل تریفلات. اثر جایگزینهای آلکیل، حلالها و نوکلئوفیلهای اضافه شده
ریچارد اچ سامرویل، کارول ای.سنکلر و پل در برابر آر. شلایر
مجله انجمن شیمی آمریکا 1974، 96 (4)، 1100-1110
DOI: 1021/ja00811a026 - استریوشیمی کاتیونهای وینیل و جایگزینهای وینیل
H. Summerville and Paul v. R. Schleyer
مجله انجمن شیمی آمریکا 1974، 96 (4)، 1110-1120
DOI: 10.1021/ja00811a027
آلکین ها هنگامی که با اسید تری فلورواستیک حرارت داده می شوند واکنش نشان می دهند و محصولات افزودنی ایجاد می کنند. مخلوط های syn و ضد محصولات افزودنی به دست می آیند و واکنش های مشابه با اسید تری فلورومتان سولفونیک (تریفلیک) رخ می دهد. این واکنش ها احتمالاً از طریق یک واسطه کاتیون وینیل نیز انجام می شود. - بررسی های نظری در مورد کربوکاتیون ها. ساختار و پایداری C3اچ5+، سی4اچ9+(کاتیون ۲-بوتیل)، C5اچ5+، سی6اچ7+(بنزن پروتونه) و C7اچ11+(کاتیون 2-نوربورنیل)
هانس یواخیم کوهلر و هانس لیشکا
مجله انجمن شیمی آمریکا 1979، 101 (13)، 3479-3486
DOI: 1021/ja00507a009
یک مکانیسمی که برای این واکنش پیشنهاد شده است، پروتوناسیون اولیه آلکین از طریق یک واسطه پل شده است. این مقاله نشان می دهد که این ساختار پل هیدروژنی از نظر انرژی امکان پذیر نیست. محاسبات مختلف MO یون پل شده را 30-45 کیلوکالری در مول بالاتر از کاتیون وینیل از نظر انرژی قرار می دهد. - سینتیک هیدراتاسیون اسیدی آلن و پروپین
پل کرامر و توماس تی تیدول
مجله شیمی آلی 1981، 46 (13)، 2683-2686
DOI: 1021/jo00326a016
اثرات ایزوتوپ حلال نشان دهنده یک پروتوناسیون تعیین کننده سرعت است. - اثرات جایگزین بر هیدراتاسیون اسیدی استیلن ها
آنت دی. آلن، ایون چیانگ، ای جی کرسگ و توماس تی. تیدول
مجله شیمی آلی 1982، 47 (5)، 775-779
DOI: 1021/jo00344a006
واکنش آلکین با افزودن جانشین های الکترون دهنده افزایش می یابد. واکنش پذیری آلکین ها نسبت به آلکن ها نسبت به اثرات جانشین تا حدودی حساس تر است. - 2- بوتین و کلرید هیدروژن هم کریستالیزه شده: هندسه حالت جامد Cl-H••پ پیوند هیدروژنی به پیوند سه گانه کربن-کربن
دیتریش موتز و اکسل دیگ
مجله انجمن شیمی آمریکا 1992، 114 (14)، 5887-5888
DOI: 10.1021/ja00040a077
طول کوتاه این JACS ارتباط دشواری این کار آزمایشی را رد می کند! این مقاله یک ساختار پرتو ایکس از کمپلکس اضافه بین HCl و یک آلکین را با HCl عمود بر پیوند CC p توصیف میکند. - افزودن الکتروفیل به آلکین ها
هیلتون ام ویس
مجله آموزش شیمی 1993، 70 (11)، 873
DOI: 1021/ed070p873
این مقاله استدلال میکند که کاتیونهای وینیل بسیار ناپایدار هستند و بنابراین نمیتوانند واسطهای در افزودنهای الکتروفیل به آلکینها باشند. این کاملاً صحیح نیست، زیرا کاتیون های وینیل در محیط های فوق اسیدی تحت شرایط مناسب مشاهده شده اند. - افزودن برمید هیدروژن برمید به آلکین ها و آلن ها به کمک برومید
هیلتون ام. وایس و کیم ام. توچت
جی. شیمی. Soc. پرکین ترانس 2 1998: 1523
DOI: 10.1039/A703569A
واکنش 4-اکتاین با TFA در CH2Cl2 حاوی 0.1-1.0 م یون برمید عمدتاً از طریق ضد علاوه بر این. حضور یون برومید در مقایسه با واکنش با TFA به تنهایی واکنش را به شدت تسریع می کند، که نشان دهنده دخالت Br است.– در مرحله تعیین نرخ
- مطالعه انتقال الکترون از تقسیم پ* اوربیتالهای مولکولی استیلنهای حلقوی با کرنش زاویهای: مفاهیمی برای الکتروفیلی بودن آلکینها
لیلی نگ، کنت دی. جردن، آدولف کربس، و ولفگانگ روگر
مجله انجمن شیمی آمریکا 1982، 104 (26)، 7414-7416
DOI: 1021/ja00390a005
توضیح احتمالی دیگر برای واکنش پذیری کمتر آلکین ها نسبت به آلکن ها مربوط به در دسترس بودن اوربیتال پر نشده در آلکین است. نشان داده شده است که اوربیتال ap* آلکین های خمیده (مثلا سیکلوکتین) انرژی کمتری نسبت به اوربیتال p* آلکن ها دارد و پیشنهاد شده است که آلکین های خطی می توانند در هنگام واکنش با الکتروفیل به ساختار خمشی در حالت های گذار خود دست یابند.
