کمی سازی اساس آمین ها، با استفاده از “pKآ از اسید مزدوج، با نام مستعار “pKآH”
چگونه پایه یک آمین را اندازه گیری می کنید؟ مورد اصلی: پایه قوی تر چیست: پیریدین یا پیپریدین؟
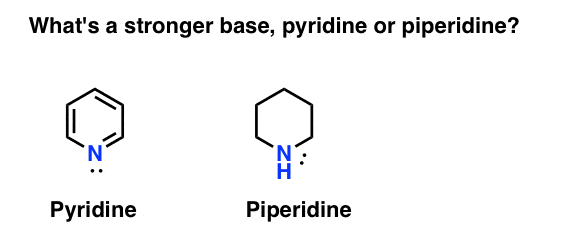
اگر گفتید پیپریدین، به شما تبریک می گویم – این در واقع پایه قوی تری است.
اما چرا؟ و چقدر قوی تر؟ تلاش برای پاسخ به این سوالات چگونه است؟ از این گذشته، ما به راحتی می توانیم قدرت اسیدها را با بررسی pK آنها مقایسه کنیمآ‘s آیا ما هم نباید همین کار را با پایگاه ها انجام دهیم؟
بله، به نوعی. در اینجا سه نکته کلیدی برای امروز وجود دارد:
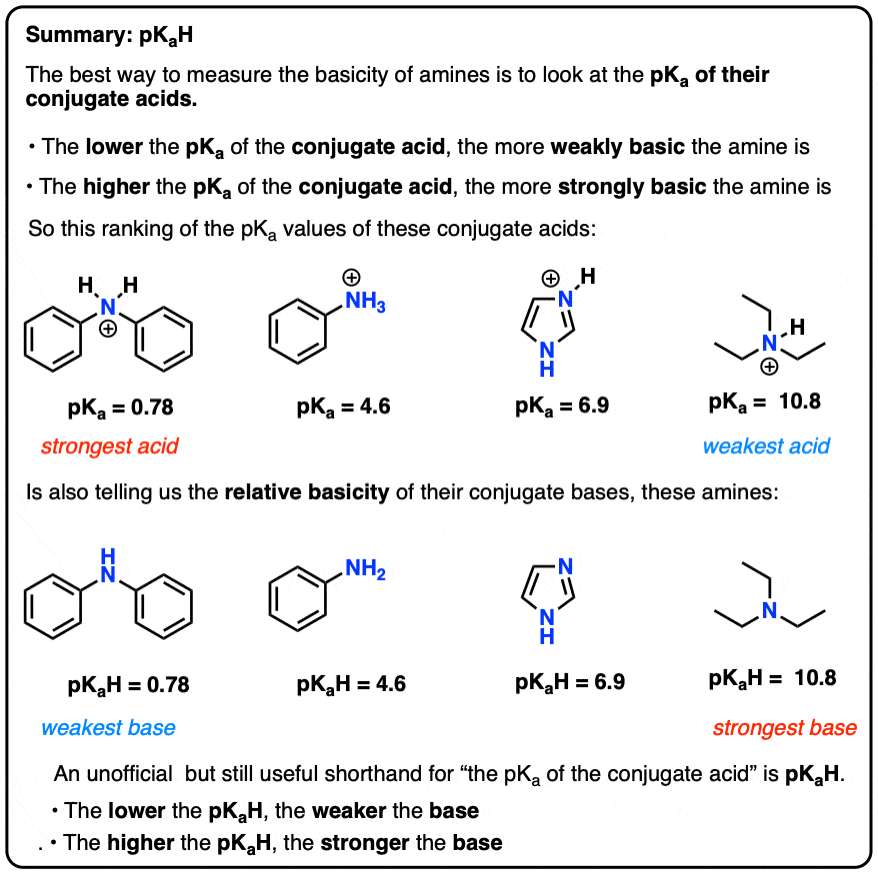
- بهترین راه برای تعیین کمیت بازی یک آمین، بررسی pK استآ اسید مزدوج آن
- هر چه pK بالاتر باشدآ از اسید مزدوج، باز قوی تر است.
- یک غیر رسمی ولی مفید مختصر برای “pKآ از اسید مزدوج” این اصطلاح است pKآاچ
فهرست مطالب
- بررسی سریع: اسیدها، بازها، اسیدهای مزدوج و بازهای مزدوج
- استفاده از pKa برای اندازه گیری اسیدیته
- استفاده از pKa برای تعیین کمیت پایه آمین ها
- “pKa از اسید مزدوج” را می توان به اختصار “pKaH” نامید
- استفاده از pKaH برای تعیین پایه های نسبی آمین ها
- چند کلمه احتیاط در مورد مقادیر pKa برای آمین ها
- چه عوامل کلیدی بر اساس آمین ها حاکم است؟
- یادداشت
1. بررسی سریع: اسیدها، بازها، اسیدهای مزدوج و بازهای مزدوج
ابتدا اجازه دهید به سرعت برخی از اصول اولیه را مرور کنیم.
در هر واکنش اسید-باز چهار بازیگر وجود دارد.
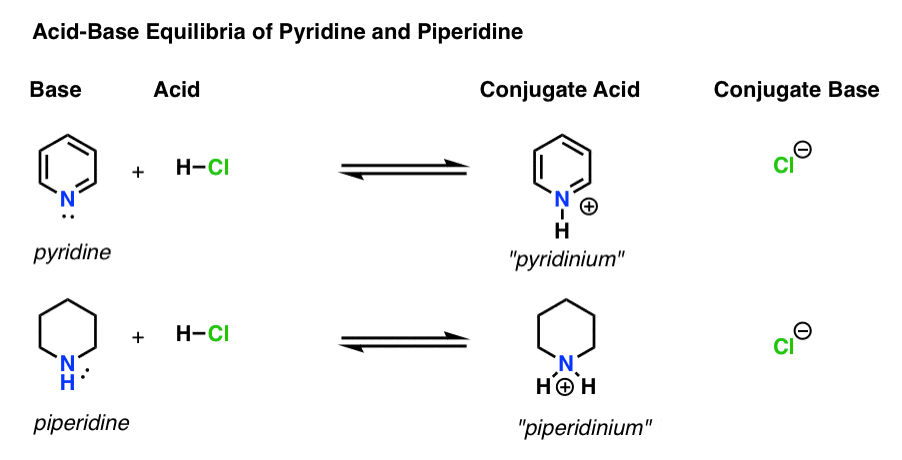
- را پایه گونه ای است که یک جفت تنها را به H+ (همچنین به عنوان “پروتون” یا “هسته هیدروژن” شناخته می شود) اهدا می کند. این جایی است که پیوند جدید به H شکل می گیرد (به عنوان مثال پیریدین، زیر)
- را اسید مزدوج گونهای است که پس از ایجاد پیوند پایه با H به وجود میآید (به عنوان مثال “پیریدینیوم” که دارای پیوند N-H جدید است)
- را اسید گونه ای است که H+ را از دست می دهد. جایی است که پیوند به H شکسته می شود (به عنوان مثال H–Cl)
- را پایه مزدوج گونه ای است که پس از اهدای اسید H+ به باز باقی می ماند (مانند Cl-)
در اینجا پیریدین و پیپریدین در عمل هستند. با پیروی از پیوندهایی که شکل می گیرد و می شکند، می توانید هر بازیگر را شناسایی کنید.
2. با استفاده از pKآ برای اندازه گیری اسیدیته
هر واکنش اسید-باز را می توان به عنوان یک تعادل بین واکنش رو به جلو و معکوس نوشت. ما دیدیم که ثابت اسیدیته، Kآ، معیاری است که نشان می دهد چگونه یک گونه به راحتی تفکیک می شود تا H+ و پایه مزدوج را به دست دهد.
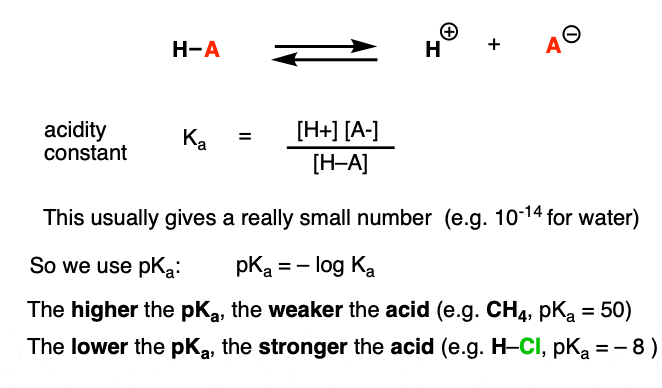
برای راحتی کار از لاگ منفی K استفاده می کنیمآ، pK نامیده می شودآکه شبیه به مقیاس pH آشنا است، اما می تواند فراتر از 14 باشد، زیرا محدود به حلال های آبی نیست. pKآ مقادیر از -10 یا بیشتر برای اسیدهای بسیار قوی (به عنوان مثال اسید هیدرویدیک، H-I) تا 50 و بالاتر برای هیدروکربن های خاص (مانند اتان) متغیر است.
چگونه می توانیم این مفاهیم را برای اندازه گیری پایه به کار ببریم؟ آیا نمیتوانیم همه چیز را عوض کنیم و یک اصطلاح تعریف کنیم، Kبکه تعادلی برای چگونگی ترکیب آسان یک گونه با H+ است، pK را تعریف کنید.ب به عنوان گزارش منفی آن، و پایه ها را با مشاهده pK آنها مقایسه کنیدب ارزش های؟
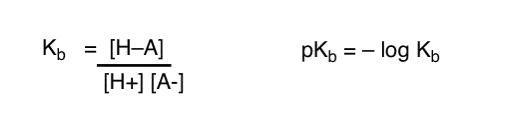
آره…. ما توانستیم حدس می زنم. اگر مجبور بودیم. اما به طور کلی، نظر شیمیدانان آلی در مورد این موضوع “Screw pKب“.
پس از همه، pKآ مقادیر برای هزاران مولکول آلی اندازه گیری شده است. آیا کسی واقعاً می خواهد مجموعه عظیمی از pK را به خاطر بسپارد؟ب ارزش ها هم؟ ابدا!
در عوض، ما به راحتی می توانیم از pK استفاده کنیمآ ارزش ها به عنوان اندازه گیری غیرمستقیم پایه. در اینجا چگونه است.
3. با استفاده از pKآ ارزش ها برای تعیین کمیت پایه آمین ها
این دو خط نثر جاودانه را که ارزش خواندن هر شب برای خود را دارد به خاطر بیاورید:
[Don’t leave out the word “conjugate” ! Note 1]
pKآ برای اسید مزدوج پیریدین (“pyridinium”) اندازه گیری شده است. حدود 5.2 است. [Source – also see Footnote 2]
ما همچنین مقداری برای pK داریمآ برای اسید مزدوج پیپریدین حدود 11 است.
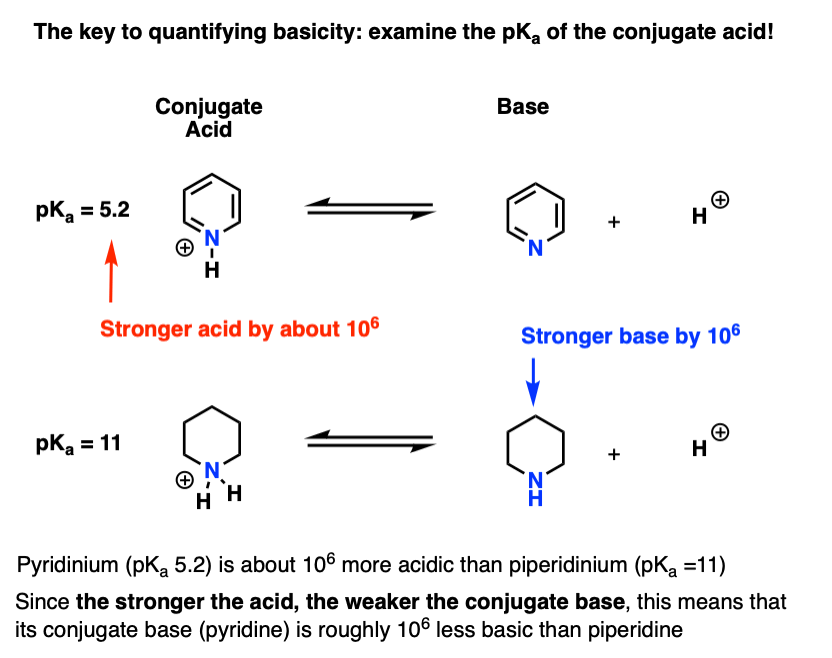
از این pKآ مقادیر، می توان گفت که اسید مزدوج پیریدین در حدود 6 pK قوی تر از اسید مزدوج پیپریدین است.آ واحدها از آنجایی که هر pKآ واحد نشان دهنده ضریب 10 است، این ضریب حدود 1 میلیون است.
از آنجایی که «هرچه اسید قویتر باشد، باز مزدوج ضعیفتر است»، بنابراین پیریدین یک باز ضعیفتر از پیپریدین با ضریب 1 میلیون است.
4. «pKآ از اسید مزدوج می توان به اختصار “pKآH”
اصطلاح “pKآ از اسید مزدوج” برای استفاده به طور منظم کمی دمنوش است. از آنجایی که به طور طبیعی تنبل هستیم، میخواهیم این را برای استفاده رایج کمی متراکم کنیم.
از آنجایی که اسید مزدوج یک باز (“B”) “BH” است، می توانیم “pK” را مخفف کنیم.آ اسید مزدوج یک باز» به عنوان آن pKآاچ.
این به ما اجازه می دهد بگوییم که pKآH پیریدین 5.2 و pK استآH پیپریدین 11 است.
سپس میتوانیم ادبیات را بررسی کنیم تا پایههای دیگری برای مقایسه آن پیدا کنیم.
به عنوان مثال، آمونیاک دقیقاً چقدر اساسی است (NH3)؟ اسید مزدوج آمونیاک، NH4(+)، 9.2 است. به طور معادل، می توان گفت که pKآH آمونیاک 9.2 است. این آن را در مقیاس اساسی بین پیریدین و پیپریدین قرار می دهد.
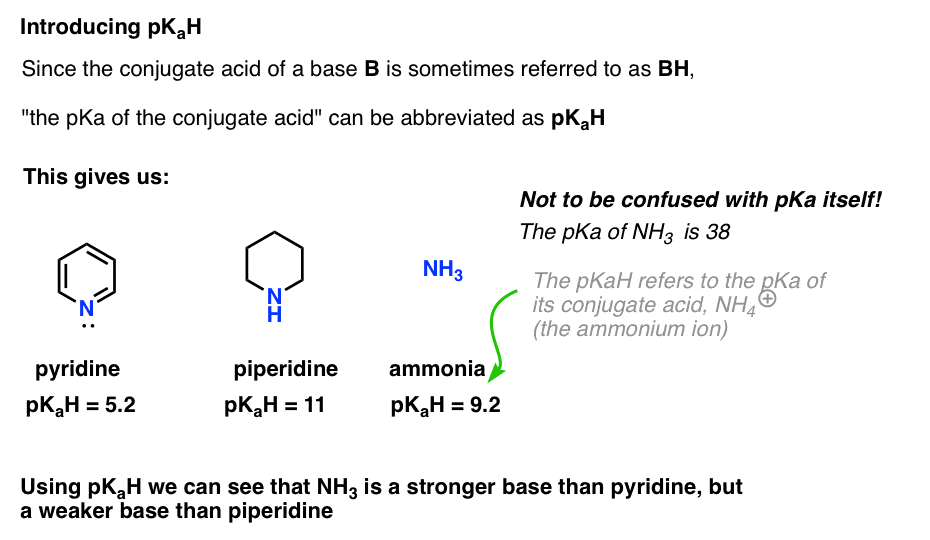
توجه داشته باشید که خیلی مهم است که pK را اشتباه نگیریدآH با pKآ. pKآH آمونیاک 9.2 است که اسیدیته اسید مزدوج آن NH را اندازه می گیرد4(+).
pKآ آمونیاک خود 38 است که ثابت تعادل را برای تفکیک NH اندازه گیری می کند3 برای دادن پایه مزدوج آن، NH2(-) و H+.
یعنی 38 pK استآH از یون آمید NH2(-)، که ممکن است قبلاً به عنوان پایه قوی (NaNH2) برای پروتون زدایی آلکین های انتهایی (pKآ = 25). با استفاده از pKآH، ما می توانیم NH را تعیین کنیم2(-) تقریباً (38-9) = 29 مرتبه قدر اساسی تر از NH است.3 !
5. استفاده از pKآH برای تعیین پایه های نسبی آمین ها
با استفاده از pKآH برای تعیین قدرت نسبی پایه ها یک ترفند بسیار مفید است.
در اینجا نمونه هایی از مولکول های حاوی نیتروژن آورده شده است. در زیر pK آمده استآ اسیدهای مزدوج آنها
قوی ترین پایگاه اینجا چیست؟ ضعیف ترین چیست؟
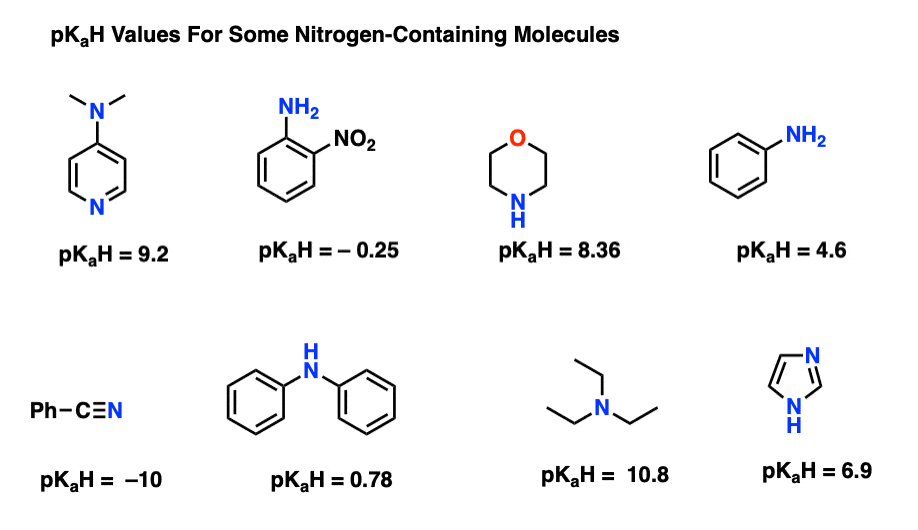
پایین ترین pKآمقدار H در اینجا 10- برای نیتریل است (پایین سمت چپ). این بدان معنی است که نیتریل کمترین پایه در بین همه این مولکول ها است.
بالاترین pKآمقدار H در اینجا برای تری اتیلامین 10.8 است. این باعث می شود تری اتیلامین قوی ترین پایه در بین تمام موارد ذکر شده باشد.
6. چند کلمه احتیاط در pKآ ارزش برای آمین ها
دو نکته که باید مراقب آن باشید، به خصوص هنگام خواندن سایر منابع آنلاین در مورد این موضوع.
اولین، گاهی اوقات pKآمقادیر H برای آمین ها به صورت pK گزارش می شودآ ارزش های ، بدون توضیح بهترین pKآ جداول این کار را انجام نمی دهند، اما زمانی که تازه شروع به کار می کنید، سخت است که گندم را از کاه جدا کنید.
اگر pK به طور غیرعادی پایین مشاهده کردیدآ ارزش یک آمین، احتمالاً به آن اشاره دارد pKآاچ ، pKآ از اسید مزدوج
به عنوان مثال، شما ممکن است یک pK را ببینیدآ جدول که در آن pKآ متیل آمین (CH3NH2) به عنوان 10.63 فهرست شده است.
این کم است. امیدواریم تا این مرحله، چنین مقدار 10 برای یک pK باشدآ یک آمین باید برای شما عجیب باشد، به خصوص که pKآ از NH نزدیک مرتبط3 38 است.
مقدار 10.63 در واقع به pK اشاره داردآ از اسید مزدوج متیل آمین، نه خود متیل آمین. این یک pK استآمقدار H.
به طور مشابه، همان جدول تری متیل آمین را با pK فهرست می کندآ از 9.8 باز هم، این در واقع pK آن استآH. من نمی توانم یک pK واقعی پیدا کنمآ مقدار تری متیل آمین است، اما من حدس می زنم که بیشتر از 40 باشد، زیرا پایه مزدوج تری متیل آمین کاربانیون است (CH3)2N–CH2(–) ).
دومین منبع سردرگمی کمتر رایج این است که گاهی اوقات pKآH از یک آمین به عنوان pK آن گزارش می شودبمانند این جدول که pK را گزارش می کندب از NH3 به عنوان 9.2. این نادرست است.
[The pKb of NH3 can be calculated from the formula pKaH + pKb = 14 . The pKb of NH3 is 4.8 (aqueous solution). ]
دوباره، pKب مقادیر واقعاً در شیمی آلی در مقطع کارشناسی زیاد مطرح نمی شوند، اگرچه به من گفته می شود که آنها گاهی اوقات در DAT/MCAT ظاهر می شوند.
7. چه عوامل کلیدی بر اساس آمین ها حاکم است؟
اکنون که ما حداقل یاد گرفتیم که چگونه pK را کمی سازی و تفسیر کنیمآ مقادیر آمین ها و اسیدهای مزدوج آنها، می توانیم این سوال کلیدی را بپرسیم: چرا؟ چه عوامل کلیدی بر پایه آمین ها حاکم است؟ گرایش های مهم چیست؟
برای مثال، چرا آیا پیریدین باز ضعیف تری نسبت به پیپریدین است؟ چرا نیتریل ها بازهای ضعیف تری هستند؟ چرا گروه های خارج کننده الکترون تمایل دارند آمین ها را بازهای ضعیف تری بسازند؟
خبر خوب این است که اگر از قبل عواملی را که اسیدیته را کنترل میکنند، درک کردهاید، باید دقیقاً همان اصول را اعمال کنید – اما برعکس!
در پست بعدی به آن خواهیم پرداخت. پنج عاملی که بر پایه آمین ها تأثیر می گذارد
یادداشت
یادداشت 1. اسیدهای زیادی وجود دارند که غیر باز هستند (مانند NH4 که فاقد یک جفت تنها است) و بسیاری از بازهایی که غیر اسیدی هستند، مانند Cl(–) که قادر به پذیرش یک جفت تنها نیست. بنابراین، گفتن “اسید قوی تر، باز ضعیف تر” اشتباه است.
تبصره 2. این اندازه گیری با استفاده از آب به عنوان حلال است. ممکن است مقدار دیگری را مشاهده کنید، 3.4، که وقتی دی متیل سولفوکسید (DMSO) به عنوان حلال استفاده می شود، به دست می آید. Bordwell pK را ببینیدآ جداول (DMSO)
