آخرین بار در این مجموعه در مورد معادله کولن و اهمیت آن برای درک برهمکنش الکترواستاتیک بین الکترون و هسته صحبت کردیم.
بیایید سوال بعدی را بپرسیم. وقتی دو اتم را به هم نزدیک کنید چه اتفاقی می افتد؟
در اینجا یک نمودار نشان می دهد که دو اتم هیدروژن HA و HB در مجاورت یکدیگر قرار گرفته اند.
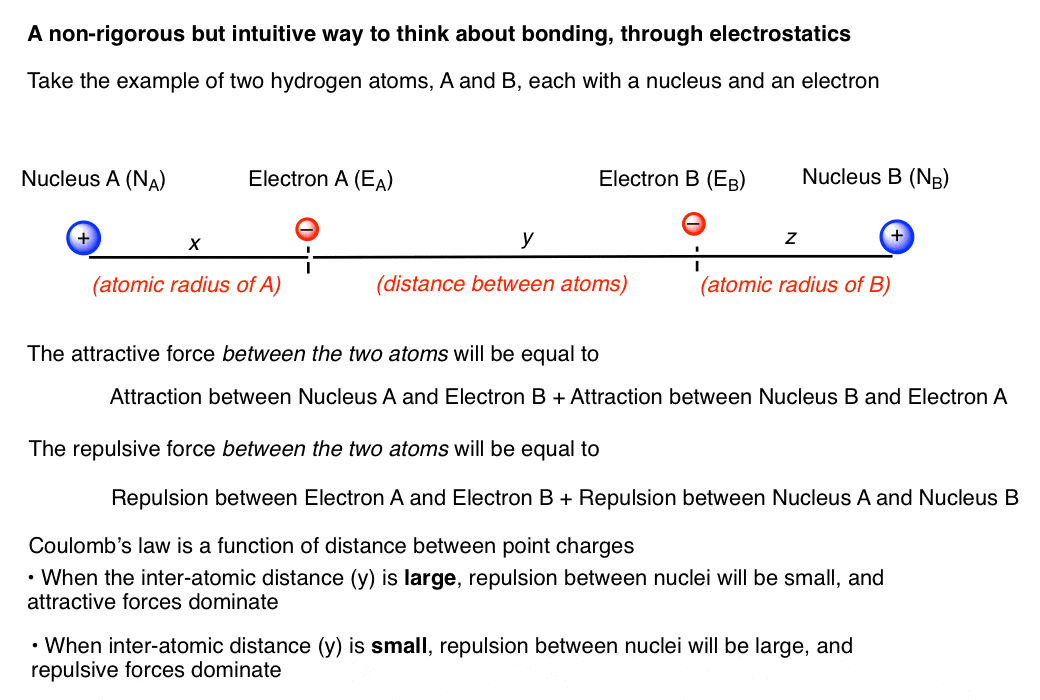
بارهای مخالف جذب می شوند و اتهامات مشابه دفع می شوند. ما در اینجا در مورد برهمکنش های بین دو اتم صحبت می کنیم، بنابراین برهمکنش های هسته A/الکترون A و هسته B/الکترون B را کنار می گذاریم. برای یک لحظه با در نظر گرفتن معادله کولن، حداقل 4 چیز وجود دارد که باید در مورد آنها فکر کنیم:
1) جاذبه بین الکترون A و هسته B
2) جاذبه بین الکترون B و هسته A
3) دافعه بین الکترون های A و B
4) دافعه بین هسته های A و B.
اگر در مورد آن فکر کنید، دو برهمکنش اول در واقع همان اندازه هستند. بنابراین وجود دارد دو نیروهای جاذبه بین الکترون ها در این موقعیت ها بین هسته ها. مخالف این نیروی جاذبه، دافعه بین دو الکترون است. به طور کلی، نیروی جاذبه بین الکترون ها و هسته ها بر عبارت دافعه الکترون غالب است، که منجر به مشاهده این می شود که انرژی برهمکنش با کاهش فاصله بین مولکولی افزایش می یابد.
بنابراین به طور خلاصه، نیروی جاذبه با فاصله نسبت عکس دارد. هر چه آنها نزدیک تر باشند، جاذبه قوی تر است. الکترون ها در مرز اتم قرار دارند و بنابراین به هسته دیگر نزدیکتر هستند. از آنجایی که فاصله (x+y) در معادله کولن کوتاهتر از فاصله بین هستهای (x+y+z) خواهد بود، جاذبه در فواصل طولانیتر غالب خواهد بود.
با این حال، یک گرفتاری وجود دارد. وقتی d به اندازه کافی کوچک می شود (یعنی وقتی “y” در معادله ما کوچک می شود)، دافعه بین هسته ها شروع به بازی می کند. نقطه عطف را در نمودار زیر می بینید؟ با نزدیک شدن اتم ها به یکدیگر، نرخ تغییر انرژی برهمکنش با فاصله شروع به کاهش می کند و در نهایت به حداقل می رسد. در نهایت آنها با “نقطه ای شیرین” روبرو می شوند که در آن دو نیرو در تعادل هستند.
نامی که ما به این “نقطه شیرین” می دهیم طول پیوند است.
و انرژی تثبیت در این فاصله؟ به آن انرژی تفکیک پیوند می گویند (یا گاهی اوقات استحکام پیوند).
راه دیگری برای فکر کردن به آن نقطه گلدیلاک است. نه خیلی طولانی، نه خیلی کوتاه – درست است، به طوری که نیروهای جذاب و دافعه متعادل شوند.
من یک نمودار کوچک تقریبی از تعامل ایجاد کردم که در اینجا نشان داده شده است:
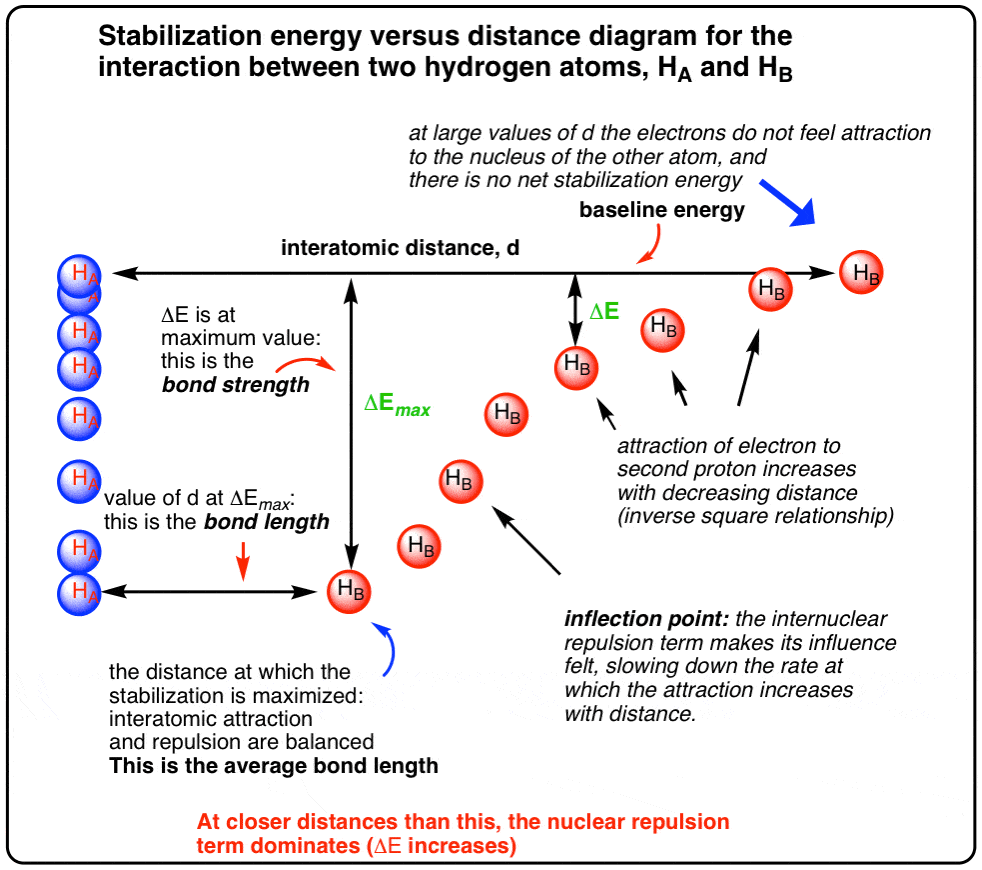
یک نمودار رسمیتر از این تعامل از LiqC از کنجکاویهای مبتنی بر کربن (که اکنون از بین رفتهاند) میآید، که به من اجازه داد تا نمودار زیبای ظاهری این انرژی تعاملی را بازتولید کنم.
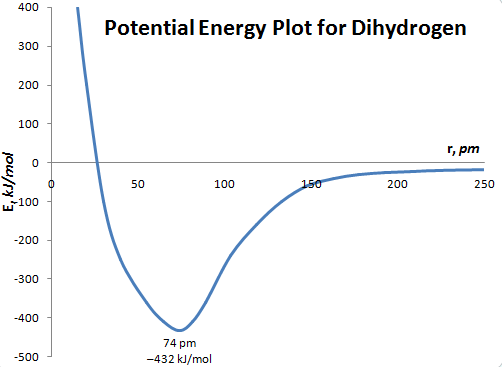
به نقطه گلدیلاک در طول پیوند 74 پیکومتر (0.74 Å) و انرژی 432 کیلوژول بر مول توجه کنید، و با کاهش طول پیوند از این نقطه، ΔE چگونه سر به فلک میکشد.
استعاره هایی برای این نوع تعاملات در همه جا وجود دارد. ممکن است والدینتان شما را دیوانه کنند [far left hand area of graph]. بنابراین تصمیم می گیرید به مدرسه در جایی دور، دور بروید [far right hand part of graph]. سپس متوجه میشوید که غافلگیرکننده، دلتان برایشان تنگ شده است. بنابراین شما به منطقه برمی گردید. اما نه هم بستن!
توجه داشته باشید – این بحث به اوربیتال ها یا مکانیک کوانتومی اشاره نمی کند، اما برای اینکه در مثال ما الکترون ها در مجاورت نزدیک باشند، باید اسپین مخالف داشته باشند. این به دلیل اصل طرد پائولی است که می گوید هیچ دو الکترونی نمی توانند حالت کوانتومی یکسانی را در یک اتم یا مولکول اشغال کنند.
پست بعدی: از ژنرال شیمی تا شیمی آلی، قسمت 5 – درک روندهای دوره ای
