اگر یک دوره فیزیک را گذرانده اید، احتمالاً موضوع هیجان انگیز (برای برخی) الکترواستاتیک را پوشش داده اید. یک فرمول اساسی وجود دارد که به شما امکان می دهد نیروی بین دو بار نقطه ای را محاسبه کنید. ما این رابطه را قانون کولن می نامیم.

برای اهداف خود ما واقعاً علاقه ای به تعیین کمیت بزرگی نیروها نداریم. اینجا همان نقطه ای است که می توانید شیمیدان های آلی را به خاطر دوست نداشتن ریاضیات مسخره کنید. من ترجیح میدهم به این فکر کنم که ما بیشتر علاقهمندیم که بفهمیم متغیرها چقدر متفاوت هستند مربوط به یکدیگر. بنابراین اجازه دهید آن را کمی بجوشانیم و سپس وارد جزئیات شویم. اولین بار q1 را بار الکترون می نامیم. این همیشه -1 خواهد بود. جزء دوم q2 است بار هسته ای همانطور که خواهیم دید این با تعداد پروتون های هسته متفاوت خواهد بود. در نهایت، r، فاصله بین آنها را داریم. در نهایت، ما از شر علامت تساوی و ثابت برای برجسته کردن خلاص خواهیم شد متناسب ماهیت این روابط
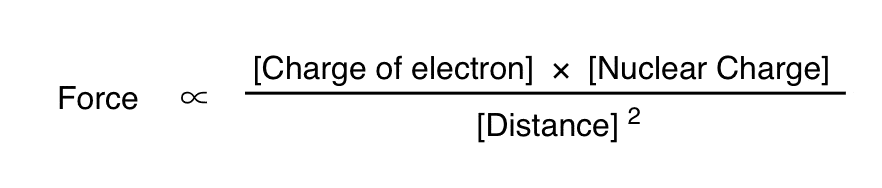
یک نکته قابل توجه – نشانه ها مخالف هستند، بنابراین یک عدد منفی به دست می آوریم که دلالت بر نیروی جاذبه دارد. اگر بارها یکسان بودند، نیرو یکسان بود اما در جهت مخالف (یعنی دافعه) عمل می کرد. ثانیاً، در حالی که درست است که الکترونها همدیگر را دفع میکنند، اما برای اهداف ما نسبتاً کوچک است و ما آن را نادیده میگیریم.
دو مشاهده:
1) نیرو به نسبت مجذور فاصله سقوط می کند. بنابراین در مثال ما، هنگامی که الکترون دو برابر دورتر از هسته حرکت می کند، نیرو 1/4 بزرگتر خواهد بود. به یاد داشته باشید که الکترون ها نمی توانند به سادگی بروند هر جا – موقعیت آنها توسط اوربیتال ها تعیین می شود. بنابراین با پر شدن اوربیتال ها، برهمکنش بین الکترون های ظرفیت (الکترون های دارای بالاترین انرژی) و هسته کمتر می شود.
2) از آنجایی که بار الکترونیکی ثابت است، بزرگی برهمکنش به شدت به بار هسته ای بستگی دارد.. چگونه بار هسته ای را محاسبه کنیم؟ بیایید به سدیم نگاه کنیم. الکترون ظرفیت سدیم در اوربیتال 3s قرار دارد. عدد اتمی سدیم 11 است، یعنی 11 پروتون در هسته دارد. بنابراین ساده لوحانه ممکن است 11+ را به عنوان بار هسته ای نسبت دهیم. هرچند این خیلی منطقی نیست. اگر به نمودار انرژی های یونیزاسیون در مقابل عدد اتمی نگاه کنید، آنها یک رابطه تناوبی دارند، بنابراین چیز پیچیده تری در حال وقوع است.

اتفاقی که در واقع میافتد این است که الکترونهای با انرژی کمتر در پوستههای پر شده، از بار هستهای محافظت میکنند. بنابراین برای دریافت تصویر بهتری از نیروی واقعی وارد بر الکترون، باید آن را در نظر بگیریم. ما به این می گوییم بار هسته ای موثر یا زف.
اگر ما ساده لوحانه از اثرات دافعه الکترون ها بر یکدیگر چشم پوشی کنیم [and also ignore the howls of outrage from the theoretical chemists as we do so]، می توانیم یک مقدار تقریبی برای بار موثر هسته ای به شرح زیر بدست آوریم:
زف = عدد اتمی – عدد اتمی گاز نجیب قبلی.
با استفاده از این، Zeff(Na) = 11 – 10 را دریافت می کنیم [Ne] = 1
با استفاده از این فرمول، تمام فلزات قلیایی دارای Zeff +1، تمام خاک های قلیایی دارای Zeff +2، هالوژن ها +7 و غیره هستند.
این عدد زف است که بیشترین تأثیر را بر شخصیت هر یک از طبقات اتم دارد.
بنابراین بر اساس معادله ما می توانیم با اطمینان چندین پیش بینی مهم انجام دهیم
- انرژی یونیزاسیون (انرژی مورد نیاز برای از بین بردن یک الکترون) در حال انجام است نزول کردن همانطور که ما می رویم پایین جدول تناوبی، زیرا ما در حال افزایش فاصله هستیم. این به وضوح توسط واکنش های فلزات قلیایی مختلف با آب نشان داده می شود.
- انرژی یونیزاسیون در حال رفتن به افزایش دادن همانطور که حرکت می کنیم در سراسر جدول تناوبی، از آنجایی که ما زف را افزایش می دهیم.
- هرچه پیش برویم شعاع اتمی افزایش خواهد یافت پایین جدول تناوبی، از آنجایی که الکترون ها کمتر محکم نگه داشته می شوند.
- زف به a می رسد بیشترین در پیکربندی گاز نجیب (زف = 8). با این پیکربندی الکترونیکی، هر الکترون کشش 8 پروتون را روی خود احساس می کند.
این دلیل عمیق قاعده هشتگانه است. اگر بخواهیم یک الکترون اضافی به نئون اضافه کنیم (که باید به اوربیتال 3s برود)، الکترون زف 0 را احساس میکند. ما آن را در مداری قرار می دهیم که در آن جاذبه بین هسته و الکترون توسط الکترون های میانی محافظت می شود. برعکس، تلاش برای حذف یک الکترون از نئون دشوار است، زیرا هر الکترون کشش هشت پروتون را بر روی خود احساس می کند، که یک برهمکنش الکترواستاتیک بسیار قدرتمند است.
این معادله همچنین به توضیح الکترونگاتیوی عناصر کمک می کند. چرا فلوئور الکترونگاتیوترین عنصر است؟ زیرا الکترونها بیشترین بار مؤثر هسته ای را احساس می کنند (Z=7) و نزدیکترین آنها به هسته هستند (یعنی d کوچکترین است).
الکترونگاتیوی دارای یک است بزرگ اثر در شیمی آلی، همانطور که خواهیم دید. بنابراین درک نحوه تولید آن از فرمول بالا به شما کمک می کند تا احساسی بصری از نحوه کار آن به شما بدهد.
