
[photo credit]
یک اتم (کمی) شبیه اتوبوس هندی است.
اینجوری کار میکنن
وارد می شوید و یک صندلی خالی پیدا می کنید. صندلی ها پر می شود.
سپس مردم در راهرو می ایستند. راهرو پر می شود.
سپس مردم روی پشت بام می روند. سقف پر می شود. (یا نه).
سپس شما آماده رفتن هستید.
صندلی ها راحت ترین مکان برای سوار شدن هستند. به همین دلیل اول پر می شوند. آیا تا به حال در اتوبوسی بوده اید که همه در راهرو بایستند و کسی روی صندلی ها ننشیند؟ البته که نه. ما خیلی تنبل هستیم که اجازه دهیم این اتفاق بیفتد.
فرض کنید اتوبوس در روستایی می ایستد و شخصی صندلی خود را ترک می کند تا پیاده شود. یک نفر دیگر از راهرو بلافاصله جای آنها را می گیرد. سپس جایی برای کسی وجود دارد که از پشت بام به راهرو برود. سپس روی پشت بام اتاقی برای سوار شدن مسافری از روستا وجود خواهد داشت. [yes, I can understand that maybe the roof could be more comfortable than the aisle in a hot crowded bus. Bear with me.]
شاید بتوانیم نمودار راحتی را در اینجا ترسیم کنیم.
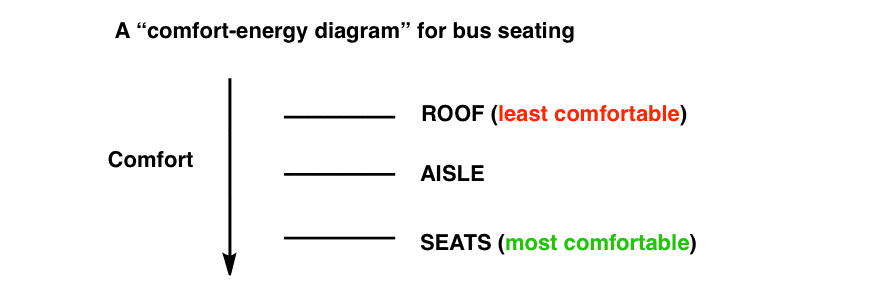
اگر به اطراف نگاه کنید نمونه های زیادی از این رفتار را خواهید دید. صف ها چیدمان صندلی در اتاق نشیمن در مهمانی های Super Bowl. کنسرت های با پذیرش آزاد هر زمان که یک مکان ترجیحی خالی می شود، عجله ای برای پر کردن آن وجود دارد.
الکترونهای موجود در یک اتم درست مانند مسافران اتوبوس هستند: هر کدام به خود نیاز دارند خود صندلی، و صندلی ها به ترتیب خاصی پر می شوند. اصل “یک لب به لب در هر صندلی” وجود دارد – همانطور که شما نمی توانید 2/3، 0.17 یا کسر دیگری از یک انسان را داشته باشید، نمی توانید کسری از یک الکترون را نیز داشته باشید. منظور ما این است کوانتیزاسیون. این واقعیت که آنها یک ترتیب خاص را پر می کنند، اصل aufbau یا اصل ساخت نامیده می شود.
«صندلیها» برای الکترونها مناطقی از فضا هستند که آنها را اوربیتال مینامیم. اوربیتال ها مناطقی از فضا هستند که نمودارهای سه بعدی از مکان احتمالی الکترون را نشان می دهند. در حالی که صندلی ها با شکل انسان مطابقت دارند، اشکال اوربیتال ها با معادله ای که در دهه 1920 توسط اروین شرودینگر توسعه یافت و ما آن را معادله موج شرودینگر می نامیم، توصیف می شوند. (شرودینگر متوجه شد که انرژی الکترون ها را می توان با در نظر گرفتن امواج به طور کاملاً مؤثر محاسبه کرد).
اگر دوره های شیمی سطح بالایی را بگذرانید، یاد می گیرید که چگونه با معادله موج شرودینگر بازی کنید. اگر نه، در اینجا نسخه آماده شده است.
همانطور که مردم به دنبال راحتترین صندلی در اتوبوس هستند، الکترونها به دنبال اوربیتالی هستند که به هسته نزدیکتر است – جایی که نیروی جاذبه بین هسته با بار مثبت و الکترون با بار منفی بیشتر است.
- الکترون ها هم به صورت ذرات و هم به صورت موج رفتار می کنند. با در نظر گرفتن الکترون ها به عنوان امواج، اوربیتال ها اشکالی هستند که مناطقی از فضا را توصیف می کنند که امکان همپوشانی موج سازنده را فراهم می کند. [note – orbitals are the areas where there’s a 95% probability of finding the electron]
- هر الکترون روی یک اتم یک “کد شناسایی” یا عدد کوانتومی منحصر به فرد دارد. [Triva: this property that the quantum numbers not be the same is a general property of a class of particles called fermions, to which electrons belong; these are distinguished from bosons, which can occupy the same quantum states (photons are a prominent example, but you may have heard of the Higgs boson).] چهار عدد کوانتومی عبارتند از:
- عدد کوانتومی اصلی n. این سطح انرژی الکترون را مشخص می کند که در نهایت بازتابی از نزدیکی آن به هسته است. این همچنین تعداد «گرهها» (مناطق با چگالی الکترون صفر) را در یک اوربیتال مشخص میکند. اگر به مثال اتوبوس خود برگردیم، یک قیاس تقریبی n=1 (صندلی)، n=2 (راهرو)، n=3 (سقف) خواهد بود. با افزایش تعداد، سطح راحتی کلی را کاهش می دهیم.
- عدد کوانتومی ازیموتال ل. این شکل اوربیتال را مشخص می کند و از 0 تا (n-1) متغیر است.
- عدد کوانتومی مغناطیسی متر. این تعداد جهت گیری های مختلف یک شکل معین را مشخص می کند و با (-l، 0، +l) تعریف می شود.
- عدد کوانتومی اسپین س، که می تواند 1/2 + یا -1/2 باشد.
اینها تنها مقادیری هستند که برای معادله موج شرودینگر راه حل ارائه می دهند.
بنابراین برای n=1، اعداد کوانتومی، n=1، l=0، m = 0 و spin = 1/2 + یا 1/2- یا بیشتر به طور خلاصه به دست میآوریم. [1 0 0 +1/2] و [1 0 0 –1/2]
خودشه. دو الکترون اگر بخواهیم الکترون های بیشتری اضافه کنیم باید n را افزایش دهیم. این مانند این است که صندلی های اتوبوسمان را پر کنیم و سپس گروه بعدی مسافران را به راهرو اضافه کنیم.
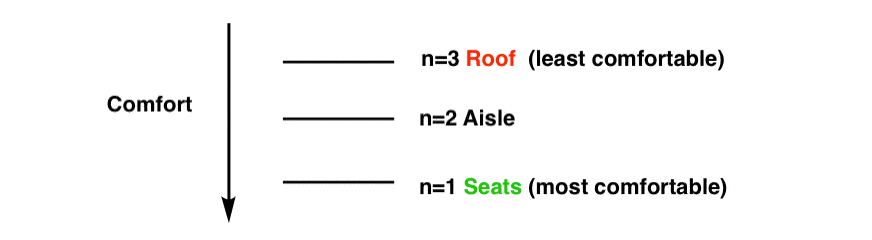
مجموعه بعدی الکترون “مسافران” باید به راهرو بروند، جایی که n=2.
برای n = 2، ل=0، برای مجموع دو الکترون 2 0 0 +1/2 و 2 0 0 –1/2 به دست می آوریم.
وقتی n=2 می توانیم اجازه دهیم ل = 1. این را تماشا کنید:
[2 1 1 +1/2]
[2 1 1 – 1/2]
[2 1 0 +1/2]
[2 1 0 –1/2]
[2 1 –1 +1/2]
[2 1 –1 –1/2].
بنابراین برای n=2 در مجموع 8 الکترون داریم: 2 برای ل= 0 و 6 برای ل=1. اگر بخواهیم الکترون های بیشتری اضافه کنیم، باید n را دوباره افزایش دهیم (به 3) که مانند پر کردن راهروی اتوبوس و فرستادن گروه بعدی مسافران به سقف است.
بیایید یک لحظه اینجا توقف کنیم. اعداد مختلف ل=0 و ل=1 مربوط به اشکال مختلف اوربیتال است. در عمل ما برای آنها نام داریم. آنها اوربیتال های S و P هستند.
اوربیتال ها شبیه کره هستند. چگونه این را بدانیم؟ از معادله موج این واقعیت که m=0 یک سرنخ است – به این معنی است که فقط یک جهت در تمام محورها ممکن است، که فقط برای یک کره ممکن است.
اوربیتال های p شبیه قطرات اشک هستند. باز هم ما این را از معادله موج می دانیم. جالب اینجاست که ما می توانیم 3 مقدار مختلف برای m داشته باشیم. در عمل منظور این است که 3 روش مختلف برای جهت دهی اوربیتال ها وجود دارد – در امتداد سه محور مختلف x، y و z.
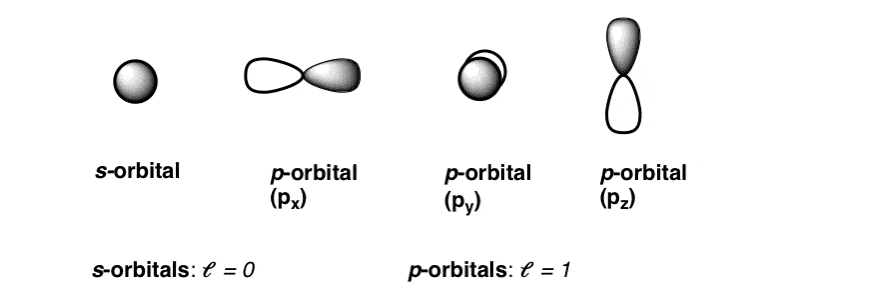
در Org 1 و Org 2 به طور انحصاری با اوربیتال های s و p سروکار خواهیم داشت. همانطور که به زودی خواهیم دید، شکل ها پیامدهای فوق العاده ای برای پیوند شیمیایی دارند.
سطوح بالاتر چطور؟ همچنین اشکال مختلفی از اوربیتال ها برای ل=2 و ل=3. برای ل2 =، اینها اوربیتالهای d نامیده می شوند که در سری فلزات واسطه یافت می شوند و 5 جهت متفاوت برای این اوربیتالها وجود دارد (m=2,1,0,-1,-2). برای ل=3، اوربیتال های f وجود دارد که در لانتانیدها و اکتینیدها یافت می شوند و 7 جهت مختلف برای این اوربیتال ها وجود دارد.
اگر دوره های بالاتر را بگذرانید، در مورد سری مداری d بیشتر خواهید آموخت، زیرا فلزات واسطه کاربردهای مهم زیادی در شیمی آلی دارند. شیمی اوربیتال های d بسیار جذاب است. در مقابل، شیمی اتمهایی که بلوک f را در بر میگیرند، بسیار شبیه به هم هستند، زیرا در این نقطه، الکترونها واقعاً از هسته دور هستند و بنابراین به مراتب کمتر متمایز میشوند. به همین دلیل است که لانتانیدها اغلب به صورت مخلوط یافت می شوند – اغلب مشکل جداسازی مواد معدنی آنها از یکدیگر است.
اوربیتالهای بالاتر از آن (g، h و غیره) واقعاً در شیمی ظاهر نمیشوند، زیرا هستههای بسیار سنگینی که شما نیاز دارید (بیش از 120) بسیار ناپایدار هستند. شخصی یک جدول تناوبی توسعه یافته ارائه کرده است که عناصر بلوک g را در خود جای داده است. زیبا! – اما بیشتر جنبه نظری دارد تا عملی. آن را با اتوبوس هندی ما مقایسه کنید – میتوانید به اضافه کردن سکوها در بالای اتوبوس ادامه دهید تا سطوح متوالی مسافران را در خود جای دهد، اما به نقطهای میرسد که همه چیز زیر وزن خودش فرو میریزد.
پست بعدی – از ژنرال شیمی تا شیمی آلی، قسمت 3 – شارژ هسته ای موثر
