از ویکی نقل قول:
قانون صفر ترمودینامیک: شما باید بازی را انجام دهید
قانون 1: شما نمی توانید برنده شوید
قانون دوم: در یک روز بسیار سرد، شما می توانید به هم بزنید
قانون سوم: هرگز آنقدر سرد نمی شود
قانون دوم ترمودینامیک: Δ G = Δ H – T Δ S.
(من یک توصیف بسیار طولانی از این قانون نوشتم و متوجه شدم که احتمالاً بیش از حد است. اما من آن را نوشتم، بنابراین آن را درج خواهم کرد. اگر قبلاً تا حدودی با ترمودینامیک راحت هستید، به خط پانچ در پایان بروید، “چگونه قانون دوم ترمودینامیک در مورد شیمی آلی کاربرد دارد.
ما در مورد مفهوم آنتالپی (گرما) و چگونگی گرماده بودن برخی واکنش ها (تولید گرما) و گرماگیر (جذب گرما) صحبت کرده ایم. به عنوان مثال، یک مثال برجسته از واکنش گرمازا، احتراق هیدروژن با اکسیژن برای تولید آب است. این 276 کیلوژول بر مول تولید می کند.
در روزهای اولیه شیمی و فیزیک، توجه زیادی به توسعه موتورهای بخار داده شد، که در آن از احتراق چوب یا زغال سنگ (یک واکنش گرمازا دیگر) برای جوشاندن آب استفاده می شود. در یک سیستم بسته، بخار پرفشار حاصل را میتوان برای انجام کار بر روی یک چرخ دستی یا برخی ابزارهای دیگر استفاده کرد و انقلاب صنعتی متولد شد. [Recall that a mole of water (18 mL) occupies 22.4 L as a gas at room temperature and even more at 100° C – that’s a lot of pressure! ] نیازی به گفتن نیست که انفجار در روزهای اولیه بخار رایج بود.
خلاصه داستان: کاری که از این نوع فرآیندها دریافت می کنید هرگز با انرژی وارد شده برابری نمی کند (قانون اول: “شما نمی توانید برنده شوید”). در دهه 1870 بود که گیبس (در میان دیگران) تشخیص داد که فرد باید مقدار معینی از انرژی “غیر مفید” را که در طی این فرآیندها تلف می شود، محاسبه کند، که بعداً به عنوان “آنتروپی” تعریف شد. انرژی باقیمانده – که برای انجام کار در دسترس است – “انرژی رایگان” یا همانطور که اکنون آن را “انرژی گیبس” می نامیم نامیده می شود. در اینجا معادله مربوطه آمده است:
Δ G = Δ H – T Δ S
این قانون دوم ترمودینامیک است که به اشکال مختلف نوشته شده است (به بالا مراجعه کنید) اما به تعبیر مورد علاقه من چنین می گوید: “انرژی از همه نوع در دنیای مادی ما به طور خود به خود پراکنده یا پخش می شود اگر مانع انجام آن نشود.” .
در شیمی آلی، درک شهودی از این معادله و درک مفاهیم آن در انواع خاصی از واکنش ها مهم است. در حالی که اثرات آنتالپی درک تغییرات معمولاً نسبتاً آسان است، به راحتی می توان آن را قطع کرد آنتروپی و انرژی گیبس
آنتروپی
به یاد داشته باشید که همه مواد در حرکت ثابت هستند و ذرات دائماً با سرعت زیاد با یکدیگر برخورد می کنند. درجه حرارت اندازه گیری سرعت حرکت این مولکول ها است. و در صفر مطلق، تمام حرکات متوقف می شود. یک قطره رنگ که در یک لیوان آب قرار می گیرد به آرامی به رنگ روشن تری محو می شود. هوا در لاستیک های خودرو به آرامی به جو نشت می کند. یک تکه یخ خارج شده از فریزر به آرامی در یک گودال کوچک ذوب می شود. همه این فرآیندها نتیجه برخورد ذرات با یکدیگر، تبادل انرژی در فرآیند و در نهایت رسیدن به تعادل است.
یکی از تعابیر آنتروپی (به معنای شیمیایی) به شرح زیر است:
«تغییر آنتروپی پراکندگی انرژی را اندازهگیری میکند: چقدر انرژی در یک فرآیند خاص پخش میشود، یا چقدر گسترده میشود (در یک دمای خاص).»
اگر به این موضوع از نظر اشکال ماده فکر کنید، درک شهودی آن کار سختی نیست که آنتروپی یک ترکیب معین با تبدیل آن از جامد به مایع به گاز افزایش می یابد: ذرات در یک منطقه وسیع تری پخش می شوند (البته در دمای معین).
به طور مشابه، اگر یک مولکول مانند H2 را بگیرید و آن را به دو مولکول H تقسیم کنید، پراکندگی انرژی افزایش خواهد یافت، از آنجایی که شما دو برابر بیشتر از قبل ذرات با یکدیگر برخورد خواهید کرد. بنابراین این نیز منجر به افزایش آنتروپی می شود.
بنابراین آنچه قانون دوم به ما می گوید این است که اگر آنتالپی یک فرآیند را علاوه بر آنتروپی محاسبه کنید، می توانید انرژی گیبس، ΔG را محاسبه کنید.
در Gen Chem یاد گرفتید که اگر مقادیر H و S به شما داده شده باشد، چگونه این معادله را برای محاسبه Δ G یک فرآیند به کار ببرید. اگر برای رخ دادن نیاز به کار دارد (زمانی که Δ G مثبت است.)
با این حال، معادله چیزی در مورد نرخ ها به شما نمی گوید. مندر شیمی، “خود به خودی” به معنای “روزی، اما نه لزوما در حال حاضر” است.. واکنش سلولز (چوب) با اکسیژن برای دادن CO2 و H2O (و گرما) بسیار خود به خود است، اما جنگلهای ما زنده میمانند زیرا فرآیند شیمیایی سوزاندن برای شروع به انرژی فعالسازی خاصی نیاز دارد.
نحوه اعمال قانون دوم در شیمی آلی
نکته کلیدی اینجاست. برای هر فرآیندی که منجر به افزایش آنتروپی شود، افزایش دما در نهایت منجر به خودبخودی (ترمودینامیکی) آن می شود. به دلیل اصطلاح TΔS، در دماهای بالا، هر فرآیندی که آنتروپی را افزایش دهد رویداد استمعمولاً بر معادله گیبس مسلط خواهد شد.
دو نوع فرآیند در Org1/Org2 وجود دارد که در عمل آن را مشاهده خواهید کرد:
1) واکنش های تکه تکه شدن
2) واکنش هایی که گازها را تشکیل می دهند.
بیایید ابتدا در مورد واکنش های پراکندگی صحبت کنیم. هر فرآیندی که تعداد خالص موجودات شیمیایی را افزایش دهد (مثلاً واکنش های تکه تکه شدن) دارای ΔS مثبت است، زیرا تعداد کل برخوردهای بین مولکولی (و در نتیجه آنتروپی) به شدت افزایش می یابد. واکنش های تکه تکه شدن یک مثال خاص است. کراکینگ حرارتی فرآیندی است که توسط صنعت پتروشیمی برای تبدیل هیدروکربن های با زنجیره بلند کم ارزش به هیدروکربن های با زنجیره کوتاه با ارزش بالاتر استفاده می شود. معمولاً در دماهای بسیار بالا انجام می شود. به عنوان مثال، می توانید بوتان را برای به دست آوردن مولکول های کوچکتر متان و پروپن گرم کنید.
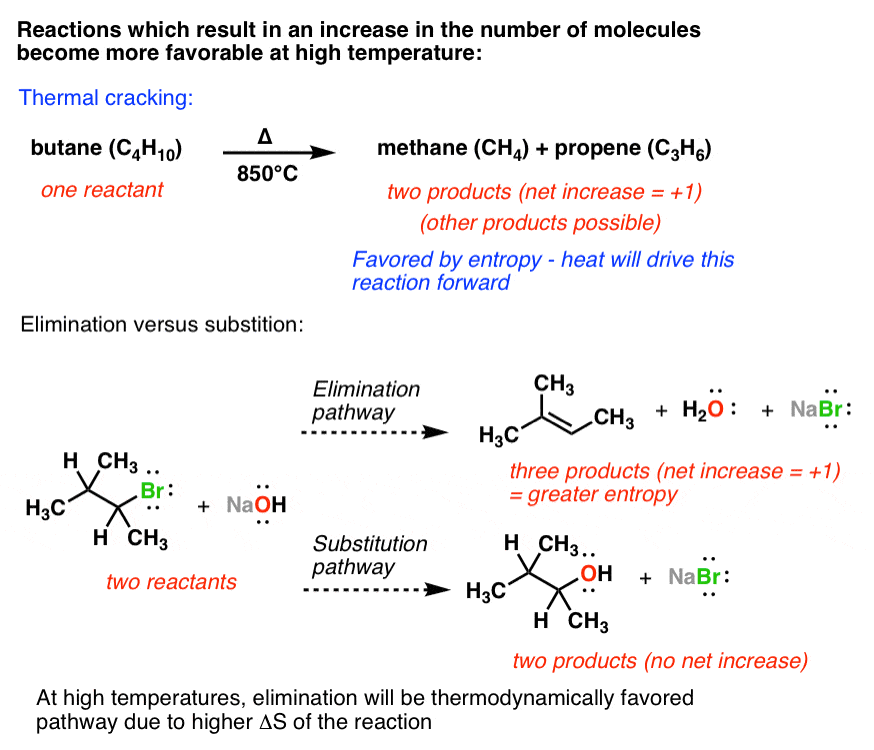
مثال دیگر واکنشی است که در Org 1 با آن مواجه خواهید شد به نام واکنش E2، که زمانی است که یک باز با یک آلکیل هالید واکنش می دهد و یک آلکن ایجاد می کند. توجه داشته باشید که در این فرآیند از دو نهاد به سه موجودیت رسیده ایم، که منجر به افزایش آنتروپی خواهد شد.
یکی از واکنش هایی که با آن رقابت می کند واکنش SN2 است (که بعداً با آن آشنا خواهید شد) که سایر محصولات را تشکیل می دهد. چند محصول در اینجا شکل می گیرد؟ دو؛ هیچ تغییر خالصی در تعداد مولکول ها وجود ندارد.
کدام یک از این دو فرآیند آنتروپی بالاتری خواهد داشت؟ E2. بنابراین، کدام یک در دمای بالاتر مطلوب خواهد بود؟ درست است – E2، زیرا عبارت TΔS شروع به تسلط بر معادله خواهد کرد.
واکنش هایی که گازها را تشکیل می دهند نمونه دیگری است. فرآیندی که منجر به تشکیل گاز از مایع یا جامد می شود، آنتروپی خالص مثبت خواهد داشت و در نتیجه دمای بالا مورد پسند قرار می گیرد.
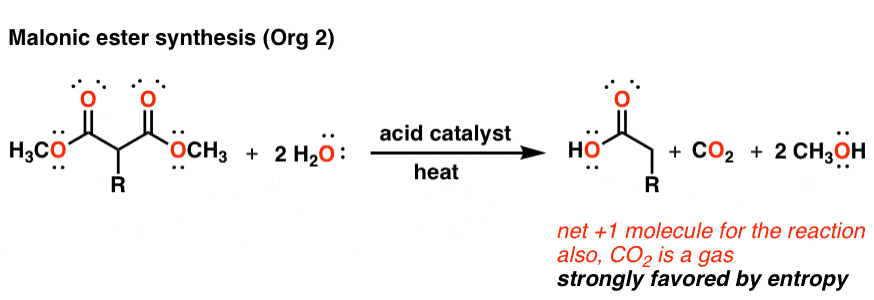
یک مثال واکنشی است که در سازمان 2 با آن مواجه خواهید شد به نام دکربوکسیلاسیون. وقتی مولکول هایی مانند این مشتق مالونات (نشان داده شده) را در حضور اسید آبی تا دمای کافی بالا گرم می کنید، آنها به طور خود به خود گاز دی اکسید کربن را از دست می دهند تا اسید کربوکسیلیک را در اختیار شما قرار دهند. این مثال خاص سنتز استر مالونیک نامیده می شود. تشکیل گاز مقدار زیادی از عبارت آنتروپی را در این واکنش ایجاد می کند. توجه داشته باشید که این نیز یک واکنش تکه تکه شدن است، بنابراین آن را نیز دارد.
پست بعدی: از ژنرال شیمی تا شیمی آلی، قسمت 12 – سینتیک
