احتمالاً در هیچ جای دیگری تضاد بین ماهیت عمدتاً کمی Gen Chem با ماهیت (نسبتا) کیفی Org Chem بیشتر از موضوع ترمودینامیک آشکار نمی شود. در حالی که شما احتمالاً زمان زیادی را در ژنرال شیمی صرف کشف گرمای شکلگیری، تفاوتهای انرژی آزاد و پتانسیلهای الکتروشیمیایی کردهاید، این نوع چالشها عمدتاً در سازمان شیمی مقدماتی وجود ندارند. با این حال، فقط به این دلیل که انواع خاصی از سوالات مطرح نمی شوند به این معنی نیست که مفاهیم کلیدی از بین رفته اند. درک معنای برخی معادلات کلیدی ترمودینامیکی و بکارگیری آنها به معنای شهودی در واکنشهای شیمی آلی هنوز بسیار مهم است.
امروز ما در مورد قانون هس صحبت خواهیم کرد و در طی چند روز آینده با پایان دادن به این مجموعه با بحث در مورد سینتیک شیمیایی و تعادل شیمیایی، با برخی معادلات کلیدی دیگر خواهیم پرداخت.
قانون هس
انرژی در جهان ثابت است. نه ایجاد می شود و نه از بین می رود، فقط شکلش را تغییر می دهد. آنتالپی (حرارت) منتشر شده (یا جذب شده) در یک واکنش برابر است با آنتالپی تشکیل محصولات منهای آنتالپی تشکیل واکنش ها. از این رابطه به عنوان قانون هس یاد می شود. این نسخه طبیعی معادله حسابداری است: سود (زیان) = درآمد – هزینه. با این حال، هنگامی که با آنتالپی سروکار داریم، آزاد شدن انرژی گرمایی (یک فرآیند گرمازا) با علامت منفی نشان داده می شود، در حالی که فرآیندهایی که انرژی جذب می کنند (فرایندهای گرماگیر) علامت مثبت را حفظ می کنند. به هر حال، این در مورد انرژی آزاد گیبس، دلتا جی نیز صدق می کند.
ΔH (واکنش) = ΔH (محصولات) – ΔH (واکنش دهنده ها)
آنتالپی چیزی است که به عنوان تابع حالت شناخته می شود، به این معنی که تغییر در آنتالپی مستقل از مسیر طی شده است. شهودی است که آنتالپی را به عنوان ارتفاع تصور کنیم، با هر اتم/مولکول در یک “ارتفاع” ثابت، که نشان دهنده گرمای استاندارد تشکیل آن است. فاصله بین آپارتمان من در اورشلیم (2600 فوت بالاتر از سطح دریا) که محل زندگی من است و دریای مرده در حدود 90 دقیقه (1200 فوت زیر سطح دریا) ثابت است – 3600 فوت. وقتی از اورشلیم به دریای مرده میروم، 3600 فوت پایین میروم، چه با پای پیاده، چه با هلیکوپتر یا از طریق یک سفر جانبی به کوه اورست. این نتیجه خالص است که مهم است. میتوانید با ارز قیاس کنید: دادگاههای ورشکستگی به شما اهمیتی نمیدهند استفاده شده برای میلیونر شدن، آنها به مقدار پول شما اهمیت می دهند اکنون.
همانطور که ارتفاع نسبت به سطح دریا اندازه گیری می شود، آنتالپی به طور مستقیم اندازه گیری نمی شود، بلکه از طریق اندازه گیری تغییرات اندازه گیری می شود. به عنوان مثال، ممکن است فکر نکنید که کلرید سدیم، NaCl، ترکیب بسیار قابل توجهی است. اگر این (واکنش سدیم مذاب با گاز کلر) را ببینید، ممکن است هیجان انگیزتر باشد. انرژی زیادی در نمک غذای شما محدود شده است! از طرف دیگر، میتوانید NaCl را به هر تعداد از راههای دیگر، شاید کمتر هیجانانگیز، تشکیل دهید – مانند واکنش هیدروکسید سدیم جامد با اسید کلریدریک. با این حال، مهم نیست که کدام مسیر را برای ساختن NaCl طی می کنید، این ترکیب از هر نظر یکسان است. آنتالپی تشکیل NaCl مستقل از نحوه ساخت آن است.
چگونه این مفاهیم را در شیمی آلی به کار ببریم؟
در اینجا یک واکنش نسبتاً ساده است که در Org 1 خواهید آموخت، به نام هیدروژناسیون. در این واکنش ما یک الفین بسیار ساده (آلکن، در این مورد اتن) را با گاز هیدروژن روی یک کاتالیزور (معمولا پالادیوم روی زغال چوب، که به صورت Pd/C نشان میدهیم) درمان میکنیم. نتیجه یک هیدروکربن اشباع (اتان) است. گرمای تشکیل هر دوی این ترکیبات توسط دانشمندان بی باک قبل از ما اندازهگیری شده است، بنابراین میتوانیم مقادیر را در جدول نگاه کنیم و از قانون هس برای محاسبه ΔH برای واکنش به صورت زیر استفاده کنیم:
Δ H (واکنش) = Hf (محصول) – Hf (واکنش دهنده).
در مورد هیدروژنه کردن اتیلن، این مقدار 140 کیلوژول بر مول خواهد بود.
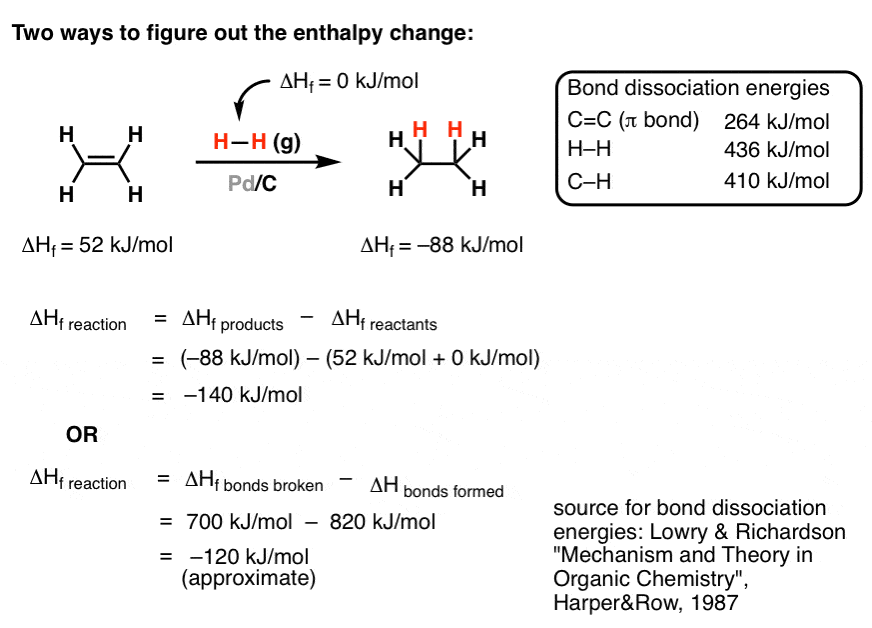
در اینجا جنبه دیگری وارد می شود. در بسیاری از مواقع در شیمی آلی، ما با ترکیباتی سروکار خواهیم داشت که اتفاقاً از گرمای تشکیل آنها اطلاعی نداریم. اما یک راه مفید برای حل این معضل وجود دارد. آنتالپی کل مولکول را می توان با بررسی آنتالپی پیوندهای منفرد تخمین زد. ما میتوانیم ترمودینامیک این فرآیند را با اعمال جدولی از انرژیهای استاندارد تفکیک پیوند بشکنیم. برای یک جدول کاملاً کامل، اینجا را کلیک کنید. انرژی های تفکیک پیوند “استاندارد” به مقدار متوسط انرژی های پیوند اندازه گیری شده از همان نوع پیوند در مولکول های مختلف اشاره دارد. از آنجایی که ما در حال اندازه گیری تغییرات نسبی انرژی هستیم، فقط به انرژی پیوندهایی که در حال شکستن یا شکل گیری هستند اهمیت می دهیم. (و این فرض را نسبتاً مطمئن داشته باشید که سایر اوراق قرضه تأثیر چندانی بر فرآیند ندارند). به عنوان مثال، در مورد ما یک C=C را می شکنیم π پیوند (توجه داشته باشید – فقط شکستن پیوند دوگانه، نه هر دو پیوند!) و یک پیوند تک HH. جدول به ما می گوید که مقادیر اینها به ترتیب 264 کیلوژول بر مول و 436 کیلوژول بر مول هستند. این همان چیزی است که واکنش “هزینه” دارد. آنچه “به دست آمده” انرژی دو پیوند CH است (هر پیوند تقریباً 410 کیلوژول بر مول).
ما از معادله Δ H (واکنش) = Δ H (پیوندهای شکسته) – Δ H (پیوندهای تشکیل شده) استفاده می کنیم. ما اوراق قرضه شکسته قرار داده است اولین زیرا شکستن پیوندها یک امر است گرماگیر فرآیند – به انرژی نیاز دارد. تشکیل اوراق قرضه است گرمازا فرآیند (انرژی آزاد می کند) و در نتیجه علامت منفی در مقابل خود دارد.
هنگامی که ما محاسبه را انجام می دهیم، مقدار -120 کیلوژول بر مول یا آزاد شدن 120 کیلوژول بر مول انرژی گرمایی در این فرآیند داریم. در حدود 15٪ از مقدار استاندارد، بنابراین تخمین وحشتناکی نیست. به دلیل برخی اثرات کوچک مشارکتی، پاسخ دقیق نیست، اما این یک راه عالی درجه اول برای فهمیدن اینکه آیا واکنش مطلوب است یا خیر است. [a note of caution – bond dissociation energies generally represent homolytic bond cleavage (i.e. each atom obtains one electron), while many processes in organic chemistry go through heterolytic processes (one atom receives 2 and the other zero) – but the point stands]. اگر متوجه شدید که یک پیوند واقعا قوی را شکسته اید – برای مثال C-F – احتمالاً مشکلی پیش آمده است.
پست بعدی – از ژنرال شیمی تا شیمی آلی، قسمت 11 – قانون دوم
