سینتیک شیمیایی مطالعه سرعت واکنش است. این می تواند در کشف مکانیسم های واکنش های شیمیایی بسیار مهم باشد. در اینجا نکات ضروری از آنچه باید در مورد سینتیک شیمیایی به خاطر بسپارید، وجود دارد که از ژن شیمی به شیمی آلی میروید.
1. سرعت واکنش متناسب با غلظت و دما است.
اول از همه، واکنش های شیمیایی زمانی رخ می دهد که برخورد بین اتم ها یا مولکول ها رخ می دهد و در نتیجه تغییری در آرایش پیوندهای شیمیایی ایجاد می شود. بنابراین، سرعت یک واکنش متناسب با تعداد برخورد بین مولکول ها است. هر برخوردی منجر به یک واکنش شیمیایی نمی شود. از تعداد کل برخوردها، تنها درصد معینی در انرژی مناسب رخ می دهد تا فرآیندهای شکستن و تشکیل پیوند شیمیایی رخ دهد. به بازاریاب تلفنی فکر کنید که چاقوهای گینسو را می فروشد – تنها درصد کمی از تماس هایی که او انجام می دهد منجر به فروش می شود، اما کل فروش متناسب با تعداد تماس ها خواهد بود.
در واکنش های شیمیایی، هر چیزی که سرعت برخورد را افزایش دهد، سرعت واکنش را افزایش می دهد. یکی از راه های انجام این کار افزایش تمرکز است. یکی دیگر از این موارد افزایش دما است – ممکن است به یاد داشته باشید که آنچه را که “دما” می نامیم را می توان به عنوان معیار حرکت اتمی و مولکولی در نظر گرفت.

2. واکنش های مرتبه اول و دوم
بسته به نوع واکنش، یک یا دو گونه شیمیایی می توانند در دگرگونی نقش داشته باشند. واکنشهایی که بیش از دو گونه شیمیایی را شامل میشود، تقریباً هرگز دیده نمیشود، زیرا احتمال برخورد سه گونه در آن واحد با انرژی مناسب وجود ندارد.
را سفارش از یک واکنش تعداد گونه های درگیر در واکنش است.
را نرخ یک واکنش عبارت است از تعداد مولکول های یک ترکیب در واحد حجم در ثانیه، همانطور که در M/L•s بیان می شود. اگر رابطه تناسب، نرخ را در نظر بگیریم، می توانیم برای این معادله بنویسیم [fish] conc، و با وارد کردن یک k ثابت به نام ثابت سرعت، به یک معادله تبدیل میشوند. هر واکنشی یک ثابت سرعت منحصر به فرد دارد که در دمای ثابت معتبر است، که منطقی است زیرا افزایش دما باعث افزایش تعداد برخوردها و منجر به نرخ متفاوت می شود.

برای یک تک مولکولی واکنشی که فقط یک گونه A را شامل می شود، سرعت برابر با k خواهد بود[A] جایی که [A] غلظت A در mol/L است. برای یک واکنش دو مولکولی A+B، سرعت برابر با k خواهد بود[A][B] جایی که [A] و [B] غلظت A و B هستند.
به عنوان مثال در واکنش SN1، که در Org 1 با آن آشنا خواهید شد، اولین گام شکستن یک پیوند ضعیف برای ایجاد یک هالید (برمید در این مثال) و یک کربوکاتیون است. این یک واکنش تک مولکولی مرتبه اول است. میتوانیم یک ثابت سرعت برای این واکنش به صورت نرخ = k بنویسیم [A]
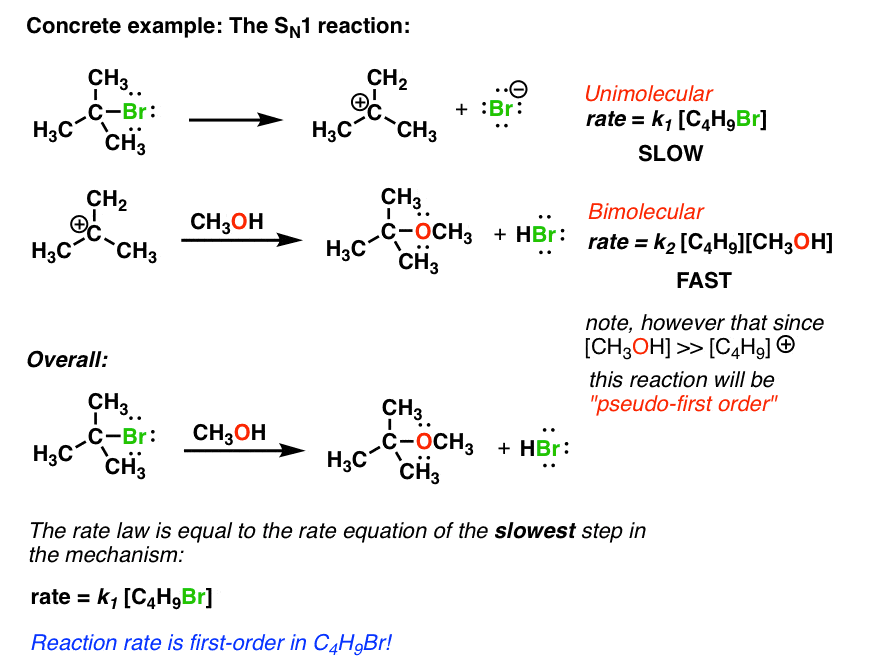
مرحله دوم شامل واکنش کربوکاتیون با یک مولکول حلال (مثلاً متانول) برای تهیه یک اتر است. این یک واکنش مرتبه دوم است. البته در اینجا توجه داشته باشید که از آنجایی که غلظت متانول بسیار زیاد است (این حلال است) غلظت آن تحت تأثیر مقدار کمی متانول مصرف شده در این واکنش نخواهد بود. بنابراین سرعت واکنش واقعاً فقط به غلظت کربوکاتیون C4H9 بستگی دارد. این نمونه ای از الف است واکنش شبه مرتبه اول
اگرچه نمونههای زیادی از واکنشهایی وجود دارد که فقط یک تبدیل کلی را شامل میشود (مثلاً HCl + NaOH برای ایجاد آب)، شما به سرعت در شیمی آلی کشف خواهید کرد که واکنشهایی مانند SN1 که بیش از یک مرحله را طی میکنند بسیار رایجتر هستند. به دنباله ای از واکنش هایی که منجر به یک محصول خاص می شود، می گویند مکانیسم واکنش
3. سرعت یک واکنش با کندترین مرحله تعیین می شود.
نکته ای که در مورد سرعت واکنش وجود دارد این است: آنها با سرعت کندترین گام تعیین می شوند. بنابراین در مثال SN1 بالا، از آنجایی که اولین واکنش گام آهسته است، میتوانیم سرعت واکنش را با قانون سرعت برای این مرحله تقریبی کنیم. بنابراین قانون سرعت کلی واکنش SN1، در بالا، نرخ نوشته شده است [C4H9OCH3] = k [C4H9Br]. به عبارت دیگر، سرعت تشکیل C4H9OCH3 در یک دمای معین مستقیماً با غلظت C4H9Br متناسب است و اصلاً به غلظت CH3OH بستگی ندارد.
4. قوانین نرخ می تواند بینشی در مورد مکانیسم ارائه دهد:
در اینجا یک نکته مفید وجود دارد: ما در واقع می توانیم از قوانین نرخ استفاده کنیم تا اطلاعاتی در مورد مکانیسم ها به ما بدهند. به عنوان مثال، واکنش SN1 در بالا بخشی از یک کلاس کلی از واکنشها به نام واکنشهای جایگزینی است. نوع دومی از مکانیسم جایگزینی به نام واکنش SN2 وجود دارد. مرحله تعیین سرعت SN1 تک مولکولی است و مرحله تعیین سرعت SN2 دو مولکولی است.
بیایید مثال خود را کمی از MeOH به نوکلئوفیل I (–) تغییر دهیم (به عنوان یک نمک یدید محلول مانند یدید پتاسیم).
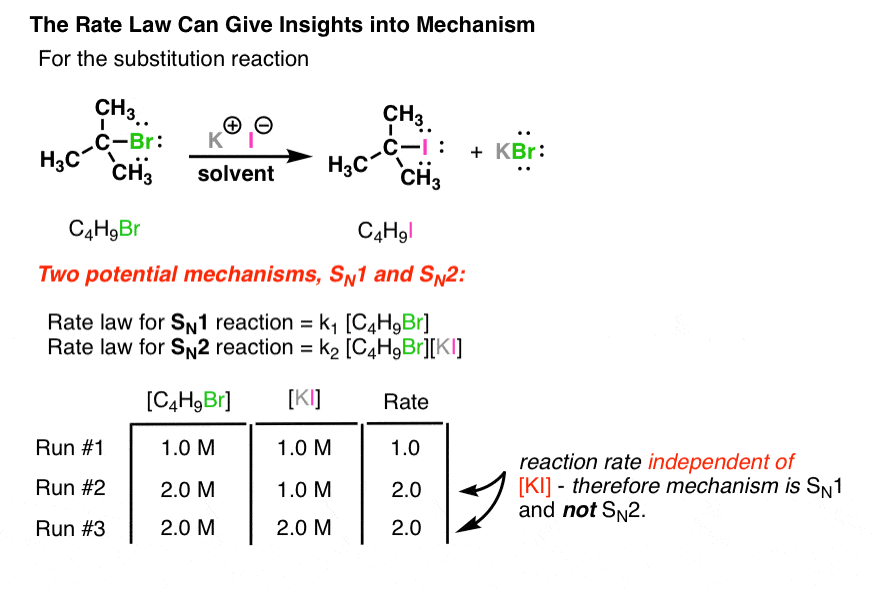
هر دو واکنش محصول یکسان C4H9I را به دست خواهند آورد. چگونه می توانیم بگوییم که کدام مکانیسم عمل می کند؟ ساده! اگر با تغییر غلظت یدید سرعت تغییر کند [I(-)] می دانیم که SN2 است و اگر تغییر نکند SN1 خواهد بود.
در این مثال، عدم تغییر نرخ زمانی که غلظت آن را دو برابر می کنیم [I (-)] به این معنی است که مکانیسم SN1 است (یا به عبارت دقیقتر، میشود رد کردن SN2، اما این بحث کاملاً دیگری است).
5. مانع واکنش نامیده می شود انرژی فعال سازی.
معلم شیمی فیزیک سال دوم من یک بار مفهوم انرژی فعال سازی را به طرز تکان دهنده ای برای ما روشن کرد و به ما گفت که از نظر ترمودینامیکی، سوزاندن گوشت انسان به CO2 و آب از نظر ترمودینامیکی بسیار مطلوب است، اما ادامه حضور ما در کلاس درس او باعث شد. گواهی بر وجود موانع فعال سازی نکته ای که او سعی داشت بیان کند این بود که ترمودینامیک یک فرآیند چیزی در مورد نرخ به شما نمی گوید.
را نرخ یک واکنش به مقداری به نام the بستگی دارد انرژی فعال سازی، که در اصل مقدار انرژی مورد نیاز برای رسیدن به یک حالت گذار است که منجر به تشکیل محصول می شود.
رابطه بین انرژی فعال سازی، دما و سرعت واکنش به شکل معادله آرنیوس به دست آمده است:

در این معادله k ثابت سرعت، T دما، R ثابت گاز، Ea انرژی فعالسازی است و حرف مرموز A چیزی است که به عنوان ثابت پیش نمایی شناخته میشود.
چیزی که به آن خلاصه می شود ثابت بودن نرخ است ک تعداد برخوردهایی است که منجر به واکنش در ثانیه می شود، آ تعداد کل برخوردهایی است که در هر ثانیه رخ می دهد و e^(Ea/rt) احتمال این است که هر برخورد معینی منجر به واکنش شود.
در اینجا یک قیاس بیسبال وجود دارد. تصور کنید که میخواهید معادلهای داشته باشید که تخمینی از تعداد رانهای خانگی در یک پارک مشخص به شما بدهد. میتوانید معادلهای شبیه این داشته باشید:
تعداد دفعات خانه = [total # of balls hit ] [ probability ball has enough energy for a home run]
“انرژی فعال سازی” در این مورد، فاصله از صفحه اصلی تا حصارهای بیرونی است، که بخشی از عبارت “درصد” خواهد بود (احتمالاً همراه با ارتفاع حصار). با عقب رانده شدن نرده ها، تعداد دفعات خانه به ناچار کاهش می یابد. اگر میخواهید، میتوانید راهی پیدا کنید که این معادله را مجدداً تنظیم کنید تا اگر تعداد توپها و انرژی لازم برای پاک کردن حصار را میدانید، فاصله تا حصار را بفهمید.
معادله آرنیوس بسیار قدرتمند است و به شما امکان می دهد مقدار انرژی فعال سازی و همچنین مقدار ثابت سرعت را در دماهای مختلف محاسبه کنید. در دوره تحصیلی خود، تردید وجود دارد که از شما خواسته شود تا بیش از حد عمیق به معادله آرنیوس بروید، اما همچنان مهم است که ظرافت های آن را درک کنید.
نکته پایانی – یک قانون مفید از معادله آرنیوس این است که سرعت واکنش به ازای هر 10 درجه افزایش دما دو برابر می شود.
پست بعدی – از ژنرال شیمی تا شیمی آلی، قسمت 13 – تعادل
