اول از همه، به چوپان ها برگردیم:
اکسیگیوس که شش گوسفند برای نگهداری داشت، دریافت که می تواند با دو پسر چوپان هایدروس که هر کدام یک گوسفند برای خود آورده اند، معامله کند. با انجام این کار، اکسیگیوس به تعهدات خود طبق قانون امپراتور اکتاویوس عمل کرد و هر یک از هیدروس ها در نگهداری یک جفت گوسفند با اوکسیگیوس شریک شدند.
یک روز یکی از پسران چوپان هیدروس به اکسیجیوس گفت که میخواهد این قرار را ترک کند. او می خواست گوسفند تنهایش را ببرد و برخی از سرزمین های تپه های دور را کاوش کند، همانطور که قبل از ملاقات با اکسیگیوس انجام می داد.
اکسیگیوس عصبانی شد. او گفت که یک معامله یک معامله است و هیدروس نمی تواند فقط وسایلش را جمع کند و با گوسفندانش برود. آنها توافق کرده بودند که گوسفندها را با هم تقسیم کنند و هیدروس باید این توافق را رعایت کند. : «نمیتوانی بروی. من آن را منع می کنم.»
در آن زمان بود که هایدروس جوان متوجه شد که گاهی راحت تر است که به ترتیبات وارد شود تا از آنها خارج شود. اگرچه او اسماً گوسفندان خود را با اکسیجیوس تقسیم می کرد، اما برای همه مقاصد، این گوسفند تحت کنترل اکسیجیوس بود. او وارد یک شراکت نابرابر شده بود و آنقدر قوی نبود که بتواند در مسابقه کشتی با چوپان قدرتمندتر پیروز شود.
بنابراین هیدروس تصمیم گرفت به هر حال به سمت مزارع دور برود، اما مجبور شد گوسفندان خود را با اکسیجیوس پشت سر بگذارد. با این حال، قبل از ترک، Oxygius یک امتیاز داد. او گردنبندی با (+) به او داد تا نشان دهد که او یک گوسفند بدهکار است، و اکسیگیوس گردنبند دیگری با (-) به گردن داشت تا نشان دهد که او یک سر اضافی در گله خود دارد.
اسیدها و بازها.
امروز در مورد اسیدیته و بازی Bronsted-Lowry صحبت خواهیم کرد و آن را به اسیدیته و بازی لوئیس تعمیم خواهیم داد، مفاهیمی که بدون شک در Gen Chem در مورد آنها آموخته اید اما ممکن است فراموش کرده باشید.
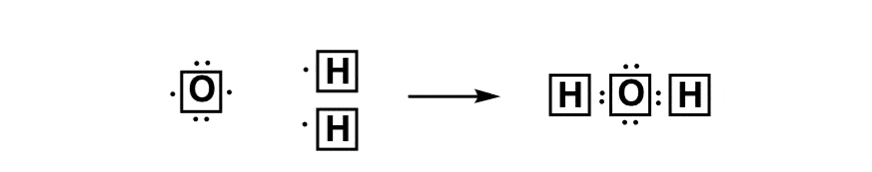
آخرین بار در مورد اینکه چه تعداد پیوند دارای اشتراک مساوی از الکترونها نیستند صحبت کردیم، اما در عوض شریک الکترونگاتیو بیشتر تمایل دارد که اکثریت چگالی الکترون را از شریک کمتر الکترونگاتی بگیرد. در مورد آب نیز چنین است، که در آن اکسیژن، که الکترونگاتیو تر است، دارای بار منفی جزئی است و هیدروژن، به دلیل کمبود الکترون، حاوی بار مثبت جزئی است. [This is the basis for hydrogen bonding, by the way – more about that later].
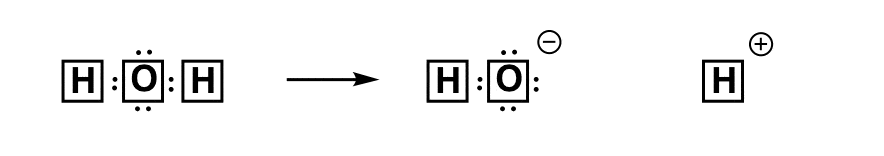
هنگامی که پیوند آب می شکند، دو راه وجود دارد که می تواند این کار را انجام دهد. ممکن است بشکند به صورت همولیتیک، که به موجب آن هر شریک یک الکترون به دست می آورد. راه دیگری که پیوند می تواند شکسته شود این است به صورت هترولیتیک، که در آن یک شریک هر دو الکترون پیوند را می گیرد و شریک دیگر هیچ یک را نمی گیرد و با یک بار مثبت باقی می ماند. دو راه وجود دارد که پیوند به صورت هترولیتیک شکسته شود. افبرش تر هترولیتیک، شریک الکترونگاتیو بیشتر بار منفی خواهد داشت و شریک الکترونگاتیو کمتر بار مثبت خواهد داشت.
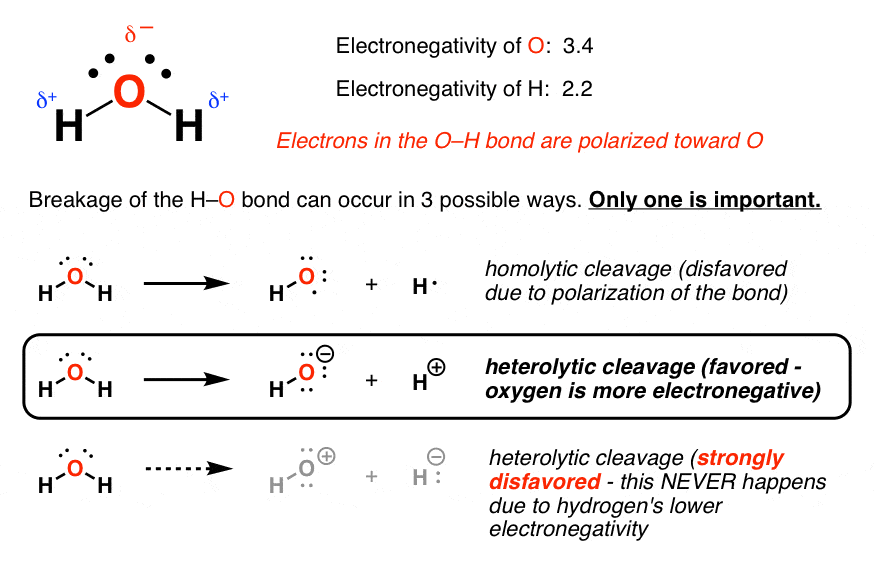
از آنجایی که الکترونگاتیوی H 2.2 است و بیشتر عناصر دیگر در سمت راست بالاتر هستند (F,O,N,Cl,Br,C,S,I) هیدروژن اغلب در موقعیت تا حدی مثبت است. هنگامی که پیوندهای حاوی H می شکند، تمایل به شکستن هترولیتیک دارند و H به صورت H+ خارج می شود.
یک کلمه برای این رفتار وجود دارد. به آن اسیدیته می گویند. اسیدیته برونستد در حقیقت.
اسید برونستد یک گونه شیمیایی است که می تواند H+ را اهدا کند. برعکس، پایه برونستد هر گونه شیمیایی است که بتواند H+ را بپذیرد.
نمونه هایی از اسیدهای برونستد قوی عبارتند از HCl، HBr، HI، H2SO4 و HClO4. هنگامی که یک اسید یک پروتون را از دست می دهد، چیزی را تشکیل می دهد که به آن می گویند پایه مزدوج. به طور کلی، اسیدهای برونستد قوی حاوی گونه ای هستند که به عنوان یک آنیون بسیار پایدار است. هنگامی که یک اسید برونستد با یک باز برونستد واکنش می دهد و یک گونه پروتونه ایجاد می کند، گونه پروتونه شده نامیده می شود. اسید مزدوج. به طور کلی، واکنش های باز اسیدی به گونه ای پیش می رود که اسید و باز واکنش نشان می دهند و اسید ضعیف تر و باز ضعیف تری می دهند. معیار اسیدیته pKa است که قبلاً به آن اشاره کرده ام، اما معیاری است که نشان می دهد یک گونه به راحتی با H+ تقسیم می شود.
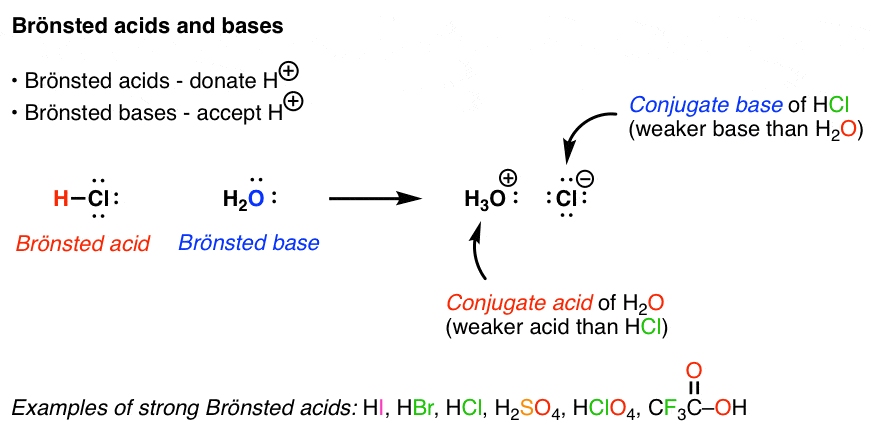
راه دیگری برای بررسی این واکنش وجود دارد. از آنجایی که میتوانید این قیاس را انجام دهید که جریانهای الکترون به علم شیمی همان چیزی است که جریانهای ارزی برای اقتصاد هستند، بررسی این موضوع مفید است. صرفاً بر اساس بررسی جریان الکترون ها. اگر به آنچه در مثال بالا اتفاق می افتد دقت کنید، خواهید دید که اکسیژن H2O یک جفت تنها به پروتون HCl اهدا می کند و پروتون جفت تنها را از اکسیژن می پذیرد. این یک روش مفید برای بررسی واکنشها است، زیرا انواع مشابه واکنشها (که شامل H+ نیستند فی نفسه) در شیمی بسیار رایج هستند، مانند واکنش BF3 با NH3:
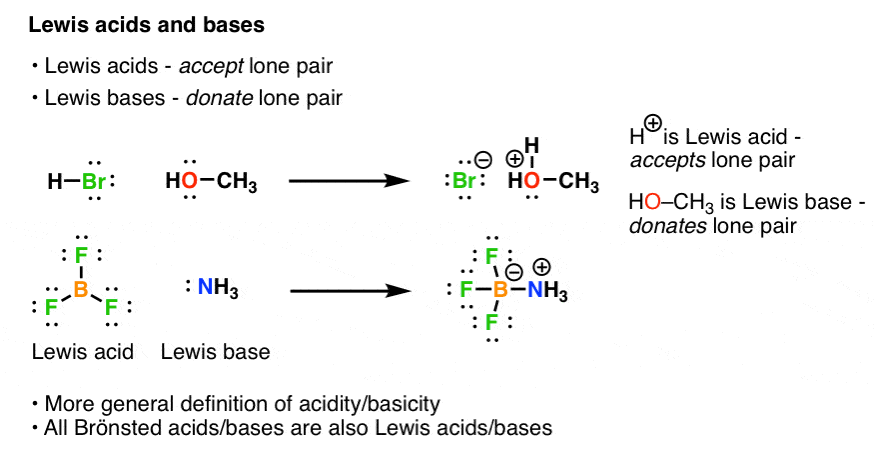
بنابراین گیلبرت لوئیس این مفهوم را تعمیم داد: در تعریف لوئیس، اسید لوئیس یک گونه شیمیایی است که یک جفت تنها را می پذیرد و یک پایه لوئیس گونه ای است که یک جفت تنها را اهدا می کند. این یک تعریف بسیار گسترده تر از اسیدیته/بازی است و ما بارها و بارها با آن مواجه خواهیم شد.
از نظر استعاری، حتی میتوانیم آن را بیشتر گسترش دهیم. باز لوئیس و اسید لوئیس در این تصویر چیست؟ (بله، این یک دوشاخه در سمت چپ است – همه چیز در اینجا کمی متفاوت است).

روابط دیگری نیز وجود دارد که می توانید استعاره را به آنها تعمیم دهید – دستکش، شمشیر- غلاف، کفش پا – لیست می تواند ادامه یابد. همانطور که خواهیم دید، واکنشهای بازها با اسیدها نمونههایی از حمله هستهدوستها به الکتروفیلها هستند، که یکی از مفاهیم کلیدی است که باید به منظور درک مجموعه وسیعی از واکنشهایی که در شیمی آلی ارائه میشوید، تسلط پیدا کنید.
گرفتن پیغام خانگی: تعاریف اسیدیته برونستد و لوئیس را درک کنید و تفاوت بین آنها را درک کنید.
پست بعدی – از ژنرال شیمی تا شیمی آلی، قسمت 10 – قانون هس